 | |
 Структура скелета полиэстрадиолфосфата (вверху) и мяч- и-стик модель эстрадиолфосфата (один мономер полиэстрадиолфосфата) (внизу) Структура скелета полиэстрадиолфосфата (вверху) и мяч- и-стик модель эстрадиолфосфата (один мономер полиэстрадиолфосфата) (внизу) | |
| Клинические данные | |
|---|---|
| Торговые наименования | Эстрадурин, Эстрадурин |
| Другие имена | PEP; Полимер фосфата эстрадиола; Эстрадиол-17β-фосфатный полимер; Полимер эстрадиола с фосфорной кислотой; Leo-114 |
| AHFS / Drugs.com | Международные названия препаратов |
| Беременность. категория |
|
| Способы введения. | Внутримышечная инъекция |
| Класс препарата | Эстроген ; Сложный эфир эстрогена |
| Код ATC | |
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетика данные | |
| Биодоступность | IM: Высокая |
| Связывание с белками | Эстрадиол: ~ 98% (с альбумином и SHBG ) |
| Метаболизм | В основном в печень, в меньшей степени почки, гонады и мышцы (по фосфатазам ) |
| метаболитов | Эстрадиол, фосфорная кислота и метаболиты эстрадиола |
| период полувыведения | ПКП: 70 дней (10 недель). Эстрадиол: 1– 2 часа |
| Экскреция | Моча (поскольку конъюгирует ) |
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem SID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL |
|
| Химиче ские и физические данные | |
| Формула | (C18H23O4P)n. (n = переменная; n = 13) |
| Молярная масса | Полимер : Переменная. Повторяемая единица : 334,347 г / моль |
| Точка плавления | от 195 до 202 ° C ( от 383 до 396 ° F) |
Полиэстрадиолфосфат (PEP ), продаваемый под торговой маркой Эстрадурин, представляет собой препарат эстроген, который используется в рак в основном для лечения простаты у мужчин. Он также используется женщинами для лечения рака груди, как компонент гормональной терапии для лечения низкого уровня эстрогена и менопаузы симптомы, и как компонент терапии феминизирующими гормонами для трансгендерных женщин. Его вводят путем инъекции в мышцу один раз в четыре недели.
Общие побочные эффекты ПКП включают головную боль, болезненность груди, развитие груди, феминизация, сексуальная дисфункция, бесплодие и вагинальное кровотечение. PEP представляет собой синтетический эстроген и, следовательно, является агонистом рецептора эстрогена, биологической мишенью эстрогены, такие как эстрадиол. Он представляет собой сложный эфир эстрогена в форме полимера и является пролекарством с очень длительным воздействием эстрадиола в организме. Время, необходимое для выведения из организма 50% дозы ПКП, составляет более двух месяцев. PEP работает путем преобразования в эстрадиол, он считается естественной и биоидентичной формой эстрогена. безопасности сложных эфиров парентерального эстрадиола, таких как PEP, значительно улучшен по сравнению с синтетическими пероральными эстрогенами, такими как этинилэстрадиол и диэтилстильбэстрол.
ПЭП был открыт примерно в 1953 году и представлен для медицинского применения в Штатах в 1957 году. Наряду с ундецилатом эстрадиола и валератом эстрадиола он часто использовался. в США и Европе в качестве парентеральной формы эстрогена для лечения мужчин с раком простаты. Однако он больше не доступен в США.
PEP используется в качестве внутримышечной инъекции для терапии эстрогенами рак простаты у мужчин. Он также используется для лечения рака груди у женщин возраста не менее 5 лет в постменопаузе. Кроме того, ПКП используется в заместительной гормональной терапии при низком уровне эстрогена из-за гипогонадизма или менопаузы у женщин. Он также используется в терапии феминизирующими гормонами для трансгендерных женщин. ПКП - это форма терапии высокими дозами эстрогена. После инъекции он очень медленно высвобождает активный агент эстрадиол в течение, по крайней мере, нескольких месяцев.
PEP сравнивали с комбинированной андрогенной блокадой (CAB; кастрация плюс флутамид ) для лечения рака простаты в большом рандомизированном клиническом исследовании с участием 915 пациентов. Через 18,5 месяцев не было разницы в выживаемости или сердечно-сосудистой токсичности между двумя методами лечения. Эти результаты предполагают предположить, что парентеральные формы эстрадиола могут иметь схожую и безопасность по сравнению с терапией депривации андрогенов (ADT) при лечении рак простаты. Кроме того, эстрогены могут иметь значительные преимущества по сравнению с ADT с зрения потери костной массы и переломов, приливов, сексуальной функции и качество жизни, а также значительная экономия средств на парентеральных формах эстрадиола по с терапией GnRH аналогом. С другой стороны, болезненность груди и гинекомастия очень часто при приеме эстрогенов, тогда как частота случаев низка при кастрации и CAB. Однако гинекомастия, вызванная эстрогенами, обычно бывает легкой или средней степени тяжести и обычно доставляет лишь умеренный дискомфорт. Кроме того, гинекомастию, вызванную эстрогенами, можно предотвратить с помощью профилактического облучения груди или можно вылечить с помощью мастэктомии.
ПЭП изучается для лечения рака простаты. в дозах 160 мг / месяц (три исследования) и 240 мг / месяц (четыре исследования). При дозировке 160 мг / мес ПЭП не полностью поддерживает уровни тестостерона, не достигает диапазона кастрации, и значительно уступает орхиэктомии в замедлении прогрессирования заболеваний. И наоборот, ПКП в дозировке 240 мг / мес приводит к большему подавлению тестостерона до диапазона кастрации, как и орхиэктомия, и по эффективности эквивалентен орхиэктомии.
При раке простаты у мужчин ПКП обычно назначают в доза от 80 до 320 мг каждые 4 недели в течение первых 2-3 месяцев для быстрого повышения уровня эстрадиола. После этого для поддержания эстрадиола доза обычно снижается до 40–160 мг каждые 4 недели на основании клинических данных и лабораторных уровней. При раке груди и низком уровне эстрогена у женщин дозировка составляет от 40 до 80 мг каждые 4 недели. Для трансгендерных женщин доза составляет от 80 до 160 мг каждые 4 недели.
ПЭП предоставляется в виде порошка или водного раствора в флаконы и ампулы отдельно или в комбинациях с мепивакаином и / или никотинамидом (витамином B 3 ) для введения через внутримышечная инъекция. Мепивакаин является местным анестетиком и используется для предотвращения ощущения жжения во время инъекции ПКП. Каждый флакон / ампула эстрадурина содержит 80 мг PEP, 5 мг мепивакаина гидрохлорида, 40 мг никотинамида и 2 мл воды.
противопоказания в основном включают PEP, такие же, как у эстрадиола, и включают:
Систематические исследования побочных эффектов <38 Общие или частные (>10%) побочные эффекты ПКП частично зависят от пола. эффекты включают головную боль, боль в животе, тошноту, сыпь, кожный зуд, потеря либидо, эректильная дисфункция, болезненность гр уди, гинекомастия, феминизация, демаскулинизация, бесплодие и вагинальные кровотечения или кровянистые выделения. Побочные эффекты, которые возникают изредка или нечасто (0,1–1%), включают задержку натрия и воды, отек, гиперчувствительность, напряжение груди, депрессия, головокружение, нарушение зрения, сердцебиение, диспепсия, узловатая эритема, крапивница и боль в груди. Все другие побочные эффекты ПКП считаются редкими.
Считается, что редкие (<0,1%) побочные эффекты ПКП включают прибавку в весе, нарушение толерантности к глюкозе, изменения настроения (приподнятость или депрессия ), нервозность, усталость, головная боль, мигрень, непереносимость контактных линз, гипертония, тромбоз, тромбофлебит, тромбоэмболия, сердечная недостаточность, инфаркт миокарда, рвота, вздутие живота, холестатическая желтуха, холелитиаз, временное повышение трансаминаз и билирубина, мультиформная эритема, гипигерпментация, мышечные спазмы, дисменорея, выделение из яичек, предменструальные симптомы, увеличение груди, <673 влаг>атрофия яичек, аллергические реакции (например, крапивница, бронхиальная астма, а нафилактический шок ) из-за мепивакаина и пример в месте инъекции (например, боль, стерильные абсцессы, воспалительные инфильтраты ).
As тромбоэмболические и другие сердечно-сосудистые осложнения, связанные в основном с синтетическими пероральными эстрогенами, такими как этинилэстрадиол и диэтилстильбестрол, они гораздо реже при парентеральном биоидентичных формах эстрогена, таких как PEP.
PEP оказывает нежелательное воздействие на факторы свертывания и, как полагают, повышают риск тромбов незначительно или не повышают вовсе. И это несмотря на то, что уровни эстрадиола достигли высоких концентраций, вплоть до 700 пг / мл при высоких дозах (320 / мес) ПКП. Это также контрастирует с пероральными синтетическими эстрогенами, такими как диэтилстильбестрол и этинилэстрадиол, которые вызывают заметное повышение факторов свертывания крови и высокую скорость образования тромбов при высоких дозах, используемых для достижений уровней кастрации тестостерон при раке простаты. Разница двумя типами терапии обусловлена биоидентичной и парентеральной природой PEP и ее минимальной на синтез белка в печени. На самом ПКП может снизить риск образования тромбов из-за снижения уровня определенных прокоагуляторных белков. Было обнаружено, что он снижает уровни антикоагулянтного антитромбина III, что может указывать на потенциальный риск тромбоэмболии и сердечно-сосудистых заболеваний. замечания. С другой стороны, ПЭП улучшенные уровни холестерина ЛПВП и снижают уровни холестерина ЛПНП, изменения, которые, как считается, защищают от ишемической болезни сердца. Оказывается, что ПКП может оказывать положительное влияние на здоровье сердечно-сосудистой системы при более низких дозах (например, 160 мг / день) из-за его положительного воздействия на уровни холестерина ЛПВП и ЛПНП, но они затмеваются при более высоких дозах (например, 240 Из-за к неблагоприятным дозозависимым мг эффектам на гемостаз, а именно к уровню антитромбина III.
Небольшие ранние пилотные исследования PEP при раке простаты у мужчин сердечно-сосудистой токсичности при терапии. Дозировка PEP 160 мг / месяц, по-видимому, не увеличивает риск сердечно-сосудистых заболеваний. Фактически, при этой дозировке наблюдалось потенциальное положительное влияние на смертность от сердечно-сосудистых заболеваний. Однако увеличиваются исследованиях было обнаружено, что ПКП в более высокой дозировке - 240 мг / месяц - увеличивает сердечно-сосудистую заболеваемость по сравнению с модуляторами гонадолиберина и орхиэктомией у мужчин. лечил им рак простаты. Увеличение сердечно-сосудистой заболеваемости при терапии нефатальных сердечно-сосудистых событий, включая ишемическую болезнь сердца и сердечную декомпенсацию, в частности сердечную недостаточность. Напротив, не было обнаружено, что ПКП увеличивает сердечно-сосудистую смертность по сравнению с модуляторами ГнРГ и орхиэктомией. Более того, было рандомизировано большее количество пациентов с ранее существовавшим сердечно-сосудистым заболеванием (17,1% против 14,5%; значимость не сообщается), и это, возможно, способствовало увеличению частоты сердечно-сосудистых заболеваний, наблюдаемых при ПКП. Некоторые исследования показывают, что повышенная сердечно-сосудистая заболеваемость при лечении ограничена в основном одним или двумя годами терапии, тогда как одно исследование показывает, что сердечно-сосудистая заболеваемость постоянно увеличивается на протяжении трех лет терапии. Долгосрочный анализ риска, рассчитанный на более чем 10 лет, показан, что сердечно-сосудистые риски. ПКП может быть обращены вспять с помощью длительного лечения и терапия может привести к значительному снижению сердечно-сосудистого риска по сравнению с модулятором гонадолиберина и орхиэктомией, хотя это не было подтверждено.
Сердечно-сосудистая токсичность PEP намного меньше, чем у пероральных синтетических эстрогенов, таких как диэтилстильбестрол и этинилэстрадиол, которые увеличивают риск венозной и артериальной тромбоэмболии, следовательно, увеличивают риск транзиторной ишемической атаки, нарушение мозгового кровообращения (инсульт) и инфаркта миокарда (сердечного приступа), что приводит к значительному увеличению смертности сердечно-сосудистых заболеваний. Считается, что относительно минимальная сердечно-сосудистая токсичность парентеральных форм эстрадиола, таких как ПКП и трансдермальные пластыри с эстрадиолом в высоких дозах, обусловлена их отсутствием влияния на факторы свертывания крови в печени.
Острая токсичность исследования не указали на риск возникновения острых побочных эффектов при передозировке ПКП. средняя летальная доза (LD 50) PEP для мышей составляет 700 мг / кг. PEP вводили в общих количествах от 2000 до 3000 мг в течение нескольких месяцев пациентам с раком без токсичности. Наиболее вероятным признаком передозировки является обратимая феминизация, а именно гинекомастия. Другие симптомы эстрогена передозировка могут включать тошноту, рвоту, вздутие живота, увеличение веса, задержка воды, болезненность болезненность, выделение из влагалища, тяжелые ноги и судороги ног. Эти побочные эффекты можно уменьшить, уменьшив дозу эстрогена. Специфического противоядия при передозировке ПКП не существует. Лечение передозировки PEP должно основываться на симптомах.
Известные потенциальные взаимодействия PEP в основном такие же, как и у эстрадиола, и включают:
Взаимодействие с ПЭП может быть меньше, чем с пероральными эстрогенами из-за отсутствия первое прохождения через печень.
 Эстрадиол, активная форма PEP.
Эстрадиол, активная форма PEP. PEP представляет собой сложный эфир эстрадиола в форме полимера и чр езвычайно пролекарство длительного действия эстрадиола. Таким образом, это эстроген, или агонист рецепторов эстрогена. PEP обладает антигонадотропным и функциональным антиандрогенным благодаря своей эстрогенной активности. Единственная повторяющаяся единица PEP, соответствующая эстрадиолфосфат у (минус OH 2), примерно на 23% выше молекулярной массы, чем эстрадиол из-за присутствия его C17β фосфатного эфира. ПЭП является пролекарством эстрадиола, он считается естественной и биоидентичной формой эстрогена.
ПЭП является сильным ингибитором несколькими ферментов, включая кислый фосфатазу, щелочную фосфатазу и гиалуронидазу, in vitro. В свете того факта, что фосфатазы, которые расщепляют ПЭП на эстрадиол и фосфорную кислоту, присутствуют в большинстве тканей организма, было сказано, что длительный период полувыведения и медленное высвобождение PEP несколько удивляет. Считается, что ПКП может подавлять свой собственный метаболизм.
| Эстроген | Форма | Доза (мг) | Продолжительность в зависимости от дозы (мг) | ||
|---|---|---|---|---|---|
| EPD | CICD | ||||
| Эстрадиол | Водн. раствор | ? | – | <1 d | |
| Раствор масла | 40–60 | – | 1–2 ≈ 1–2 d | ||
| Вод. сусп. | ? | 3,5 | 0,5–2 ≈ 2–7 дней; 3,5 ≈>5 дней | ||
| Микросф. | ? | – | 1 ≈ 30 дней | ||
| Бензоат эстрадиола | Масляный раствор | 25–35 | – | 1,66 ≈ 2–3 дня; 5 ≈ 3–6 d | |
| Вод. сусп. | 20 | – | 10 ≈ 16–21 d | ||
| Эмульсия | ? | – | 10 ≈ 14–21 d | ||
| Дипропионат эстрадиола | Масляный раствор | 25–30 | – | 5 ≈ 5 –8 дней | |
| валерат эстрадиола | Масляный раствор | 20–30 | 5 | 5 ≈ 7–8 дней; 10 ≈ 10–14 сут;. 40 ≈ 14–21 сут; 100 ≈ 21–28 d | |
| Эстрадиол бенз. бутират | Масляный раствор | ? | 10 | 10 ≈ 21 d | |
| Эстрадиолципионат | Масляный раствор | 20–30 | – | 5 ≈ 11–14 d | |
| Водн. суспензия | ? | 5 | 5 ≈ 14–24 дня | ||
| Эстрадиолэнантат | Масляный раствор | ? | 5–10 | 10 ≈ 20–30 дней | |
| Эстрадиолдиенантат | Масляный раствор. | ? | – | 7,5 ≈>40 дней | |
| Ундецилат эстрадиола | Масляный раствор | ? | – | 10–20 ≈ 40–60 дней;. 25–50 ≈ 60–120 дней | |
| Полиэстрадиолфосфат | Вод. раствор | 40–60 | – | 40 ≈ 30 дней; 80 ≈ 60 дн.;. 160 ≈ 120 d | |
| Estrone | Раствор масла | ? | – | 1-2 ≈ 2–3 d | |
| Водн. сусп. | ? | – | 0,1–2 ≈ 2–7 d | ||
| Эстриол | Раствор масла | ? | – | 1–2 ≈ 1–4 d | |
| Полиэстриолфосфат | Водн. солн. | ? | – | 50 ≈ 30 дн.; 80 ≈ 60 d | |
| Примечания и источники Примечания: Все водные суспензии имеют микрокристаллические частицы размером. Продукция эстрадиола во время менструального цикла составляет 30–640 мкг / день (всего 6,4–8,6 мг в месяц или цикл). Сообщается, что для созревания вагинального эпителия доза бензоата эстрадиола или валерата эстрадиола составляет от 5 до 7 мг / неделю. Эффективная ингибирующая овуляция доза ундецилата эстрадиола составляет 20–30 мг / мес. Источники: См. Шаблон. | |||||
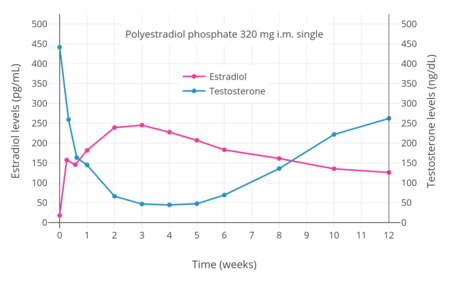
Уровни эстрадиола и тестостерона при однократной внутримышечной инъекции 320 мг полиэстрадиолфосфата у мужчин с раком простаты.
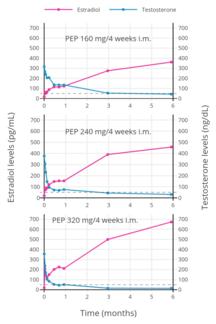
Уровни эстрадиола и тестостерона с полиэстрадиолфосфатом 160, 240 или 320 мг один раз в 4 недели внутримышечной инъекции мужчинам с раком простаты.
PEP оказывает антигонадотропное действие эффектов из-за его эстрогенной активности. Было обнаружено, что он снижает уровень тестостерона у мужчин на 55%, 75% и 85% при внутримышечных дозах 80, 160 и 240 мг каждые 4 недели соответственно. Было обнаружено, что однократная внутримышечная инъекция 320 мг ПКП снижает уровень тестостерона для уровня кастрации (< 50 ng/dL) within 3 weeks. This was associated with circulating estradiol levels of just over 200 pg/mL. The suppression of testosterone levels that can be achieved with PEP is equal to that with орхиэктомия. Однако достижения таких концентраций тестостерона, которые в среднем составляют около 15 нг / дл, были необходимы более высокие уровни эстрадиола около 500 пг / мл. Это было связано с внутримышечной дозой 320 мг. В конечном итоге, 240 мг ПКП в конечном итоге подавляли уровни тестостерона в диапазоне кастрации.>Механизм действия при раке простаты
Рост рака простаты обычно стимулирует дигидротестостероном (DHT), и если только рак не устойчивый к кастрации, его можно лечить, Эстрадиол оказывает терапевтическое действие в основном за счет отрицательной обратной связи на гипоталамус - ось гипофиз-гонад. Это блокирует секрецию из лютеинизи рующего гормона, который, в свою очередь, снижает выработку тестостерона в клетках Лейдига семенников. Эстрадиол также снижает процент свободного тестостерона за счет повышения уровня глобулина, связывающего половые гормоны (SHBG). Кроме того, он проявляет прямую цитотоксичность в отношении клеток рака простаты.
 уровней SHBG при 1) im инъекции 320 мг PEP каждые 4 недели; 2) в / м инъекция 320 мг ПЭП каждые 4 недели плюс 150 мкг / день перорально этинилэстрадиол ; 3) орхиэктомия.
уровней SHBG при 1) im инъекции 320 мг PEP каждые 4 недели; 2) в / м инъекция 320 мг ПЭП каждые 4 недели плюс 150 мкг / день перорально этинилэстрадиол ; 3) орхиэктомия.| Факторы | Пероральные эстрогены | Парентеральные эстрогены |
|---|---|---|
| Фактор VII | Повышает | Без изменений |
| Активность фактора VIII | Увеличивает | Без изменений |
| Активность антитромбина III | Уменьшает | Уменьшает |
| Протромбиновый фрагмент 1 + 2 | Увеличивает | Без изменений |
| Устойчивость к активированному протеину C | Увеличивает | Без изменений |
| Фибриноген | Уменьшает | Без изменений |
| Сноски: = Например, DES, EE. = PEP. Источники: | ||
эстрогены на синтез белка в печени, в том числе на синтез белков плазмы, факторы свертывания, липопротеины и триглицериды. Эти могут привести к повышенному риску тромбоэмболических и сердечно-сосудистых заболеваний, что, в свою очередь, может привести к увеличению смертности. Исследования показали, что у мужчин, получавших пероральные синтетические эстрогены, такие как этинилэстрадиол и диэтилстильбестрол, при раке простаты значительно повышенный 5-летний риск сердечно-сосудистой смертности от 14 до 26%. Однако, в то время как пероральные синтетические эстрогены имеют сильное влияние на синтез белка в печени, эффекты парентеральных биоидентичных эстрогенов, таких как PEP, на синтез белка в печени сравнительно очень слабы или даже полностью устранены. Это связано с тем, что первый проход через печень при пероральном введении избегается, и потому что биоидентичные эстрогены эффективно инактивируются в печени. Соответственно, PEP оказывает минимальное влияние на печень при дозировке не менее 240 мг / мес.
Исследование показало, что, тогда как внутримышечная PEP 320 мг / увеличивает уровни SHBG до 166% мужчин с раком простая комбинация 80 мг / месяц внутримышечного полиэстрадиолфосфата и 150 мкг / день перорального этинилээдиолфосфата и 150 мкг / день перорального этинилээдиола увеличила уровни SHBG до 617%, почти 8-кратная разница в увеличении и почти 4-кратная разница в абсолютных уровнях между двумя схемами лечения. Кроме того, в группе сердечно-сосудистых заболеваний, которые лечились этинилэстрадиолом, частота сердечно-сосудистых заболеваний в группе, принимающей сердечно-сосудистые заболевания, составляла 25%. Другое исследование не обнаружило изменений в уровнях фактора свертывания крови VII, белка, имеющего особое значение для сердечно-сосудистых побочных эффектов эстрогенов, при внутримышечном введении 240 мг / месяц PEP. Эти результаты демонстрируют огромное влияние синтетических пероральных эстрогенов, таких как этинилэстрадиол, на выработку белка в печени по сравнению с парентеральными биоидентичными формами эстрогена, такими как PEP.
Первоначально PEP обычно использовался в дозировке 80 мг в месяц в сочетании с 150 мкг этинилэстрадиола перорально в день лечения рака простаты. Было обнаружено, что эта комбинация вызывает значительную частоту сердечно-сосудистой токсичности, и в некоторых публикациях эта токсичность вызывает неправильную приписывалась ПКП. Последующие исследования показали, что токсичность связана не с ПКП, а с ее компонентом этинилэстрадиола.
Исследование показало, что терапия внутримышечными ПКП, приводящая к уровню эстрадиола около 400 пг / мл у мужчин с раком простаты, не дала результата. влияние на уровни гормона роста или инсулиноподобного фактора роста 1, тогда как добавление перорального этинилэстрадиола увеличивает уровни гормона роста и снижает уровни инсулиноподобного фактора роста 1.
ПКП имеет очень длительную продолжительность и вводится внутримышечно один раз в 4 недели. У мужчин первоначальная внутримышечная инъекция ПКП дает к быстрому повышению уровня эстрадиола, измеренному через 24 часа, с последующим медленным и последующим дальнейшим повышением уровней, по крайней мере, до 28 дня (время следующей инъекции). Последующие инъекции приводят к прогрессивному и значительному накоплению эстрадиола в течение как минимум 6 месяцев. Было установлено, что средний период полувыведения ПКП составляет 70 дней (10 недель) при однократной внутримышечной дозе 320 мг лекарства. tmax (время достижения максимальной концентрации) для эстрадиола составляло около 16 дней. ПЭП имеет продолжительность приблизительно 1 месяц при однократной дозе 40 мг, 2 месяца при 80 мг и 4 месяца при 160 мг.
ПЭП достигает кровотока в течение нескольких часов. после инъекции (90% через 24 часа), где он накапливается в ретикулоэндотелиальной системе. Затем эстрадиол отщепляется от полимера с помощью фосфатаз, хотя и очень медленно. Уровни эстрадиола у мужчин при внутримышечных инъекциях ПКП один раз каждые 4 недели составляли около 350 пг / мл для 160 мг, 450 пг / мл для 240 мг и почти 700 пг / мл для 320 мг, все измерялись через 6 месяцев лечения. Причных инъекций стабильные ежемесячно эстрадиола достижимы через 6–12 месяцев. Эстрадиол метаболизируется главным образом в печени с помощью CYP3A4 и других ферментов цитохрома P450 и в меньшей степени метаболизируется во внепеченочных тканях. метаболиты в основном выводятся с мочой через почки.
. Ранние исследования показали, что при дозе 80 мг ПКП каждые 4 недели быстро образует высокий средний уровень эстрадиола от 400 до 800 пг / мл. Эти уровни аналогичны уровням 100 мг ундецилата эстрадиола каждый месяц, который, как было обнаружено, обеспечивает уровень эстрадиола от 500 до 600 пг / мл. В результате ранее было сказано, что 80 мг PEP в месяц и 100 мг ундецилата эстрадиола в месяц примерно эквивалентны. Однако последующие исследования показали, что эта доза действительно обеспечивает более низкие уровни эстрадиола, чем было изначально.
ПЭП - это синтетический эстран стероид и C17β фосфорная кислота (фосфат) сложный эфир эстрадиола (эстрадиол-17β-фосфат ) в форме полимера. Он также известен как полимер эстрадиола с фосфорной кислотой или как полимер эстрадиола 17β-фосфата, а также полимер эстра-1,3,5 (10) -триен-3,17β-диола 17β-фосфата. С помощью ультрацентрифугирования было определено, что средняя молекулярная масса PEP соответствует длине цепи примерно 13 повторяющихся единиц эстрадиол-17β-фосфата. PEP тесно связан с полиэстриолфосфатом (Gynäsan, Klimadurin, Triodurin) и политестостеронфлоретинфосфатом (никогда не продавался), которые представляют собой эстриол и сложные эфиры тестостерона. в форме полимеров соответственно. A. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science Business Media. С. 551–. ISBN 978-3-642-96158-8. Полимер эстрадиола или эстриола и фосфорной кислоты обладает превосходным депо-действием при внутримышечном введении (фосфат полиэстриола или фосфат полиэстрадиола) (таблица 16). Фосфорная кислота соединяется с молекулой эстрогена в C3 и C17 с образованием макромолекулы. Соединение накапливается в печени и селезенке, где эстроген постепенно высвобождается за счет отщепления фосфатной части под действием щелочной фосфатазы. [...] Конъюгированные эстрогены и полиэстриол и эстрадиолфосфат также можно вводить внутривенно в водном растворе. Однако внутривенное введение гормонов яичников не имеет преимуществ и, следовательно, не имеет практического значения. [...] При однократном введении были получены следующие продолжительности действия (WlED, 1954; LAURITZEN, 1968): [...] 50 мг полиэстрадиолфосфата ~ 1 месяц; 50 мг полиэстриолфосфата ~ 1 месяц; 80 мг полиэстриолфосфата ~ 2 месяца.
Он также связан с полидиэтилстильбэстролфосфатом (никогда не поступает в продажу), сложным эфиром диэтилстильбэстрола в форме полимера.
| Эстроген | Структура | Эстер(s) | Относительный. мол. вес | Относительное. E2содержание | logP | ||||
|---|---|---|---|---|---|---|---|---|---|
| Позиция (я) | Moiet (ы) | Тип | Длина | ||||||
| Эстрадиол | – | – | – | – | 1,00 | 1,00 | 4,0 | ||
| Эстрадиола ацетат | C3 | Этановая кислота | Жирная кислота с прямой цепью | 2 | 1,15 | 0,87 | 4,2 | ||
| Бензоат эстрадиола | C3 | Бензолкарбоновая кислота | Ароматическая жирная кислота | - (~ 4–5) | 1,38 | 0,72 | 4,7 | ||
| Дипропионат эстрадиола | C3, C17β | Пропановая кислота (× 2) | Жирная кислота с прямой цепью | 3 (× 2) | 1,41 | 0,71 | 4,9 | ||
| валерат эстрадиола | C17β | пентановая кислота | жирная кислота с прямой цепью | 5 | 1,31 | 0,76 | 5,6–6,3 | ||
| Эстрадиолбензоатбутират | C3, C17β | Бензойная кислота, масляная кислота | Смешанные жирные кислоты | - (~ 6, 2) | 1,64 | 0,61 | 6,3 | ||
| эстрадиолципионат | C17β | Циклопентилпропановая кислота | Ароматическая жирная кислота | - (~ 6) | 1,46 | 0,69 | 6,9 | ||
| Эстрадиолэнантат | C17β | Гептановая кислота | Прямоцепочечная жирная кислота | 7 | 1,41 | 0,71 | 6,7–7,3 | ||
| Эстрадиолдиенантат | C3, C17β | Гептановая кислота (× 2) | Прямоцепочечная жирная кислота | 7 (× 2) | 1,82 | 0,55 | 8,1–10,4 | ||
| ундецилат эстрадиола | C17β | ундекановая кислота | жирная кислота с прямой цепью | 11 | 1,62 | 0,62 | 9,2–9,8 | ||
| стеарат эстрадиола | C17β | октадекановая кислота | жирная кислота с прямой цепью | 18 | 1,98 | 0,51 | 12,2–12,4 | ||
| дистеарат эстрадиола | C3, C17β | октадекановая кислота (× 2) | Прямоцепочечная жирная кислота | 18 (× 2) | 2,96 | 0,34 | 20,2 | ||
| Сульфат эстрадиола | C3 | Серная кислота | Водорастворимый конъюгат | – | 1,29 | 0,77 | 0,3–3,8 | ||
| Глюкуронид эстрадиола | C17β | Глюкуроновая кислота | Водорастворимый конъюгат | – | 1,65 | 0,61 | 2,1–2,7 | ||
| Эстрамустин фосфат | C3, C17β | Нормустин, ph o сфориновая кислота | Водорастворимый конъюгат | – | 1,91 | 0,52 | 2,9–5,0 | ||
| Полиэстрадиол-фосфат | C3 - C17β | Фосфорная кислота | Водорастворимый конъюгат | – | 1,23 | 0,81 | 2,9 | ||
| Сноски: = Длина сложный эфир в углеродных атомах для жирных кислот с прямым цепью или приблизительная длина сложного эфира в углеродных атомах для ароматических жирных кислот. = Относительное содержание эстрадиола по массе (т. Е. Относительное эстрогенное воздействие). = Экспериментальный или прогнозируемый коэффициент распределения октанол / вода (т.е. липофильность / гидрофобность ). Получено из PubChem, ChemSpider и DrugBank. = Также известен как фосфат эстрадиола и нормустина. = Полимер из эстрадиолфосфата (~ 13 повторяющихся единиц ). = Относительная молекулярная масса или содержание эстрадиола на повторяющуюся единицу. = logP повторяющейся единицы (т. е. эстрадиолфосфата). Источники: См. Отдельные статьи. | |||||||||
PEP имеет очень низкую растворимость в воде, ацетоне, хлороформе, диоксан и этанол, но легко растворяется в основаниях, особенно в водном пиридине.
Подобный полифосфаты полифенолов, PEP можно получить из мономера (в данном случае эстрадиола) и фосфорилхлорида. Последний реагирует как с фенольной гидроксильной группой в положении 3, так и с алифатической группой в положении 17β. Молекулярную массу полученного полимера можно контролировать, прерывая реакцию через заданное время: чем дольше продолжается реакция, тем выше масса.
Фармакологические эксперименты с эстрадиолфосфатами, проведенные примерно в 1950 году, привели к гипотезе о том, что эстрадиол-3,17β-дифосфат действует как ингибитор почечной щелочной фосфатазы. Когда те же ученые захотели синтезировать простые фосфаты из флоретина, соединения, обнаруженного в листьях яблони, они случайно вместо этого создали полимер. Позже было показано, что он проявляет те же антифосфатазные свойства, что и дифосфат эстрадиола, и поэтому было высказано предположение, что первоначальное открытие было связано с загрязнением полимерами эстрадиолфосфата. Следовательно, эти полимеры были изучены более подробно, что произошло к разработке PEP еще в 1953 году и его последующему внедрению в медицину в 1957 году в США.
Полиэстрадиолфосфат - это генерическое название препарата и его INN и БАН. Он также известен под кодовым названием Leo-114.
PEP продается исключительно под торговой маркой Эстрадурин или Эстрадурин.
 Доступность полиэстрадиолфосфата в странах по всему миру по состоянию на март 2018 года. В настоящее время продается синий, ранее продается зеленый.
Доступность полиэстрадиолфосфата в странах по всему миру по состоянию на март 2018 года. В настоящее время продается синий, ранее продается зеленый. ПЭП продается в США и широко по всей Европе, в том числе в Австрии, Бельгии, Чехии, Дании, Финляндии, Германии, Италия, Нидерланды, Норвегия, Россия, Испания, Швеция, Швейцария, Украина и Соединенное Королевство. Однако он больше не доступен в США и, возможно, в некоторых других странах, но, как известно, по-прежнему продается в Австрии, Бельгии, Дании, Финляндии, Нидерландах, Норвегии, Швеции и Швейцарии.
ПКП был изучен как средство гормонального увеличения груди у женщин.
Комбинация ПКП и медроксипрогестерона ацетата изучалась у женщин как длительное комбинированный инъекционный контрацептив для использования внутримышечной инъекцией один раз в три месяца.
.