| Типы жиров в пище |
|---|
| Смотрите также |
|
 Трехмерные изображения нескольких жирных кислот. Насыщенные жирные кислоты имеют идеально прямую цепную структуру. Ненасыщенные обычно изогнуты, если они не имеют транс- конфигурации.
Трехмерные изображения нескольких жирных кислот. Насыщенные жирные кислоты имеют идеально прямую цепную структуру. Ненасыщенные обычно изогнуты, если они не имеют транс- конфигурации. В химии, особенно в биохимии, жирная кислота представляет собой карбоновую кислоту с длинной алифатической цепью, которая может быть насыщенной или ненасыщенной. Большинство встречающихся в природе жирных кислот имеют неразветвленную цепь с четным числом атомов углерода от 4 до 28. Жирные кислоты обычно не встречаются в организмах в их отдельной форме, а вместо этого существуют в виде трех основных классов сложных эфиров : триглицеридов, фосфолипидов и холестериловые эфиры. В любой из этих форм жирные кислоты являются важными пищевыми источниками топлива для животных и важными структурными компонентами клеток.
Понятие жирной кислоты ( ацид гра) было введено в 1813 году Мишелем Эженом Шеврёлем, хотя первоначально он использовал несколько вариантов терминов: ацид злака и ацид huileux («кислый жир» и «масляная кислота»).
 Сравнение транс- изомера элаидиновой кислоты (вверху) и цис- изомера олеиновой кислоты (внизу).
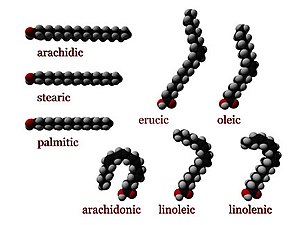
Сравнение транс- изомера элаидиновой кислоты (вверху) и цис- изомера олеиновой кислоты (внизу). Жирные кислоты классифицируются по-разному: по длине, по насыщенности и ненасыщенности, по четному и нечетному содержанию углерода, а также по линейным и разветвленным.
Насыщенные жирные кислоты не имеют двойных связей C = C. У них одинаковая формула CH 3 (CH 2) n COOH с вариациями в «n». Важной насыщенной жирной кислотой является стеариновая кислота (n = 16), которая при нейтрализации щелочью является наиболее распространенной формой мыла.
 Арахидовая кислота, насыщенная жирная кислота.
Арахидовая кислота, насыщенная жирная кислота. | Распространенное имя | Химическая структура | C: D |
|---|---|---|
| Каприловая кислота | CH 3 (CH 2) 6 COOH | 8: 0 |
| Каприновая кислота | CH 3 (CH 2) 8 COOH | 10: 0 |
| Лауриновая кислота | CH 3 (CH 2) 10 COOH | 12: 0 |
| Миристиновая кислота | CH 3 (CH 2) 12 COOH | 14: 0 |
| Пальмитиновая кислота | CH 3 (CH 2) 14 COOH | 16: 0 |
| Стеариновая кислота | CH 3 (CH 2) 16 COOH | 18: 0 |
| Арахидовая кислота | CH 3 (CH 2) 18 COOH | 20: 0 |
| Бегеновая кислота | CH 3 (CH 2) 20 COOH | 22: 0 |
| Лигноцериновая кислота | CH 3 (CH 2) 22 COOH | 24: 0 |
| Серотовая кислота | CH 3 (CH 2) 24 COOH | 26: 0 |
Ненасыщенные жирные кислоты имеют один или более С = С двойных связей. Двойные связи C = C могут давать цис- или транс- изомеры.
В большинстве встречающихся в природе ненасыщенных жирных кислот каждая двойная связь имеет после себя три ( n-3 ), шесть ( n-6 ) или девять ( n-9 ) атомов углерода, и все двойные связи имеют цис-конфигурацию. Большинство жирных кислот в транс- конфигурации ( трансжиры ) не встречаются в природе и являются результатом обработки человеком (например, гидрогенизации ). Некоторые трансжирные кислоты также естественным образом содержатся в молоке и мясе жвачных животных (например, крупного рогатого скота и овец). Они производятся ферментацией в рубце этих животных. Они также содержатся в молочных продуктах из молока жвачных животных и могут быть также обнаружены в грудном молоке женщин, которые получали их из своего рациона.
Геометрические различия между различными типами ненасыщенных жирных кислот, а также между насыщенными и ненасыщенными жирными кислотами играют важную роль в биологических процессах и в построении биологических структур (таких как клеточные мембраны).
| Распространенное имя | Химическая структура | Δ x | C: D | ИЮПАК | п - х |
|---|---|---|---|---|---|
| Миристолеиновая кислота | СН 3 (СН 2) 3 СН = СН (СН 2) 7 COOH | цис -Δ 9 | 14: 1 | 14: 1 (9) | п −5 |
| Пальмитолеиновая кислота | СН 3 (СН 2) 5 СН = СН (СН 2) 7 COOH | цис -Δ 9 | 16: 1 | 16: 1 (9) | п −7 |
| Сапиеновая кислота | СН 3 (СН 2) 8 СН = СН (СН 2) 4 COOH | цис -Δ 6 | 16: 1 | 16: 1 (6) | п -10 |
| Олеиновая кислота | СН 3 (СН 2) 7 СН = СН (СН 2) 7 COOH | цис -Δ 9 | 18: 1 | 18: 1 (9) | п -9 |
| Элаидиновая кислота | СН 3 (СН 2) 7 СН = СН (СН 2) 7 COOH | транс -Δ 9 | 18: 1 | п -9 | |
| Вакценовая кислота | СН 3 (СН 2) 5 СН = СН (СН 2) 9 COOH | транс -Δ 11 | 18: 1 | п −7 | |
| Линолевая кислота | СН 3 (СН 2) 4 СН = СН СН 2 СН = СН (СН 2) 7 COOH | цис, цис -Δ 9, Δ 12 | 18: 2 | 18: 2 (9,12) | п −6 |
| Линоэлаидовая кислота | СН 3 (СН 2) 4 СН = СН СН 2 СН = СН (СН 2) 7 COOH | транс, транс -Δ 9, Δ 12 | 18: 2 | п −6 | |
| α-линоленовая кислота | СН 3 СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН (СН 2) 7 COOH | цис, цис, цис -Δ 9, Δ 12, Δ 15 | 18: 3 | 18: 3 (9,12,15) | п -3 |
| Арахидоновая кислота | СН 3 (СН 2) 4 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН (СН 2) 3 COOH NIST | цис, цис, цис, цис -Δ 5 Δ 8, Δ 11, Δ 14 | 20: 4 | 20: 4 (5,8,11,14) | п −6 |
| Эйкозапентаеновая кислота | СН 3 СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН (СН 2) 3 COOH | цис, цис, цис, цис, цис -Δ 5, Δ 8, Δ 11, Δ 14, Δ 17 | 20: 5 | 20: 5 (5,8,11,14,17) | п -3 |
| Эруковая кислота | СН 3 (СН 2) 7 СН = СН (СН 2) 11 COOH | цис -Δ 13 | 22: 1 | 22: 1 (13) | п -9 |
| Докозагексаеновая кислота | СН 3 СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН СН 2 СН = СН (СН 2) 2 СООН | цис, цис, цис, цис, цис, цис -Δ 4, Δ 7, Δ 10, Δ 13, Δ 16, Δ 19 | 22: 6 | 22: 6 (4,7,10,13,16,19) | п -3 |
Большинство жирных кислот имеют четную цепочку, например стеариновая (C16) и олеиновая (C18), что означает, что они состоят из четного числа атомов углерода. Некоторые жирные кислоты имеют нечетное количество углерода; их называют жирными кислотами с нечетной цепью (OCFA). Наиболее распространенными OCFA являются насыщенные производные C15 и C17, соответственно пентадекановая кислота и гептадекановая кислота, которые содержатся в молочных продуктах. На молекулярном уровне OCFAs биосинтезируются и метаболизируются несколько иначе, чем родственники с четной цепью.
 Нумерация атомов углерода. Систематические числа C- x (IUPAC) выделены синим цветом. Знаки омега-минуса "ω− x " красного цвета. Ярлыки с греческими буквами зеленого цвета.
Нумерация атомов углерода. Систематические числа C- x (IUPAC) выделены синим цветом. Знаки омега-минуса "ω− x " красного цвета. Ярлыки с греческими буквами зеленого цвета. Большинство встречающихся в природе жирных кислот имеют неразветвленную цепь атомов углерода с карбоксильной группой (–COOH) на одном конце и метильной группой (–CH3) на другом конце.
Положение атомов углерода в основной цепи жирной кислоты обычно указывается путем счета от 1 на конце -COOH. Углеродное число x часто сокращается или C- x (или иногда C x), где x = 1, 2, 3 и т. Д. Это схема нумерации, рекомендованная IUPAC.
Согласно другому соглашению буквы греческого алфавита используются последовательно, начиная с первого атома углерода после карбоксильной группы. Таким образом, углерод α ( альфа ) представляет собой C-2, углерод β ( бета ) представляет собой C-3 и так далее.
Хотя жирные кислоты могут иметь разную длину, в этом втором соглашении последний атом углерода в цепи всегда обозначается как ω ( омега ), что является последней буквой греческого алфавита. Третье соглашение о нумерации считает атомы углерода с этого конца с использованием меток «ω», «ω-1», «ω-2». В качестве альтернативы, метка «ω− x » записывается как «n− x », где «n» означает количество атомов углерода в цепи.
В любой схеме нумерации положение двойной связи в цепи жирной кислоты всегда указывается путем указания метки углерода, ближайшего к карбоксильному концу. Таким образом, в жирной кислоте из 18 атомов углерода, двойная связь между C-12 (или ω-6) и C-13 (или ω-5), как говорят, находится «в» положении C-12 или ω-6. Название кислоты ИЮПАК, такое как «октадек-12-еновая кислота» (или более произносимый вариант «12-октадекановая кислота»), всегда основано на нумерации «С».
Обозначение Δ x, y,... традиционно используется для обозначения жирной кислоты с двойными связями в положениях x, y,.... (заглавная греческая буква "Δ" ( дельта ) соответствует римской "D", т.е. D ouble связь). Таким образом, например, 20-углеродная арахидоновая кислота имеет Δ 5,8,11,14, что означает, что она имеет двойные связи между атомами углерода 5 и 6, 8 и 9, 11 и 12, 14 и 15.
В контексте питания человека и метаболизма жиров ненасыщенные жирные кислоты часто классифицируются по положению двойной связи, ближайшему к ω-углероду (только), даже в случае множественных двойных связей, таких как незаменимые жирные кислоты. Таким образом, арахидоновая кислота, линолевая кислота (18 атомов углерода, Δ 9,12) и миристолеиновая кислота (14 атомов углерода, Δ 8) все классифицируются как жирные кислоты «ω-3»; означает, что их формула заканчивается на –CH = CH– CH 2- CH 3.
Жирные кислоты с нечетным числом атомов углерода называются жирными кислотами с нечетной цепью, тогда как остальные - жирными кислотами с четной цепью. Разница имеет отношение к глюконеогенезу.
В следующей таблице описаны наиболее распространенные системы наименования жирных кислот.
| Номенклатура | Примеры | Объяснение |
|---|---|---|
| Банальный | Пальмитолеиновая кислота | Тривиальные имена (или общие имена) - это несистематические исторические имена, которые являются наиболее частой системой именования, используемой в литературе. У большинства распространенных жирных кислот есть тривиальные названия в дополнение к их систематическим названиям (см. Ниже). Эти имена часто не соответствуют какой-либо схеме, но они краткие и часто недвусмысленные. |
| Систематический | цис-9-октадек-9-еновая кислота (9 Z) -октадек-9-еновая кислота | Систематические названия (или названия ИЮПАК ) происходят из стандартных Правил ИЮПАК по номенклатуре органической химии, опубликованных в 1979 году, наряду с рекомендациями, опубликованными специально для липидов в 1977 году. Нумерация атомов углерода начинается с карбоксильного конца основной цепи молекулы. Двойные связи обозначаются цис - / транс - обозначением или E - / Z - обозначением, где это необходимо. Эти обозначения обычно более подробны, чем общепринятая номенклатура, но имеют то преимущество, что они более технически ясны и наглядны. |
| Δ x | цис -Δ 9, цис -Δ 12 октадекадиеновая кислота | В номенклатуре Δ x (или дельта- x) каждая двойная связь обозначена как Δ x, где двойная связь начинается с x- й углерод-углеродной связи, считая от карбоксильного конца основной цепи молекулы. Каждой двойной связи предшествует цис- или транс- префикс, указывающий на конфигурацию молекулы вокруг связи. Например, линолевая кислота обозначается как « цис -Δ 9, цис -Δ 12 октадекадиеновая кислота». Эта номенклатура имеет то преимущество, что она менее многословна, чем систематическая, но не более технически ясна или описательна. |
| n - x (или ω− x) | n −3 (или ω − 3 ) | Номенклатура n - x ( n минус x ; также ω - x или омега- x)дает названия для отдельных соединений и классифицирует их по их вероятным биосинтетическим свойствам у животных. Двойная связь расположена на x- й углерод-углеродной связи, считая от метильного конца основной цепи молекулы. Например, α-линоленовая кислота классифицируется какжирная кислота n- 3 или омега-3, и поэтому она, вероятно, разделяет путь биосинтеза с другими соединениями этого типа. Обозначенияω− x,omega- x или «омега» распространены в популярной литературе по питанию, но IUPAC отказался от них в пользуобозначения n − x в технических документах. Наиболее часто исследуемые пути биосинтеза жирных кислот - это n -3 и n -6. |
| Липидные числа | 18: 3 18: 3n3 18: 3, цис, цис, цис -Δ 9, Δ 12, Δ 15 18: 3 (9,12,15) | Числа липидов имеют вид C: D, где C - количество атомов углерода в жирной кислоте, а D - количество двойных связей в жирной кислоте. Если D больше единицы, предполагается, что двойные связи прерываются CH 2единиц, т. е. с интервалом в 3 атома углерода вдоль цепи. Например, α-линоленовая кислота представляет собой жирную кислоту 18: 3, и ее три двойные связи расположены в положениях Δ 9, Δ 12 и Δ 15. Это обозначение может быть неоднозначным, так как некоторые различные жирные кислоты могут иметь один и тот же C: D номера. Следовательно, когда существует неоднозначность, это обозначение обычно сочетается с членом Δ x или n - x. Например, хотя α-линоленовая кислота и γ-линоленовая кислота имеют соотношение 18: 3, они могут быть однозначно описаны как жирные кислоты 18: 3n3 и 18: 3n6 соответственно. Для той же цели IUPAC рекомендует использовать в скобках список позиций двойных связей, добавленный к обозначению C: D. Например, IUPAC рекомендовал обозначения для α- и γ-линоленовой кислоты: 18: 3 (9,12,15) и 18: 3 (6,9,12) соответственно. |
При циркуляции в плазме (жирные кислоты плазмы), а не в виде сложного эфира, жирные кислоты известны как неэтерифицированные жирные кислоты (NEFA) или свободные жирные кислоты (FFA). СЖК всегда связаны с транспортным белком, таким как альбумин.
Жирные кислоты обычно получают промышленно с помощью гидролиза из триглицеридов, с удалением глицерина (см переработки масел ). Другой источник - фосфолипиды. Некоторые жирные кислоты получают синтетически путем гидрококсилирования алкенов.
Гипероксигенированные жирные кислоты производятся специальными производственными процессами для кремов для кожи местного действия. Процесс основан на введении или насыщении пероксидов в сложные эфиры жирных кислот через присутствие ультрафиолетового света и барботирования газообразного кислорода при контролируемых температурах. В частности, было показано, что линоленовая кислота играет важную роль в поддержании функции водного барьера кожи (предотвращая потерю воды и обезвоживание кожи). В исследовании, проведенном в Испании, опубликованном в журнале Journal of Wound Care в марте 2005 года, сравнивали коммерческий продукт с жирным плацебо, и этот конкретный продукт был более эффективным и рентабельным. Ряд таких безрецептурных медицинских продуктов сейчас широко доступен. Однако в ходе рандомизированного тройного слепого контролируемого исследования не меньшей эффективности, проведенного в Испании в течение 2015 года, оливковое масло, применяемое для местного применения, не уступает по качеству. Коммерческие продукты, вероятно, будут менее грязными в обращении и более пригодными для мытья, чем оливковое масло или бензин. желе, оба из которых при местном применении могут испачкать одежду и постельное белье.
У животных жирные кислоты образуются из углеводов преимущественно в печени, жировой ткани и молочных железах во время лактации.
Углеводы превращаются в пируват путем гликолиза, что является первым важным шагом в превращении углеводов в жирные кислоты. Затем пируват декарбоксилируется с образованием ацетил-КоА в митохондрии. Однако этот ацетил-КоА необходимо транспортировать в цитозоль, где происходит синтез жирных кислот. Это не может произойти напрямую. Для получения цитозольного ацетил-КоА цитрат (полученный путем конденсации ацетил-КоА с оксалоацетатом ) удаляется из цикла лимонной кислоты и переносится через внутреннюю мембрану митохондрий в цитозоль. Там он расщепляется цитратлиазой АТФ на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малата. Цитозольный ацетил-КоА карбоксилируется ацетил-КоА-карбоксилазой в малонил-КоА, первый обязательный этап синтеза жирных кислот.
Затем малонил-КоА участвует в повторяющейся серии реакций, которые удлиняют растущую цепь жирных кислот на два атома углерода за раз. Таким образом, почти все природные жирные кислоты имеют четное число атомов углерода. Когда синтез завершен, свободные жирные кислоты почти всегда объединяются с глицерином (три жирные кислоты на одну молекулу глицерина) с образованием триглицеридов, основной формы хранения жирных кислот и, следовательно, энергии у животных. Однако жирные кислоты также являются важными компонентами фосфолипидов, которые образуют бислои фосфолипидов, из которых построены все мембраны клетки ( клеточная стенка и мембраны, которые охватывают все органеллы внутри клеток, такие как ядро, митохондрии, эндоплазматический ретикулум и аппарат Гольджи ).
«Несвязанные жирные кислоты» или «свободные жирные кислоты», обнаруженные в кровообращении животных, возникают в результате распада (или липолиза ) накопленных триглицеридов. Поскольку они нерастворимы в воде, эти жирные кислоты транспортируются связанными с альбумином плазмы. Уровни «свободных жирных кислот» в крови ограничены доступностью сайтов связывания альбумина. Они могут поступать из крови всеми клетками, имеющими митохондрии (за исключением клеток центральной нервной системы ). Жирные кислоты могут быть расщеплены только в митохондриях посредством бета-окисления с последующим сжиганием в цикле лимонной кислоты до CO 2 и воды. Клетки центральной нервной системы, хотя и обладают митохондриями, не могут забирать свободные жирные кислоты из крови, поскольку гематоэнцефалический барьер непроницаем для большинства свободных жирных кислот, за исключением жирных кислот с короткой цепью и жирных кислот со средней длиной цепи. Эти клетки должны производить свои собственные жирные кислоты из углеводов, как описано выше, чтобы производить и поддерживать фосфолипиды своих клеточных мембран и их органелл.
Исследования на клеточные мембраны из млекопитающих и рептилий обнаружено, что клеточные мембраны млекопитающих состоят из более высокой пропорции полиненасыщенных жирных кислот ( DHA, омега-3 жирных кислот ), чем рептилии. Исследования по составу жирных кислот птиц показали, что пропорции аналогичны млекопитающим, но с содержанием омега-3 жирных кислот на 1/3 меньше по сравнению с омега-6 для данного размера тела. Такой состав жирных кислот приводит к более жидкой клеточной мембране, но также к такой, которая проницаема для различных ионов (H + и Na +), в результате чего клеточные мембраны становятся более дорогостоящими в обслуживании. Утверждалось, что эта стоимость содержания является одной из основных причин высокой скорости обмена веществ и сопутствующей теплокровности млекопитающих и птиц. Однако полиненасыщение клеточных мембран также может происходить в ответ на хронические низкие температуры. У рыб все более холодная среда приводит к все более высокому содержанию в клеточных мембранах как мононенасыщенных, так и полиненасыщенных жирных кислот, чтобы поддерживать большую текучесть (и функциональность) мембран при более низких температурах.
В следующей таблице представлен состав жирных кислот, витамина Е и холестерина в некоторых распространенных диетических жирах.
| Насыщенный | Мононенасыщенный | Полиненасыщенные | Холестерин | Витамин Е | |
|---|---|---|---|---|---|
| г / 100г | г / 100г | г / 100г | мг / 100г | мг / 100г | |
| Животные жиры | |||||
| Утиный жир | 33,2 | 49,3 | 12,9 | 100 | 2,70 |
| Сало | 40,8 | 43,8 | 9,6 | 93 | 0,60 |
| Жир | 49,8 | 41,8 | 4.0 | 109 | 2,70 |
| Сливочное масло | 54,0 | 19,8 | 2,6 | 230 | 2,00 |
| Растительные жиры | |||||
| Кокосовое масло | 85,2 | 6,6 | 1,7 | 0 | 0,66 |
| Кокосовое масло | 60,0 | 32,9 | 3.0 | 0 | 1,8 |
| Пальмовое масло | 81,5 | 11,4 | 1.6 | 0 | 3,80 |
| пальмовое масло | 45,3 | 41,6 | 8,3 | 0 | 33,12 |
| Хлопковое масло | 25,5 | 21,3 | 48,1 | 0 | 42,77 |
| Масло из зародышей пщеницы | 18,8 | 15,9 | 60,7 | 0 | 136,65 |
| Соевое масло | 14,5 | 23,2 | 56,5 | 0 | 16.29 |
| Оливковое масло | 14.0 | 69,7 | 11.2 | 0 | 5.10 |
| Кукурузное масло | 12,7 | 24,7 | 57,8 | 0 | 17,24 |
| Подсолнечное масло | 11,9 | 20,2 | 63,0 | 0 | 49.00 |
| Сафлоровое масло | 10.2 | 12,6 | 72,1 | 0 | 40,68 |
| Конопляное масло | 10 | 15 | 75 | 0 | 12,34 |
| Рапсовое / рапсовое масло | 5,3 | 64,3 | 24,8 | 0 | 22.21 |
Жирные кислоты вступают в реакции, как и другие карбоновые кислоты, то есть подвергаются этерификации и кислотно-основным реакциям.
Жирные кислоты не показывают больших изменений в кислотности, на что указывает их соответствующее значение p K a. Например, нонановая кислота имеет ap K a 4,96, что лишь немного слабее уксусной кислоты (4,76). По мере увеличения длины цепи растворимость жирных кислот в воде снижается, так что жирные кислоты с более длинной цепью оказывают минимальное влияние на pH водного раствора. Даже те жирные кислоты, которые являются нерастворимыми в воде растворяются в теплом этаноле, и могут быть титруют с гидроксидом натрия раствором с использованием фенолфталеина в качестве индикатора. Этот анализ используется для определения содержания свободных жирных кислот в жирах; то есть доля триглицеридов, которые были гидролизованы.
Нейтрализация жирных кислот, то есть омыление, является широко распространенным способом получения металлических мыл.
Гидрирование ненасыщенных жирных кислот широко практикуется. Типичные условия включают давление H 2 2,0–3,0 МПа, 150 ° C и никель, нанесенный на кремнезем в качестве катализатора. Эта процедура позволяет получить насыщенные жирные кислоты. Степень гидрирования указывается йодным числом. Гидрогенизированные жирные кислоты менее склонны к прогорканию. Поскольку насыщенные жирные кислоты имеют более высокую температуру плавления, чем ненасыщенные предшественники, этот процесс называется отверждением. Родственная технология используется для преобразования растительных масел в маргарин. Гидрирование триглицеридов (по сравнению с жирными кислотами) выгодно, потому что карбоновые кислоты разрушают никелевые катализаторы, давая никелевые мыла. Во время частичного гидрирования ненасыщенные жирные кислоты могут быть изомеризованы из цис- конфигурации в транс.
Более форсированная гидрогенизация, то есть использование более высоких давлений H 2 и более высоких температур, превращает жирные кислоты в жирные спирты. Однако жирные спирты легче получить из сложных эфиров жирных кислот.
В реакции Варрентраппа некоторые ненасыщенные жирные кислоты расщепляются в расплавленной щелочи, реакция, которая в какой-то момент имела отношение к выяснению структуры.
Ненасыщенные жирные кислоты подвергаются химическому изменению, известному как автоокисление. Процесс требует кислорода (воздуха) и ускоряется наличием следов металлов. Растительные масла в небольшой степени сопротивляются этому процессу, поскольку содержат антиоксиданты, такие как токоферол. Жиры и масла часто обрабатывают хелатирующими агентами, такими как лимонная кислота, для удаления металлических катализаторов.
Ненасыщенные жирные кислоты подвержены разложению под действием озона. Эта реакция практикуется при производстве азелаиновой кислоты ((CH 2) 7 (CO 2 H) 2) из олеиновой кислоты.
Жирные кислоты с короткой и средней цепью всасываются непосредственно в кровь через капилляры кишечника и проходят через воротную вену, как и другие всасываемые питательные вещества. Однако длинноцепочечные жирные кислоты не попадают напрямую в капилляры кишечника. Вместо этого они абсорбируются жировыми стенками ворсинок кишечника и снова собираются в триглицериды. Триглицериды покрыты холестерином и белком (белковая оболочка) в соединение, называемое хиломикроном.
Изнутри клетки хиломикрон попадает в лимфатический капилляр, называемый млечным, который сливается с более крупными лимфатическими сосудами. Он транспортируется через лимфатическую систему и грудной проток к месту рядом с сердцем (где артерии и вены больше). Грудной проток выводит хиломикроны в кровоток через левую подключичную вену. На этом этапе хиломикроны могут транспортировать триглицериды в ткани, где они хранятся или метаболизируются для получения энергии.
При метаболизме жирные кислоты выделяют большое количество АТФ. Многие типы клеток могут использовать для этой цели либо глюкозу, либо жирные кислоты. Жирные кислоты (получаемые при приеме внутрь или за счет триглицеридов, хранящихся в жировых тканях) распределяются по клеткам и служат топливом для мышечного сокращения и общего метаболизма. Они расщепляются на CO 2 и воду внутриклеточными митохондриями, высвобождая большое количество энергии, захваченной в форме АТФ в результате бета-окисления и цикла лимонной кислоты.
Жирные кислоты, которые необходимы для хорошего здоровья, но не могут быть получены в достаточном количестве из других субстратов и поэтому должны быть получены из пищи, называются незаменимыми жирными кислотами. Есть две серии незаменимых жирных кислот: одна имеет двойную связь на три атома углерода от метильного конца; другой имеет двойную связь на расстоянии шести атомов углерода от метильного конца. У людей отсутствует способность вводить двойные связи в жирные кислоты, помимо атомов углерода 9 и 10, если считать со стороны карбоновой кислоты. Две незаменимые жирные кислоты - это линолевая кислота (LA) и альфа-линоленовая кислота (ALA). Эти жирные кислоты широко распространены в растительных маслах. Организм человека имеет ограниченную способность преобразовывать АЛК в жирные кислоты омега-3 с более длинной цепью - эйкозапентаеновую кислоту (ЭПК) и докозагексаеновую кислоту (ДГК), которые также можно получить из рыбы. Жирные кислоты омега-3 и омега-6 являются биосинтетическими предшественниками эндоканнабиноидов с антиноцицептивными, анксиолитическими и нейрогенными свойствами.
Жирные кислоты крови принимают различные формы на разных этапах кровообращения. Они попадают через кишечник в хиломикронах, но также существуют в липопротеинах очень низкой плотности (ЛПОНП) и липопротеидах низкой плотности (ЛПНП) после обработки в печени. Кроме того, при высвобождении из адипоцитов жирные кислоты существуют в крови в виде свободных жирных кислот.
Предполагается, что смесь жирных кислот, выделяемых кожей млекопитающих, вместе с молочной кислотой и пировиноградной кислотой, является отличительной и позволяет животным с острым обонянием различать особей.
Химический анализ жирных кислот в липидах обычно начинается со стадии переэтерификации, которая расщепляет их исходные сложные эфиры (триглицериды, воски, фосфолипиды и т. Д.) И превращает их в метиловые эфиры, которые затем разделяются с помощью газовой хроматографии. или анализируются с помощью газовой хроматографии и спектроскопии в среднем инфракрасном диапазоне.
Разделение непредельных изомеров возможно с помощью тонкослойной хроматографии с ионами серебра (аргентации). Другие методы разделения включают высокоэффективную жидкостную хроматографию (с короткими колонками, заполненными силикагелем со связанными группами фенилсульфоновой кислоты, атомы водорода которых заменены на ионы серебра). Роль серебра заключается в его способности образовывать комплексы с ненасыщенными соединениями.
Жирные кислоты в основном используются при производстве мыла как для косметических целей, так и, в случае мыла с металлическим покрытием, в качестве смазочных материалов. Жирные кислоты также превращаются через их метиловые эфиры в жирные спирты и жирные амины, которые являются предшественниками поверхностно-активных веществ, детергентов и смазок. Другие применения включают их использование в качестве эмульгаторов, текстурирующих агентов, смачивателей, пеногасителей или стабилизаторов.
Сложные эфиры жирных кислот с более простыми спиртами (такие как метил-, этил-, н-пропил-, изопропил- и бутиловые эфиры) используются в качестве смягчающих веществ в косметике и других продуктах личной гигиены, а также в качестве синтетических смазок. Сложные эфиры жирных кислот с более сложными спиртами, такими как сорбит, этиленгликоль, диэтиленгликоль и полиэтиленгликоль, потребляются с пищей или используются для личной гигиены и очистки воды, или используются в качестве синтетических смазочных материалов или жидкостей для обработки металлов.
этот процесс показан графически на странице 73
Поглощение вальпроевой кислоты снижалось в присутствии жирных кислот со средней длиной цепи, таких как гексаноат, октаноат и деканоат, но не пропионата или бутирата, что указывает на то, что вальпроевая кислота попадает в мозг через транспортную систему для жирных кислот со средней длиной цепи., а не жирные кислоты с короткой цепью.... Основываясь на этих сообщениях, считается, что вальпроевая кислота двунаправленно транспортируется между кровью и мозгом через ГЭБ с помощью двух различных механизмов, чувствительных к монокарбоновым кислотам и чувствительных к среднецепочечным жирным кислотам транспортеров, для оттока и поглощения, соответственно.
Транспортеры монокарбоксилатов (MCT), как известно, опосредуют транспорт монокарбоксилатов с короткой цепью, таких как лактат, пируват и бутират.... MCT1 и MCT4 также связаны с транспортом короткоцепочечных жирных кислот, таких как ацетат и формиат, которые затем метаболизируются в астроцитах [78].
| У Схолии есть профиль химического класса для жирных кислот. |