 A бюретка и колба Эрленмейера (коническая колба), используемый для кислотно-основного титрования.
A бюретка и колба Эрленмейера (коническая колба), используемый для кислотно-основного титрования.титрования (также известного как титриметрия и объемный анализ ), является распространенным лабораторным методом количественного химический анализ для определения концентрации идентифицированного аналита (вещества, подлежащего анализу). Реагент , называемый титрантом или титратором, готовят в виде стандартного раствора известной концентрации и объема. Титрант реагирует с раствором аналита (который также может называться титрантом) для определения концентрации аналита. Объем титранта, который прореагировал с аналитом, называется объемом титрования.
Слово «титрация» происходит от французского слова tiltre (1543), означающего долю золота или серебра в монетах или в изделиях из золота или серебра; то есть мера тонкости или чистоты. Тильтр стал титром, что стало означать «пробу легированного золота», а затем «концентрацию вещества в данном образце». В 1828 году французский химик Жозеф Луи-Люссак впервые использовал титр как глагол (titrer), означающий «определять концентрацию вещества в данном образце».
Объемный анализ возник в конце 18 века во Франции. Франсуа-Антуан-Анри Дескруазиль (fr ) разработал первую бюретку (которая была похожа на градуированный цилиндр) в 1791 году. Гей-Люссак разработал улучшенную версию бюретки с боковым плечом и изобрел термины « пипетка "и" бюретка "в статье 1824 года о стандартизации растворов индиго. Первая настоящая бюретка была изобретена в 1845 году французским химиком Этьеном Оссианом Анри (1798–1873). Значительное улучшение метода и популяризация объемного анализа произошли благодаря Карлу Фридриху Мору, который преобразовал бюретку в простую и удобную форму и написал первый учебник по этой теме, Lehrbuch der chemisch-analytischen Titrirmethode (Учебник методов титрования аналитической химии), опубликованный в 1855 г.
 Анализ образцов почвы титрованием.
Анализ образцов почвы титрованием. Типичное титрование начинается с стакана или Колба Эрленмейера, содержащая очень точное количество аналита и небольшое количество индикатора (например, фенолфталеина ), помещенная под калиброванную бюретку или химический пипеточный шприц, содержащий титрант. Затем к аналиту и индикатору добавляются небольшие объемы титранта до тех пор, пока индикатор не изменит цвет в ответ на порог насыщения титранта, что означает достижение конечной точки титрования, что означает, что количество титранта уравновешивает количество наличие аналита в соответствии с реакцией между ними. В зависимости от желаемой конечной точки, отдельные капли или менее одной капли титранта могут иметь значение между постоянным и временным изменением индикатора.
Для типичного титрования требуется титрант и аналит должен находиться в жидкой (растворной) форме. Хотя твердые вещества обычно растворяются в водном растворе, другие растворители, такие как ледяная уксусная кислота или этанол, используются для специальных целей (как в нефтехимии ). Концентрированные аналиты часто разбавляются для повышения точности.
Для многих некислотно-щелочных титрований требуется постоянное pH во время реакции. Следовательно, буферный раствор может быть добавлен в камеру для титрования для поддержания pH.
В случаях, когда два реагента в образце могут реагировать с титрантом и только один является желаемым аналитом, в реакционную камеру может быть добавлен отдельный маскирующий раствор, который устраняет влияние нежелательного иона.
Некоторые реакции восстановления-окисления (окислительно-восстановительный ) могут потребовать нагревания раствор образца и титрование, пока раствор еще горячий, для увеличения скорости реакции. Например, для окисления некоторых оксалатных растворов требуется нагревание до 60 ° C (140 ° F) для поддержания разумной скорости реакции.
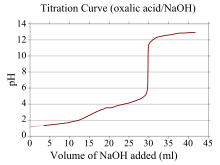 Типичная кривая титрования дипротонной кислоты титрован с сильным основанием. Здесь показана щавелевая кислота, титрованная гидроксидом натрия. Видны обе точки эквивалентности.
Типичная кривая титрования дипротонной кислоты титрован с сильным основанием. Здесь показана щавелевая кислота, титрованная гидроксидом натрия. Видны обе точки эквивалентности. Кривая титрования - это кривая на графике, координата x которой представляет объем титранта, добавленного с начала титрования, а координата y которого представляет концентрация аналита на соответствующей стадии титрования (при кислотно-основном титровании координата y обычно представляет собой pH раствора).
В кислоте - основание, кривая титрования представляет концентрацию соответствующей кислоты и основания. Для сильной кислоты и сильного основания кривая будет относительно гладкой и очень крутой около точки эквивалентности. Из-за этого небольшое изменение объема титранта вблизи точки эквивалентности приводит к значительному изменению pH, и могут быть использованы многие индикаторы (например, лакмус, фенолфталеин или бромтимоловый синий ).
Если один реагент представляет собой слабую кислоту или основание, а другой - сильную кислоту или основание, кривая титрования будет нерегулярной, а pH смещается меньше при небольших добавках титранта вблизи точки эквивалентности. Например, изображена кривая титрования между щавелевой кислотой (слабая кислота) и гидроксидом натрия (сильное основание). Точка эквивалентности находится между pH 8-10, что указывает на то, что раствор является основным в точке эквивалентности, и такой индикатор, как фенолфталеин, будет подходящим. Кривые титрования, соответствующие слабым основаниям и сильным кислотам, ведут себя аналогичным образом, причем раствор является кислым в точке эквивалентности, и наиболее подходящими являются такие индикаторы, как метиловый оранжевый и бромтимоловый синий.
При титровании между слабой кислотой и слабым основанием кривые титрования очень нерегулярны. Из-за этого не может быть подходящего конкретного индикатора, и для отслеживания реакции часто используется pH-метр.
Тип функции, которая может использоваться для описания кривой, называется сигмовидная функция.
Существует множество типов титрований с разными процедурами и целями. Наиболее распространенными видами качественного титрования являются кислотно-основное титрование и окислительно-восстановительное титрование.
 Метиловый оранжевый
Метиловый оранжевый | Индикатор | Цвет на кислотной стороне | Диапазон изменения цвета. (pH) | Цвет на основной стороне |
|---|---|---|---|
| Метиловый фиолетовый | Желтый | 0,0–1,6 | Фиолетовый |
| Бромфеноловый синий | Желтый | 3,0–4,6 | Синий |
| Метиловый оранжевый | Красный | 3,1–4,4 | Желтый |
| Метиловый красный | Красный | 4,4–6,3 | Желтый |
| Litmus | Красный | 5,0–8,0 | Синий |
| Бромтимоловый синий | Желтый | 6,0–7,6 | Синий |
| Фенолфталеин | Бесцветный | 8.3–10.0 | Розовый |
| Ализариновый желтый | Желтый | 10.1–12.0 | Красный |
Кислотно-основное титрование зависит от нейтрализации между кислотой и основанием при смешивании с раствором. В дополнение к образцу в камеру для титрования добавляется соответствующий индикатор pH, представляющий диапазон pH точки эквивалентности. Кислотно-щелочной индикатор указывает конечную точку титрования изменением цвета. Конечная точка и точка эквивалентности не совсем совпадают, потому что точка эквивалентности определяется стехиометрией реакции, в то время как конечная точка - это просто изменение цвета от индикатора. Таким образом, тщательный подбор индикатора снизит погрешность индикатора. Например, если точка эквивалентности находится при pH 8,4, тогда индикатор фенолфталеина будет использоваться вместо желтого ализарина, потому что фенолфталеин уменьшит ошибку индикатора. Общие индикаторы, их цвета и диапазон pH, в котором они меняют цвет, приведены в таблице выше. Когда требуются более точные результаты или когда реагенты представляют собой слабую кислоту и слабое основание, используют pH-метр или измеритель проводимости.
Для очень сильных оснований, таких как литийорганический реагент, амиды металлов и гидриды, вода обычно не является подходящим растворителем и индикаторами, pKa находятся в диапазоне изменения pH водной среды, мало пригодны. Вместо этого в качестве титранта и индикатора используются более слабые кислоты, и используются безводные растворители, такие как THF.
 Фенолфталеин, обычно используемый индикатор при кислотном и основном титровании.
Фенолфталеин, обычно используемый индикатор при кислотном и основном титровании. Приблизительный pH во время титрования. можно аппроксимировать тремя видами расчетов. Перед началом титрования концентрацию ![{\ displaystyle {\ ce {[H +]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)
![{\ displaystyle {\ ce {[H +]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)
![{\ displaystyle {\ ce {[H +]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\ displaystyle [{\ ce {H +}}] [{\ ce {OH- }}] = 10 ^ {- 14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\ displaystyle [{\ ce {H +}}] = K_ {a} {\ ce {{\ frac {[ HA]} {[A ^ {-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\ displaystyle [{\ ce {HA}}] + [{\ ce {A -}}] = {\ frac {(n _ {{ \ ce {A}}} + n _ {{\ ce {B}}})} {V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\ displaystyle [{\ ce {H +}}] + {\ frac {n _ {{\ ce {B}}}} {V}} = [{\ ce {A -}}] + [{\ ce { OH-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)
В уравнениях 

![{\ displaystyl е В [{\ ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\ displaystyle V [{\ ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)

Редокс-титрование основано на реакции восстановления-окисления между окислителем и восстанавливающим агентом. потенциометр или индикатор окислительно-восстановительного потенциала обычно используется для определения конечной точки титрования, например, когда одним из компонентов является окислитель дихромат калия. Изменение цвета раствора с оранжевого на зеленый не является однозначным, поэтому используется индикатор, такой как дифениламин натрия. Для анализа вин на диоксид серы необходим йод в качестве окислителя. В этом случае в качестве индикатора используется крахмал; синий крахмал-йодный комплекс образуется в присутствии избытка йода, что указывает на конечную точку.
Некоторые окислительно-восстановительные титрования не требуют индикатора из-за интенсивного цвета составляющих. Например, в перманганометрии слабый устойчивый розовый цвет сигнализирует о конечной точке титрования из-за цвета избыточного окислителя перманганата калия. В иодометрии при достаточно больших концентрациях исчезновение темно-красно-коричневого трииодид иона само может быть использовано в качестве конечной точки, хотя при более низких концентрациях чувствительность улучшается путем добавления индикатор крахмала, который образует комплекс интенсивно-синего цвета с трииодидом.
 Цвет йодометрической смеси для титрования до (слева) и после (справа) конечной точки.
Цвет йодометрической смеси для титрования до (слева) и после (справа) конечной точки. Титрование в газовой фазе выполняется в газовая фаза, в частности, как методы определения химически активных веществ по реакции с избытком какого-либо другого газа, действующего как титрант. При обычном газофазном титровании газообразный озон титруют оксидом азота в соответствии с реакцией
После завершения реакции оставшийся титрант и продукт определяют количественно (например, с помощью спектроскопии с преобразованием Фурье ) (FT-IR); это используется для определения количества аналита в исходной пробе.
Газофазное титрование имеет несколько преимуществ перед простой спектрофотометрией. Во-первых, измерение не зависит от длины пути, потому что одна и та же длина пути используется для измерения как избыточного титранта, так и продукта. Во-вторых, измерение не зависит от линейного изменения оптической плотности как функции концентрации анализируемого вещества, как это определено законом Бера-Ламберта. В-третьих, это полезно для образцов, содержащих частицы, которые мешают на длинах волн, обычно используемых для аналита.
Комплексометрическое титрование основывается на образовании комплекса между аналит и титрант. Как правило, они требуют специализированных комплексометрических индикаторов, которые образуют слабые комплексы с аналитом. Наиболее распространенным примером является использование индикатора крахмала для повышения чувствительности йодометрического титрования, при этом темно-синий комплекс крахмала с йодом и йодидом более заметен, чем один йод. Другими комплексометрическими показателями являются эриохром черный T для титрования ионов кальция и магния и хелатирующий агент EDTA <141.>используется для титрования ионов металлов в растворе.
Титрование с дзета-потенциалом - это титрование, в котором завершение контролируется с помощью дзета-потенциала, а не с помощью индикатор, для характеристики гетерогенных систем, таких как коллоиды. Одно из применений - определение изоэлектрической точки , когда поверхностный заряд становится нулевым, что достигается изменением pH или добавлением поверхностно-активного вещества.. Другое использование - определение оптимальной дозы для флокуляции или стабилизации.
Анализ - это тип биологического титрования, используемый для определения концентрации вируса . или бактерия. Серийные разведения выполняются на образце в фиксированном соотношении (например, 1: 1, 1: 2, 1: 4, 1: 8 и т. Д.) До тех пор, пока последнее разведение не даст положительного результата теста на присутствие вируса. Положительное или отрицательное значение может быть определено путем визуального осмотра инфицированных клеток под микроскопом или иммуноферментным методом, таким как иммуноферментный анализ (ELISA). Это значение известно как титр.
К различным методам определения конечной точки относятся:
 Элементарный pH-метр, который можно использовать для отслеживания реакций титрования.
Элементарный pH-метр, который можно использовать для отслеживания реакций титрования. Хотя термины «точка эквивалентности» и «конечная точка» часто используются используются как взаимозаменяемые, это разные термины. Точка эквивалентности - это теоретическое завершение реакции: объем добавленного титранта, при котором количество молей титранта равно количеству молей анализируемого вещества или некоторому кратному ему (как в полипротонном кислоты). Конечная точка - это то, что фактически измеряется, физическое изменение решения, определяемое индикатором или инструментом, упомянутым выше.
Есть небольшая разница между конечной точкой и точкой эквивалентности титрование. Эта ошибка называется ошибкой индикатора и является неопределенной.
Обратное титрование - это титрование в обратном направлении; вместо титрования исходного образца в раствор добавляется известный избыток стандартного реагента, который титруется. Обратное титрование полезно, если конечную точку обратного титрования легче определить, чем конечную точку обычного титрования, как в случае реакций осаждения. Обратное титрование также полезно, если реакция между аналитом и титрантом очень медленная или когда аналит находится в не- растворимом твердом веществе.
В процессе титрования создаются растворы с составом от чистой кислоты до чистого основания. Определение pH, связанного с любой стадией процесса титрования, относительно просто для монопротоновых кислот и оснований. Присутствие более чем одной кислотной или основной группы усложняет эти вычисления. Графические методы, такие как эквилиграф, давно используются для учета взаимодействия связанных равновесий. Эти графические методы решения просты в реализации, однако используются нечасто.
 Учащимся средней школы демонстрируется титрование.
Учащимся средней школы демонстрируется титрование. | На Викискладе есть материалы, связанные с титрованием. |
| Найдите титрование в Викисловаре, бесплатном словаре. |