 Две митохондрии из легочной ткани млекопитающих с их матриксом и мембранами, как показано с помощью электронной микроскопии
Две митохондрии из легочной ткани млекопитающих с их матриксом и мембранами, как показано с помощью электронной микроскопии | Клеточная биология | |
|---|---|
 Компоненты типичной животной клетки: Компоненты типичной животной клетки:
| |
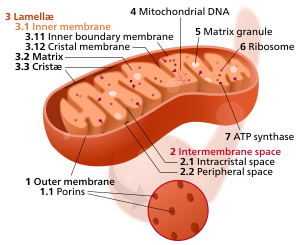 компоненты типичной митохондрии компоненты типичной митохондрии
3Ламелла.
4Митохондр иальная ДНК. 5Матричная гранула. 6Рибосома. 7АТФ-синтаза . |
митохондрия (, множественное число митохондрии ) представляет собой полуавтономная двойная мембранная связанная органелла, обнаруженная у представителей эукариотических организмов. Однако некоторые клетки некоторых многоклеточных организмов могут не иметь митохондрий (например, зрелые эритроциты млекопитающих). Ряд одноклеточных организмов, таких как микроспоридии, парабазалиды и дипломонады, также уменьшили или трансформировали свои митохондрии в другие структуры. На сегодняшний день известно, что только один эукариот, Monocercomonoides полностью потерял свои митохондрии, один многоклеточный организм Henneguya salminicola сохранил митохондрии. -связанные с ними органеллы в связи с полной утратой их митохондриального генома.
Слово митохондрия происходит от греческого μίτος, митос, «нить», и χονδρίον, хондрия, «гранула» или «зерноподобный». Митохондрии производят большую часть запаса аденозинтрифосфата (АТФ), используется в качестве источника который химической энергии. Таким образом, митохондрии называют электростанцией клетки.
Митохондрии обычно имеют площадь от 0,75 до 3 мкм ², но значительно различаются по размеру и структуре. Если специально не окрашен, они не видны. Помимо клеточной энергии митохондрии участвуют в других задачах, таких как передача сигналов, клеточная дифференцировка и гибель клеток, а также поддержание контроля над клеточный цикл и рост клеток. Митохондриальный биогенез, в свою очередь, координируется во времени с этими клеточными процессами. Митохондрии участвуют в нескольких заболеваниях человека, таких как митохондриальные нарушения, сердечная дисфункция, сердечная недостаточность и аутизм.
. Количество митохондрий в клетке может широко распространяться в зависимости от ткани, ткань и тип клеток. Например, эритроциты не имеют митохондрий, тогда как клетки печени могут иметь более 2000. органелла состоит из компартментов, которые имеют специализированные функции. Эти компартменты или области включают внешнюю мембрану, межмембранное пространство, внутреннюю мембрану и кристы и матрикс.
, хотя большую часть ДНК клетка содержится в ядре клетки, митохондрия имеет свой собственный независимый геном («митогеном»), который показывает существенное сходство с бактериальным геномы. Митохондриальные белки (белки, транскрибируемые из митохондриальной ДНК ) различаются в зависимости от ткани и вида. У людей было идентифицировано 615 различных типов белков из сердечных митохондрий, тогда как у крыс сообщалось о 940 белках. Считается, что митохондриальный протеом динамически регулируется.
Первые наблюдения внутриклеточных структур, которые, вероятно, представляли митохондрии, были опубликованы в 1840-х годах. Ричард Альтманн в 1890 году определил их как органеллы клетки и назвал их «биобластами». Термин «митохондрии» был введен Карлом Бендой в 1898 году. Леонор Михаэлис обнаружил, что Янус зеленый может быть в качестве суправитального красителя для митохондрий в 1900 году. В 1904 г. сделал первое зарегистрированное наблюдение митохондрий растений в клетках белой кувшинки Nymphaea alba, а в 1908 г. вместе с Клаудиусом Рего предположил, что они содержат белки и липиды. Бенджамин Ф. Кингсбери в 1912 году впервые связал их с клеточным дыханием, но почти исключительно на основании морфологических наблюдений. В 1913 году Отто Генрих Варбург связал частицы экстрактов печени морской свинки с дыханием, которые он назвал «грана». Варбург и Генрих Отто Виланд, которые также постулировали аналогичные механизмы частиц, не согласились с химической природой дыхания. Лишь в 1925 году Дэвид Кейлин открыл цитохромы, и дыхательная цепь была описана.
В 1939 году эксперименты с использованием измельченных мышц клетки действуют, что клеточное дыхание с использованием одного атома кислорода может образовывать две молекулы аденозинтрифосфата (АТФ), а в 1941 году Концепция фосфатных связей АТФ как формы энергии в клеточный метаболизм был разработан Фрицем Альбертом Липманном. В последующие годы механизм клеточного дыхания получил дальнейшее развитие, хотя его связь с митохондриями не была известна. Введение фракционирования тканей Альбертом Клодом провести митохондрии из других фракций клеток и провести биохимический анализ только на них. В 1946 году он пришел к выводу, что цитохромоксидаза и другие ферменты, ответственные за дыхательную цепь, были выделены из митохондрий. Юджин Кеннеди и Альберт Ленингер в 1948 году появилось, что митохондрии имеют место окислительного фосфорилирования у эукариот. Со временем метод фракционирования получил дальнейшее развитие, улучшив качество митохондрий, и было установлено, что другие элементы клеточного дыхания присутствуют в митохондриях.
Первый электрон высокого разрешения микрофотографии разрешения появились в 1952 году, заменив красители Янус Грин в качестве предпочтительного способа визуализации митохондрий. Это привело к более подробному анализу структуры митохондрий, подтверждение того, что они были окружены мембраной. Он также показал вторую мембрану внутри митохондрий, которая складывалась гребнями, разделяющими внутреннюю камеру, и что размер и форма митохондрий варьировались от клетки к клетке.
Популярный термин «электростанция клетки» был придуман Филипом Зикевицем в 1957 году.
В 1967 году было обнаружено, что митохондрии содержат рибосомы. В 1968 году были разработаны методы дрожжевой терапии митохондриальных генов, при этой генетической и физической карте митохондриальной ДНК завершена в 1976 году.
Существуют две гипотезы происхождения митохондрии: эндосимбиотические и аутогенные. Эндосимбиотическая гипотеза предполагает, что митохондрии изначально были прокариотическими клетками, способными реализовывать окислительные механизмы, которые были невозможны для эукариотических клеток; они стали эндосимбионтами, живущими внутри эукариот. Согласно автогенной гипотезе, митохондрии возникли в результате отщепления части ДНК от ядра эукариотической клетки во время расхождения с прокариотами; эта часть ДНК была бы заключена в мембраны, которые не могли бы пересечься белки. Митохондрии много общих черт с бактериями, эндосимбиотическая гипотеза получила более широкое признание.
A митохондрии содержат ДНК, которая организована как несколько копий одного, обычно кольцевого хромосома. Эта митохондриальная хромосома содержит гены белков редокс, например белков дыхательной цепи. Гипотеза CoRR предполагает, что это совместное расположение требуется для регуляции окислительно-восстановительного потенциала. Митохондриальный геном кодирует некоторые РНК из рибосом и 22 тРНК, необходимые для трансляции мРНК в белок. Круглая структура также встречается у прокариот. Протомитохондрия, вероятно, была связана с Rickettsia. Точное родство предка митохондрий с альфа-протеобактериями и то, образовалась ли митохондрия одновременно или после ядра, остается спорным. Например, было высказано предположение, что SAR11 клада бактерий имеет относительно недавнего общего предка с митохондриями, как показывает филогеномный анализ показывает, что митохонд произошли от протеобактерий линия, которая связями или является членом alphaproteobacteria.
Рибосомы, кодируемые митохондриальной ДНК, похожи на рибосомы бактерий по размеру и структуре. Они очень похожи на бактериальные рибосомы 70S, а не на 80S цитоплазматические рибосомы, которые кодируются ядерной ДНК.
эндосимбиотическая ь митохондрий с их клетками-хозяевами была популяризирована Линн Маргулис. эндосимбиотическая гипотеза предполагает, что митохондрии произошли от бактерий, каким-то образом пережили эндоцитоз другой клеткой, и вошли в цитоплазму. Способность этих бактерий обеспечивает дыхание в клетках-хозяевах, которые полагаются на гликолиз и ферментацию, обеспечила бы значительное эволюционное преимущество. Эти симбиотические отношения, вероятно, возникли от 1,7 до 2 миллиардов лет назад. Некоторые группы одноклеточных эукариот имеют только рудиментарные митохондрии или производные структуры: некоторые микроспоридии, метамонады и архамебы. Эти группы проявляются как наиболее примитивные эукариоты на филогенетических деревьях, построенных с использованием информации рРНК, которая когда-то предполагала, что они появились до возникновения митохондрий. Теперь известно, что это артефакт притяжения длинных ветвей - они являются производными и сохраняют гены или органеллы, полученные из митохондрий (например, митосомы и гидрогеносомы ). Таким образом, митохондрии, гидрогеносомы, митосомы и родственные органеллы, обнаруженные у некоторых loricifera (например, Spinoloricus ) и myxozoa (например, Henneguya zschokkei ) вместе классифицируются как MRO, органеллы, связанные с митохондриями.
Моноцеркомоноиды, по-видимому, полностью утратили свои митохондрии, и, по крайней мере, некоторые из митохондриальных функций, похоже, теперь выполняются цитоплазматическими белками.

 1 Наружная мембрана 1,1 Порины 2 Межмембранное пространство 2,1 Внутрикристальное пространство 2,2 Периферийное пространство 3 Lamellæ 3.1 Внутренняя мембрана 3.11 Внутренняя граничная мембрана 3.12 Кристаллическая мембрана 3,2 Матрица 3.3 Cristæ 4 Митохондриальная ДНК 5 Гранула Matix 6 Рибосома 7 АТФ-синтаза Редактировать · Исходное изображение Ультраструктура митохондрий (интерактивная диаграмма) Митохондрия имеет двойную мембрану; внутренний содержит его хемиосмотический аппарат и имеет глубокие бороздки, увеличивающие площадь его поверхности. Хотя митохондрии обычно изображаются как «апельсиновая колбаса с каплей внутри» (как здесь), митохондрии могут принимать разные формы, а их межмембранное пространство довольно тонкое.
1 Наружная мембрана 1,1 Порины 2 Межмембранное пространство 2,1 Внутрикристальное пространство 2,2 Периферийное пространство 3 Lamellæ 3.1 Внутренняя мембрана 3.11 Внутренняя граничная мембрана 3.12 Кристаллическая мембрана 3,2 Матрица 3.3 Cristæ 4 Митохондриальная ДНК 5 Гранула Matix 6 Рибосома 7 АТФ-синтаза Редактировать · Исходное изображение Ультраструктура митохондрий (интерактивная диаграмма) Митохондрия имеет двойную мембрану; внутренний содержит его хемиосмотический аппарат и имеет глубокие бороздки, увеличивающие площадь его поверхности. Хотя митохондрии обычно изображаются как «апельсиновая колбаса с каплей внутри» (как здесь), митохондрии могут принимать разные формы, а их межмембранное пространство довольно тонкое. Митохондрии содержат внешнюю и внутреннюю мембраны, состоящие из фосфолипидные бислои и белки. Две мембраны имеют разные свойства. Благодаря этой двухмембранной митохондрии, состоящей из пяти различных частей. Это:
Митохондрии, лишенные своей внешней мембраны, представляют собой так называемые митопласты.
внешняя митохондриальная мембрана, которая охватывает весь органеллу, имеет толщину от 60 до 75 Угрем (Å). Он имеет соотношение белков и фосфолипидов, аналогичное происхождение клеточной мембраны (примерно 1: 1 по весу). Он содержит большое количество интегральных мембранных белков, называемых поринами. Основным транспортным белком является порообразующий потенциалзависимый анионный канал (VDAC). VDAC является первичным транспортером нуклеотидов, первой и метаболитов между цитозолем и межмембранным пространством. Он сформирован в виде бета-ствола, который охватывает внешнюю мембрану, аналогично мембране грамотрицательных бактерий. Более крупные белки могут проникать в митохондрии, если сигнальная последовательность на их N-конце связывается с большим мультисубъединичным белком, называемым транслоказой на внешней мембране, который активно перемещает их через мембрану. Митохондриальные протеины импортируются через специализированные транслокационные комплексы.
Наружная мембрана также содержит ферменты, участвующие в таких разнообразных действиях, как удлинение жирных кислот, окисление эпинефрина, и разложение триптофана. Эти ферменты включают моноаминоксидазу, ротенон, -нечувствительную NADH-цитохром с-редуктазу, кинуренин гидроксилазу и жирную кислоту Co-A <382.>лигаза. Нарушение внешней мембраны позволяет протеинам из межмембранного пространства просачиваться в цитозоль, что приводит к гибели клеток. Наружная мембрана митохондрий может ассоциироваться с мембраной эндоплазматического ретикулума (ER) в структуре, называемой MAM (митохондриально-ассоциированная ER-мембрана). Это важно для передачи сигналов кальция в ER-митохондриях и участвует в переносе липидов между ER и митохондриями. С внешней внешней мембраны есть маленькие (диаметром 60 Å) частицы, называемые частичками Парсона.
митохондриальное межмембранное пространство - это пространство между внешней и внутренней мембранами. Оно известно также как перимитохондриальное пространство. Внешняя мембрана свободно проницаема для малых молекул, слабые молекулы, такие как ионы и сахара, в межмембранном пространстве такие же, как в цитозоле. Однако большие белки должны иметь определенную внешнюю сигнальную последовательность, чтобы транспортироваться через белковый состав, поэтому белковый состав отличается от белкового состава цитозоля. Один белок, локализованный таким образом в межмембранном пространстве, - это цитохром с.
Внутренняя митохондриальная мембрана содержит белки с тремя типами функций:
Он содержит более 151 различных полипептидов и имеет очень высокое содержание белка соотношение α-фосфолипидов (более 3: 1 по весу, что составляет примерно 1 белок на 15 фосфолипидов). Внутренняя мембрана содержит около 1/5 всего белка митохондрии. Кроме того, внутренняя мембрана богата необычным фосфолипидом кардиолипином. Этот фосфолипид был первоначально обнаружен в сердцах коров в 1942 году и обычно характерен для митохондриальных и бактериальных плазматических мембран. Кардиолипин содержит четыре жирные кислоты, а не две, и может помочь сделать внутреннюю мембрану непроницаемой. В отличие от внешней мембраны, внутренняя мембрана не содержит поринов и очень непроницаема для всех молекул. Практически все ионы и молекулы требуют специальных мембранных транспортеров для входа в матрицу или выхода из нее. Белки переносятся в матрикс через транслоказу внутренней мембраны (TIM) или через Oxa1. Кроме того, существует мембранный потенциал через внутреннюю мембрану, образованный действием ферментов цепи переноса электронов. Слияние внутренней мембраны опосредуется белком внутренней мембраны OPA1.
 Изображение поперечного сечения крист в митохондриях печени крысы, демонстрирующее вероятную трехмерную структуру и взаимосвязь с внутренней мембраной
Изображение поперечного сечения крист в митохондриях печени крысы, демонстрирующее вероятную трехмерную структуру и взаимосвязь с внутренней мембраной Внутренняя митохондриальная мембрана разделена на многочисленные кристы, которые увеличивают площадь поверхности внутренней митохондриальной мембраны, повышая ее способность производить АТФ. Для типичных митохондрий печени площадь внутренней мембраны примерно в пять раз больше внешней мембраны. Это соотношение варьируется, и митохондрии из клеток, которые имеют большую потребность в АТФ, таких как мышечные клетки, содержат еще больше крист. Митохондрии в одной и той же клетке могут иметь существенно разнуюплотность криста, те, которые необходимы для производства большего количества энергии, имеют гораздо большую поверхность криста-мембраны. Эти складки усеяны небольшими круглыми телами, известными как F1частицы или оксисомы. Это не простые случайные складки, а скорее инвагинации внутренних мембран, которые могут влиять на общую хемиосмотическую функцию.
Одно недавнее исследование с математическим моделированием показало, что оптические свойства кристов в нитчатых митохондриях может влиять на генерацию и распространение света в ткани.
Матрица - это пространство, ограниченное внутренней мембраной. Он содержит около 2/3 всех белков митохондрии. Матрикс играет важную роль в производстве АТФ с помощью АТФ-синтазы, содержащийся во внутренней мембране. Матрикс содержит высококонцентрированную смесь сотен ферментов, специальных митохондриальных рибосом, тРНК и нескольких копий митохондриальной ДНК генома. Из ферментов основные функции включают окисление пирувата и жирных кислот, а также цикл лимонной кислоты. Молекулы ДНК упаковываются в нуклеоиды с помощью белков, один из которых TFAM.
. Митохондрии имеют собственный генетический материал и оборудование для производства собственных РНК и белков (см.: биосинтез белка ). Опубликованная последовательность митохондриальной ДНК человека выявила 16 569 пар оснований, кодирующих 37 генов: 22 тРНК, 2 рРНК и 13 пептид гена. 13 митохондриальных пептидов у человека интегрированы во внутреннюю митохондриальную мембрану вместе с белками, кодируемыми генами, находящимися в ядре <809 клетки-хозяина.>Митохондриально-ассоциированная мембрана ER (MAM) Митохондриально-ассоциированная мембрана ER (MAM) - это еще один структурный элемент, который все больше признается за его критическую роль в клеточной физиологии и гомеостазе. Когда-то считавшиеся технические загвоздкой в методх клеточного фракционирования, предполагаемые контаминанты ER везикул, которые неизменно появлялись в митохондриальной фракции, были идентифицированы как мембранные структуры, происходящие из MAM - интерфейса между митохондриями и ER. Физическая связь между этими двумя органеллами ранее наблюдалась на электронных микрофотографиях, недавно была исследована с помощью флуоресцентной микроскопии. Такие исследования показывают, что в МАМ, который может составлять до 20% внешней митохондриальной мембраны, ЭПР и митохондрии разделены всего на 10-25 нм и удерживаются вместе белковыми связующими комплексами. Очищенный МАМ от субклеточного фракционирования, как было показано, обогащается ферментами, участвующими в обмене фосфолипидов, в дополнение к каналу, с передачей сигналов Са. Эти намеки на выдающуюся роль MAM в регуляции клеточных липидных запасов и сигналов были подтверждены со значительными последствиями для митохондриально-ассоциированных клеточных явлений, как обсуждается ниже. МАМ не только предоставил понимание механистической, лежащей в основе таких физиологических процессов, как внутренний апоптоз и распространение кальциевых сигналов, но также основы более точному представлению о митохондриях. Хотя его часто рассматривают как статические, изолированные `` электростанции '', используемые для метаболизма в результате древнего эндосимбиотического события, эволюция MAM подчеркивает степень интеграции митохондрий в общую физиологию клетки с тесным физическим и функциональным взаимодействием с эндомембранной системой. МАМ обогащения ферментами, участвующими в биосинтезе липидов, такими как фосфатидилсеринсинтаза на поверхности ER и фосфатидилсерин декарбоксилаза на поверхности митохондрий. Предоставьте собой динамические механизмыеллы, подвергающиеся постоянно митющимся событиям деления и слияния, они требуют постоянного и хорошо регулируемого поступления фосфолипидов для целостности мембраны. Но митохондрии - это не только место назначения фосфолипидов, синтез которых они завершают; скорее, эта органелла также играет роль в межорганическом перемещении промежуточных продуктов биосинтеза фосфолипидов, метаболизма церамидов и холестерина и анаболизма гликосфинголипидов. Такая способность к перемещению зависит от MAM, что было показано для облегчения переноса промежуточных липидов между органеллами. В противоположность стандартному везикулярному механизму переноса липидов, данные указывают на то, что физическая близость ER и митохондриальных мембран в MAM делает возможным переключение липидов между противоположными бислоями. Несмотря на этот необычный и, казалось бы, энергетически невыгодный механизм, такой транспорт не требует АТФ. Вместо этого было показано, что у дрожжей он зависит от связывания связывания мультипротеинов, называемой ER-митохондриальной структурой встречи, или ERMES, хотя остается неясным, напрямую ли эта структура опосредует перенос липидов или требуется для сохранения мембраны находиться в достаточно непосредственной близости, чтобы снизить энергетический барьер для липида переброса. МАМ также может быть секреторным пути, своей ролью во внутриклеточном перемещении липидов. В частности, МАМ, по-видимому, является промежуточным местом назначения между грубым ER и Гольджи на пути, который ведет к липопротеину очень низкой плотности или ЛПОНП, сборке и секреции. Таким образом, МАМ наиболее важным метаболизма и транспортировки липидов. Критическая роль ER в передаче сигналов кальция была признана еще до того, как такая роль митохондрий получила широкое признание, отчасти из-за низкого сродства Са-каналов, локализованных к внешнему митохондриям. Мембрана, по-видимому, противоречит предполагаемой способности этого органеллы реагировать на изменения внутриклеточного потока Са. Но данная MAM способствует передаче Са от ЭР к митохондриям, что приводит к образованию микродоменов. Передача происходит в ответ на так называемые «затяжки Са», генерируемые спонтанной кластеризацией и активацией IP3R, канонического Са-канала мембраны ЭР. Судьба этих затяжек - в частности, они остаются ограниченными изолированными местами или интегрированными волнами Ca распространения по клетке - в степени это определяется динамикой MAM. Хотя повторный захват Са ЭР (одновременно с его высвобождением) модулирует интенсивность затяжек, таким образом изолируя митохондрии до определенного эффекта воздействия Са, МАМ часто служит брандмауэром, по существу буферизует затяжки Са, действуя как сток в какие свободные ионы, созданные в цитозоль, могут быть задействованы. Это туннелирование Ca происходит через низкоаффинный рецептор Ca VDAC1, который, как недавно было показано, физически привязан к кластерам IP3R на мембране ER и обогащен в MAM. Способность митохондрий служить стоком Са является результатом электрохимического градиента, генерируемого время окислительного фосфорилирования, что делает туннелирование катиона экзергоническим процессом. Нормальный, умеренный приток кальция из цитозоля в митохондриальный матрикс вызывает временную деполяризацию, которая корректируется путем откачки протонов. Но передача Са не является однонаправленной; скорее, это улица с двусторонним движением. Свойства кальциевого насоса SERCA и канала IP3R, присутствующего на мембране ER, способствуют регулированию обратной связи, координируемому функции MAM. В частности, клиренс Са посредством МАМ позволяет формировать пространственно-временныйтерн передачи сигналов Са, поскольку Са изменяет активность IP3R двухфазным образом. SERCA аналогичным образом зависит от обратной связи митохондрий: захвата СаМ стимулирует выработку АТФ, тем самым энергию, которая позволяет SERCA перезагружать ЭР Са для продолжения оттока Са в МАМ. Таким образом, МАМ не является пассивным буфером для затяжек с кальцием; скорее он помогает модулировать дальнейшую передачу сигналов Ca через петли обратной связи, которые влияют на динамику ER. Регулирование высвобождения Са в ЭР в МАМ особенно важно, потому что только определенное наращивание Са поддерживает митохондрии и, следовательно, клетку в гомеостазе. Достаточная передача сигналов Са внутриорганелл необходим для стимуляции метаболизма активации ферментов дегидрогеназы, критических для прохождения цикла лимонной кислоты. Однако, как только передача сигналов Са в митохондриях преодолевает определенный порог, она частично стимулирует внутренний путь апоптоза за счет коллапса потенциала митохондриальной мембраны, необходимого для метаболизма. Исследования, изучающие роль систем и антиапоптотических факторов, следующие эту модель; Например, антиапоптотический фактор Bcl-2, как было показано, взаимодействует с IP3R, снижающим наполнение ЭР кальцием, что приводит к уменьшению оттока в МАМ и предотвращает постапоптотические стимулы стимулов митохондриальной мембраны. Учитывая потребность в такой тонкой регуляции передачи сигналов Са, возможно, неудивительно, что дисрегулируемый митохондриальный Са участвовал в нескольких нейродегенеративных заболеваниях, в то время как каталог опухолевых супрессоров включает несколько, которые обогащены MAM. Недавние успехи в идентификации привязок между митохондриальной и ER-мембрами предполагают, что поддерживающая функция используемых молекулярных элементов вторична по отношению к другим, неструктурным функциям. Мультибелковый комплекс взаимодействующих ER- и митохондриально-резидентных мембранных белков, необходимых для переноса липидов в MAM, демонстрирует этот принцип. Один из его компонентов, например, является составной частью белкового комплекса, необходимого для встраивания трансмембранных бета-стволовых белков в липидный бислой. Однако гомологПеренос фосфолипидов
Передача сигналов кальция
Молекный основа для привязки
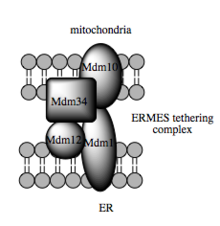 Модель дрожжевого мультимерного связывающего комплекса, ERM
Модель дрожжевого мультимерного связывающего комплекса, ERM МАМ является важным центром передачи сигналов, метаболизма и трафика в клетке, который позволяет интегрировать ER и физиологию митохондрий. Связь между этим органеллами является не только структурной, но также функциональной и имеет решающее значение для общей клеточной физиологии и гомеостаза. Таким образом, MAM предлагает взгляд на митохондрии, который расходится с традиционным взглядом на эту органеллу как на статичную изолированную единицу, приспособленную для ее метаболической способности клеткой. Напротив, этот интерфейс митохондрий-ER подчеркивает интеграцию митохондрий, продукта эндосимбиотического события, в разнообразные клеточные процессы. Недавно было также показано, что митохондрии и MAM-ы в нейронах прикреплены к специализированным участкам межклеточной коммуникации (так называемые соматические соединения). Процессы микроглии контролируют и защищают функции нейронов на этих участках, и предполагается, что MAM-ы играют важную роль в этом типе контроля качества клеток.
 Типичный митохондриальная сеть (зеленый) в двух клетках человека (клетки HeLa )
Типичный митохондриальная сеть (зеленый) в двух клетках человека (клетки HeLa )Митохондрии (и родственные структуры) обнаружены во всех эукариотах (кроме двух - оксимонад Monocercomonoides и Henneguya salminicola). Хотя обычно они изображаются как бобовидные структуры, они образуют высокодинамичную сеть в большинстве клеток, где они постоянно подвергаются делению и слиянию. Популяция всех митохондрий данной клетки составляет хондриом. Митохондрии различаются по количеству и расположению в зависимости от типа клеток. Одна митохондрия часто встречается у одноклеточных организмов. И наоборот, размер хондриома клеток печени человека велик, с примерно 1000–2000 митохондрий на клетку, составляющими 1/5 объема клетки. Митохондриальное содержание в схожих клетках может существенно различаться по размеру и мембранному потенциалу, причем различия возникают из-за источников, включая неравномерное распределение при делениях клеток, что приводит к внешним различиям в уровнях АТФ и последующим клеточным процессы. Митохондрии могут располагаться между миофибриллами мышцы или обернутыми вокруг сперматозоидов жгутика. Часто они образуют сложную трехмерную разветвленную сеть внутри клетки с цитоскелетом. Связь с цитоскелетом определяет форму митохондрий, которая также может влиять на функцию: различные структуры митохондриальной сети могут давать населению различные физические, химические и сигнальные преимущества или недостатки. Митохондрии в клетках всегда распределяются по микротрубочкам, и распределение этих органелл также коррелирует с эндоплазматическим ретикулумом. Недавние данные свидетельствуют о том, что виментин, один из компонентов цитоскелета, также имеет решающее значение для ассоциации с цитоскелетом.
Наиболее важными функциями митохондрий являются для производства энергетической валюты клетки, АТФ (т.е. фосфорилирования АДФ ), посредством дыхания и для регулирования клеточного метаболизма. Центральный набор реакций, участвующих в производстве АТФ, известен под общим названием цикл лимонной кислоты или цикл Кребса. Однако митохондрия выполняет много других функций помимо производства АТФ.
Доминирующей ролью митохондрий является производство АТФ, что отражается в большом количестве белков во внутренней мембране для этой задачи. Это происходит путем окисления основных продуктов глюкозы : пирувата и НАДН, которые продуцируются в цитозоле. Этот тип клеточного дыхания, известный как аэробное дыхание, зависит от присутствия кислорода, который обеспечивает большую часть выделяемой энергии. Когда кислород ограничен, гликолитические продукты будут метаболизироваться посредством анаэробной ферментации, процесса, который не зависит от митохондрий. Производство АТФ из глюкозы и кислорода дает примерно в 13 раз больший выход при аэробном дыхании по с ферментацией. Митохондрии растений также могут быть ограниченное количество АТФ без кислорода, используя альтернативный субстрат нитрит. АТФ проходит через внутреннюю мембрану с помощью специфического белка и через внешнюю мембрану через порины. ADP возвращается по тому же самому.
Молекулы пирувата, продуцируемые гликолизом, активно транспортируются через внутреннюю митохондриальную мембрану и в матрикс, где они могут быть окислены и в сочетании с коферментом A с образованием CO 2, ацетил-CoA и NADH, или они могут быть карбоксилированы (по пируваткарбоксилаза ) с образованием оксалоацетата. Эта последняя реакция «восполняет» количество оксалоацетата в цикле лимонной кислоты и, следовательно, анаплеротической реакцией, увеличивая способность циклировать ацетил-КоА, когда ткани требуется энергия (например, в мышцы ) внезапно увеличиваются из-за активности.
В цикле лимонной кислоты все промежуточные соединения (например, цитрат, изо-цитрат, альфа -кетоглутарат, сукцинат, фумарат, малат и оксалоацетат) регенерируются во время каждого цикла цикла. Таким образом, добавление большего количества из этих промежуточных продуктов к митохондрии означает, что дополнительное количество продолжается в пределах одного цикла, увеличенное количество всех других промежуточных продуктов по мере того, как одно превращается в другое. Следовательно, его добавление имеет катаплеротический эффект, поскольку он имеет анаплеротический эффект. Эти анаплеротические реакции будут в течение цикла увеличиваться или уменьшать количество оксалоацетата, доступного для объединения с ацетил-КоА с образованием лимонной кислоты. Это, в свою очередь, увеличивает или уменьшает скорость производства АТФ митохондрией и, следовательно, доступность АТФ для клетки.
Ацетил-КоА, с другой стороны, образует реакцию в результате окисления пирувата., или от бета-окисления жирных кислот, является единственным топливом, которое входит в цикл лимонной кислоты. При каждом повороте цикла одна молекула ацетил-КоА расходуется на каждую молекулу оксалоацетата, присутствующего в митохондриальном матриксе, и никогда не регенерируется. Именно окисление ацетатной части ацетил-КоА приводит к образованию CO 2 и воды, при этом высвобождаемая энергия улавливается в форме АТФ.
В печени карбоксилирование из цитозольного пирувата в оксалоацетат внутри митохондрий является ранней стадией глюконеогенного пути, который превращает лактат и деаминируется аланин в глюкозу под высокими уровнями глюкагона и / или адреналина в крови. Здесь добавление оксалоацетата к митохондрии не имеет чистого анаплеротического эффекта, поскольку другой промежуточный продукт цикла лимонной кислоты (малат) немедленно удаляется из митохондрии и превращается в цитозольный оксалоацетат, который в итоге превращается в глюкозу в процессе, который почти противоположен гликолизу.
Ферменты цикла лимонной кислоты расположены в митохондриальном матриксе, за исключением сукцинатдегидрогеназы, которая связывает с внутренней митохондриальной мембраной как часть Комплекс II. Цикл лимонной кислоты окисляет ацетил-КоА до диоксида углерода и в процессе производит восстановленные кофакторы (три молекулы NADH и одна молекула FADH 2 ), которые являются электронами для переноса электронов и молекула GTP (которая легко превращается в АТФ).
 Цепь переноса электронов в митохондриальном межмембранном пространстве
Цепь переноса электронов в митохондриальном межмембранном пространстве электроны от NADH и FADH 2 переносятся на кислород (O 2), богатая энергией молекула и водород (протоны) в несколько этапов через цепь переноса электронов. Молекулы НАДН и ФАДН 2 продуцируются в матриксе посредством цикла лимонной кислоты, но также продуцируются в цитоплазме посредством гликолиза. Восстанавливающие эквиваленты из цитоплазмы могут быть импортированы через систему малат-аспартатный челнок белков антипортер или поданы в цепи переноса электронов с использованием глицеринфосфата челнок. Белковые комплексы во внутренней мембране (НАДН-дегидрогеназа (убихинон), цитохром-с-редуктаза и цитохром-с-оксидаза ) перенос, дополнительное высвобождение энергии используется для закачки протонов (H) в межмембранное пространство. Этот процесс эффективен, но небольшой процент электронов может преждевременно восстанавливать кислород, образуя активные формы кислорода, такие как супероксид. Это может вызвать окислительный стресс в митохондриях и может вызвать снижение митохондриальной функции, происхождение процесса старения.
По мере увеличения концентрации протонов в межмембранном пространстве, сильное электрохимический градиент устанавливается через внутреннюю мембрану. Протоны могут возвращаться в матрицу через комплекс АТФ-синтазы, и их потенциальная энергия используется для синтеза АТФ из АДФ и неорганического фосфата (P i). Этот процесс называется хемиосмосом и впервые был описан Питером Митчеллом, который был удостоен за свою работу Нобелевской премии по химии 1978 года. Позже часть Нобелевской программы по химии 1997 года была присуждена Полу Д. Бойеру и Джону Э. Уокеру за их разъяснение рабочего механизма АТФ-синтазы.
При определенных условиях протоны могут повторно проникать в митохондриальный матрикс, не участвуя в синтезе АТФ. Этот процесс известен как утечка протонов или митохондриальное разобщение и происходит из-за облегченной диффузии протонов в матрицу. Процесс приводит к высвобождению высвобожденной потенциальной энергии протонного электрохимического градиента в виде тепла. Этот процесс опосредуется протонным каналом, называемым термогенином или UCP1. Термогенин представляет собой белок 33 k Da, впервые открытый в 1973 году. Термогенин в основном содержит в коричневой жировой ткани или коричневом жире и отвечает за термогенез без бези. Коричневая жировая ткань обнаруживает высокий уровень млекопитающих, и ее уровень наблюдается в раннем возрасте и у животных, находящихся в спячке. У людей коричневая ткань присутствует при рождении и уменьшается с возрастом.
 Передача электронная микрофотография хондроцита, окрашены на кальций, современный его ядро (N) и митохондрии (M).
Передача электронная микрофотография хондроцита, окрашены на кальций, современный его ядро (N) и митохондрии (M). Концентрации свободного кальция в клетке могут регулировать параметры сигнала и важны для передачи в клетке. Митохондрии могут временно накапливать кальций, способствующий гомеостазу кальция в клетке. Фактически, их способность быстро усваивать кальций для последующего высвобождения делает их очень хорошими «цитозольными буферами» для кальция. Эндоплазматический ретикулум (ER) является важным местом хранения кальция. Кальций поглощается матрицей с помощью митохондри унипортера кальция на внутренней митохондриальной мембране. Это в первую очередь обусловлено митохондриальным мембранным потенциалом. Высвобождение этого кальция внутрь клетки может происходить через обменный белок натрий-кальций или через пути «кальций-индуцированного высвобождения кальция». Это может вызвать скачки кальция или волны кальция большими изменениями мембранного потенциала. Они могут активировать серию белков системы вторичных мессенджеров, которые могут координировать такие процессы, как высвобождение нейромедиатора в нервных клетках и гормонов в эндокринных клетках.
Приток Са в митохондриальном матриксе недавно был задействован как механизм регуляции респираторной биоэнергетики, позволяющий электрохимическому потенциалу через мембрану временно «пульсировать» от ΔΨ-доминирующего до pH-доминирующего, уменьшая окислительного стресса. В нейронах сопутствующее увеличение цитозольного и митохондриального кальция синхронизирует активность нейронов с митохондриальным энергетическим метаболизмом. Уровень кальция в митохондриальном матриксе может достичь десятков микромолярных уровней, что необходимо для активации изоцитратдегидрогеназы, из ключевых регуляторных ферментов цикла Кребса.
Митохондрии играют центральную роль во многих других метаболических задач, таких как:
Некоторые функции митохондрий выполняются только в определенных типах клеток. Например, митохондрии в клетках печени содержат ферменты, которые позволяют им детоксифицировать аммиак, побочный продукт метаболизма белков. Мутация в генах, регулирующих любую из этих функций, может привести к митохондриальным заболеваниям.
Взаимосвязь между клеточной пролиферацией и митохондриями была исследована с использованием рака шейки HeLa клеток. Опухолевым клеткам требуется достаточное количество АТФ (аденозинтрифосфат ) для синтеза биоактивных соединений, таких как липиды, белки и нуклеотиды для быстрого размножения клеток. Большая часть АТФ в опухолевых клетках генерируется посредством пути окислительного фосфорилирования (OxPhos). Было показано, что вмешательство OxPhos вызывает остановку клеточного цикла, что позволяет предположить, что митохондрии играют роль в пролиферации клеток. Продукция митохондриального АТФ также жизненно важна для клеточного деления и дифференцировки при инфекции в дополнение к основным функциям, включая клетки нормы концентрации растворенного вещества и клеточной архитектуры. Уровни АТФ клеточного клеточного различаются на разных стадиях цикла, что позволяет предположить, что существует взаимосвязь между включением АТФ и способностью клетки вступать в новый цикл. Роль АТФ в основных функциях клетки делает клеточный цикл чувствительным к изменениям в доступности митохондриального производного АТФ. Различия в уровнях АТФ на разных стадиях клеточного цикла подтверждают гипотезу о том, что митохондрии восстанавливают роль в регуляции клеточного цикла. Доказано, что контрольные точки низкоэнергетического клеточного цикла контролируют энергетическую способность перед переходом к следующему этапу деления клетки, хотя подтверждают механизмы между митохондриями и регуляцией клеточного цикла не совсем понятны.
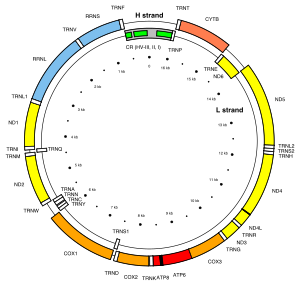 184>кольцевой 16 569 п.н. митохондриального генома человека, кодирующего 37 генов, т. Е. 28 на H-цепи и 9 на L-цепи.
184>кольцевой 16 569 п.н. митохондриального генома человека, кодирующего 37 генов, т. Е. 28 на H-цепи и 9 на L-цепи. Митохондрии содержат собственный геном, что свидетельствует о том, что они произошли от бактерий посредством эндосимбиоз. Геном предкового эндосимбионта потерял часть своих генов, так что большой митохондриальный геном (митогеном) является одним из наиболее редуцированных геномов у организма.
митохондриальный геном человека представляет собой кольцевую молекулу ДНК примерно 16 килобаз. Он кодирует 37 генов: 13 для субъединиц респираторных комплексов I, III, IV и V, 22 для митохондриальной тРНК (для 20 стандартных аминокислот плюс дополнительный ген для лейцина и серин) и 2 для рРНК. Одна митохондрия может содержать от двух до десяти копий своей ДНК.
Как и у прокариот, здесь очень высокая доля кодирующей ДНК и отсутствие повторов. Митохондриальные гены транскрибируются как мультигенные транскрипты, которые расщепляются и полиаденилируются с образованием зрелых мРНК. Не все белки, необходимые для митохондриальной функции, кодируются митохондриальным геномом; Большинство из них кодируется генами в клеточном ядре, и соответствующие белки импортируются в митохондрии. Точное количество генов, кодируемых ядром и митохондриальным геномом, различается у разных видов. Большинство митохондриальных геномов имеют круглую форму, хотя есть исключения об исключении. В общем, митохондриальная ДНК не имеет интронов, как это имеет место в митохондриальном геноме человека; однако интроны наблюдались в некоторых митохондриальных ДНК эукариот, таких как интроны дрожжей и протистов, включая Dictyostelium discoideum. Между областями, кодирующими белок, присутствуют тРНК. Во время транскрипции тРНК приобретают характерную L-форму, которая распознается и расщепляется специфическими ферментами. Гены митохондриальной тРНК используют, отличные от ядерных тРНК, но двойные митохондриальные тРНК были обнаружены в ядерных хромосомах с высоким сходством последовательностей.
У животных митохондриальный геном обычно представляет собой один кольцевой хромосома длиной примерно 16 т.п.н. и имеет 37 генов. Гены, хотя и являются высококонсервативными, могут различаться по местоположению. Любопытно, что этот образец не встречается у вшей человеческого тела (Pediculus humanus ). Вместо этого этот митохондриальный геном организован в 18 минициркулярных хромосом, каждая из которых имеет длину 3-4 т.п.н. и имеет от одного до трех генов. Этот образец также встречается у других сосущих вшей, но не у жевательных вшей. Было показано, что между минихромосомами происходит рекомбинация. Причина такой разницы неизвестна.
Хотя небольшие вариации стандартного генетического кода были предсказаны ранее, когда исследователи, изучающие митохондриальные гены человека, определили, что не было обнаружено до 1979 года, они использовали альтернативный код. Однако митохондрии других эукариот, включая большинство растений, используют стандартный код. С тех пор было установлено множество различных вариантов, включая альтернативные митохондриальные коды. Кроме того, все кодоны AUA, AUC и AUU являются допустимыми стартовыми кодонами.
| Организм | Кодон | Стандартный | Митохондрии |
|---|---|---|---|
| Митохондрии | AGA, AGG | Аргинин | Стоп-кодон |
| Беспозвоночные | AGA, AGG | Аргинин | Серин |
| Грибы | CUA | Лейцин | Треонин |
| Все вышеперечисленное | AUA | Изолейцин | Метионин |
| UGA | Стоп-кодон | Триптофан |
Некоторые из этих различий следует рассматривать как псевдоизменения в генетическом коде из-за явлений, которое является обычным для митохондрий. Считалось, что у высших растений CGG кодирует триптофан, а не аргинин ; однако было обнаружено, что кодон в процессированной РНК является кодоном UGG, что соответствует стандартному генетическому коду для триптофана. Следует отметить, что генетический код митохондрий членистоногих претерпевал параллельную эволюцию внутри филума, при этом некоторые организмы однозначно переводили AGG в лизин.
Митохондриальные геномы имеют гораздо меньше генов, чем бактерии, от которых они, как считается, произошли. Хотя некоторые из них были полностью потеряны, многие из них были перенесены в ядро , например, белковые субъединицы респираторного комплекса II. Считается, что это относительно обычное явление на протяжении эволюционного времени. Некоторые организмы, такие как Cryptosporidium, действительно митохондрии без какой-либо ДНК, предположительно потому, что все их гены были потеряны или перенесены. У Cryptosporidium митохондрии имеют измененную систему генерации АТФ, которая делает паразита устойчивым ко многим классическим митохондриальным ингибиторам , таким как цианид, азид, и атоваквон.
Митохондрии делятся на бинарное деление, подобно делению бактериальных клеток. Регуляция этого деления у эукариот разная. У многих одноклеточных эукариот их рост и деление связаны с клеточным циклом. Например, отдельная митохондрия может делиться синхронно с ядром. Этот процесс деления и сегрегации необходимо строго контролировать, чтобы каждая дочерняя клетка получила по крайней мере одну митохондрию. У других эукариот (например, у млекопитающих) митохондрии могут реплицировать свою ДНК и делиться в основном в ответ на энергетические потребности клетки, а не в фазе с клеточным циклом. Когда энергетические потребности клетки высоки, митохондрии растут и делятся. Когда потребление энергии низкое, митохондрии разрушаются или становятся неактивными. В таких примерах и в отличие от ситуации во многих одноклеточных эукариотах митохондрии, по-видимому, случайным образом распределяются по дочерним клеткам во время деления цитоплазмы. Понимание динамики митохондрий, которая описывается как баланс между слиянием митохондрий и делением, показало, что функциональные и структурные изменения в морфологии митохондрий являются важными факторами патологий, связанных с несколькими болезненными состояниями.
Гипотеза бинарного деления митохондрий основана на визуализации с помощью флуоресцентной микроскопии и обычной просвечивающей электронной микроскопии (ТЕМ). Разрешение флуоресцентной микроскопии (~ 200 нм) недостаточно для различения структурных деталей, таких как двойная митохондриальная мембрана в митохондриальном делении, или даже для различения отдельных митохондрий, когда несколько митохондрий расположены близко друг к другу. Обычный ПЭМ также имеет некоторые технические ограничения при проверке деления митохондрий. Криоэлектронная томография недавно была использована для визуализации деления митохондрий в замороженных гидратированных интактных клетках. Выяснилось, что митохондрии делятся за счет образования почкования.
Митохондриальные гены человека не наследуются по тому же механизму, что и ядерные гены. Обычно митохондрии наследуются только от одного родителя. У людей, когда яйцеклетка оплодотворяется спермой, ядро яйцеклетки и ядро сперматозоида вносят равный вклад в генетический состав ядра зиготы. Напротив, митохондрии и, следовательно, митохондриальная ДНК обычно происходят только из яйца. Митохондрии сперматозоидов входят в яйцеклетку, но не передают эмбриону генетическую информацию. Вместо этого отцовские митохондрии помечают убиквитином, чтобы выбрать их для дальнейшего разрушения внутри эмбриона. Яйцеклетка содержит относительно мало митохондрий, но именно эти митохондрии выживают и делятся, чтобы заселить клетки взрослого организма. Таким образом, митохондрии в большинстве случаев наследуются только от матери, и этот паттерн известен как материнское наследование. Этот режим наблюдается у большинства организмов, включая большинство животных. Однако митохондрии у некоторых видов иногда могут передаваться по отцовской линии. Это норма для некоторых хвойных растений, но не для сосны и тис. Для Mytilids отцовское наследование происходит только внутри самцов данного вида. Было высказано предположение, что это происходит в очень низком уровне у людей. В 2012 году в статье в Current Biology было высказано предположение, что митохондрии, сокращающие продолжительность жизни мужчин, остаются в системе, потому что они передаются по наследству только от матери. Напротив, естественный отбор отсеивает митохондрии, которые снижают выживаемость самок, поскольку такие митохондрии с меньшей вероятностью будут переданы следующему поколению. Поэтому предполагается, что самки человека и самки животных живут дольше самцов. Авторы утверждают, что это частичное объяснение. Доктор Том Кирквуд, профессор старения в Университете Ньюкасла, прокомментировал статью: «Я, конечно, не думаю, что это открытие объясняет, почему женщины живут на пять-шесть лет дольше мужчин».
Однородительское наследование приводит к небольшой возможности генетической рекомбинации между различными линиями митохондрий, хотя одна митохондрия может содержать 2–10 копий своей ДНК. По этой причине обычно считается, что митохондриальная ДНК воспроизводится посредством бинарного деления. То, что действительно происходит, поддерживает генетическую целостность, а не разнообразие. Однако есть исследования, показывающие доказательства рекомбинации в митохондриальной ДНК. Понятно, что ферменты, необходимые для рекомбинации, присутствуют в клетках млекопитающих. Кроме того, данные свидетельствуют о том, что митохондрии животных могут подвергаться рекомбинации. Данные о людях немного более противоречивы, хотя существуют косвенные доказательства рекомбинации. Если рекомбинации не происходит, вся последовательность митохондриальной ДНК представляет собой единственный гаплотип, что делает его полезным для изучения эволюционной истории популяций.
Можно ожидать, что сущности, подвергающиеся монородительскому наследованию и практически не имеющие рекомбинации, будут подвержены храповику Мюллера, неумолимому накоплению вредных мутаций до тех пор, пока функциональность не будет потеряна. Популяции животных в митохондриях избегают этого накопления благодаря процессу развития, известному как узкое место мтДНК. Узкое место использует случайные процессы в клетке для увеличения межклеточной изменчивости мутантной нагрузки по мере развития организма: одна яйцеклетка с некоторой долей мутантной мтДНК, таким образом, производит эмбрион, в котором разные клетки имеют разные мутантные нагрузки. Затем отбор на клеточном уровне может действовать для удаления тех клеток с большим количеством мутантной мтДНК, что приводит к стабилизации или снижению мутантной нагрузки между поколениями. Механизм, лежащий в основе узкого места, обсуждается, и недавнее математическое и экспериментальное метаисследование предоставило доказательства комбинации случайного разделения мтДНК при делении клетки и случайного оборота молекул мтДНК внутри клетки.
Митохондрии могут восстанавливать окислительные повреждения ДНК с помощью механизмов, аналогичных тем, которые происходят в ядре клетки. Белки, которые используются в репарации мтДНК, кодируются ядерными генами и перемещаются в митохондрии. Пути репарации ДНК в митохондриях млекопитающих включают эксцизионную репарацию оснований, репарацию двухцепочечных разрывов, прямую реверсию и репарацию несоответствия. Также повреждения ДНК могут быть обойдены, а не восстановлены с помощью синтеза трансформации.
Из нескольких процессов репарации ДНК в митохондриях, путь эксцизионной репарации оснований является наиболее изученным. Эксцизионная репарация оснований осуществляется последовательностью стадий, катализируемых ферментативными методами, которые включаютраспознавание и удаление поврежденного основания ДНК, удаление образовавшегося абазического сайта, обработка концов, заполнение пробелов и лигирование. Обычное повреждение мтДНК, которое восстанавливается с помощью эксцизионной репарации оснований, - это 8-оксогуанин, полученный окислением гуанина.
Двухцепочечные разрывы могут быть восстановлены с помощью гомологичной рекомбинации ремонт как в мтДНК млекопитающих, так и в мтДНК растений. Двухцепочечные разрывы в мтДНК также можно репарировать с помощью опосредованного микрогомологией соединения концов. Хотя есть доказательства процессов репарации прямой реверсии и репарации ошибочного спаривания в мтДНК, эти процессы все еще недостаточно хорошо изучены.
Эукариотические клетки обычно имеют митохондриальную ДНК; однако митохондрии, в которых отсутствует собственная ДНК, были обнаружены у морских паразитов динофлагеллят из рода Amoebophyra. Этот микроорганизм, A. cerati, имеет функциональные митохондрии, в которых отсутствует геном. У родственных видов митохондриальный геном по-прежнему имеет три гена, но у A. cerati обнаружен только один митохондриальный ген - ген цитохром с оксидазы I (cox1), и он мигрировал в геном
Практически полное отсутствие генетической рекомбинации в митохондриальной ДНК делает ее использование информации для ученых, занимающихся популяционной генетикой и эволюционная биология. Меры всяохондриальной ДНК наследуется как единое целое, или гаплотип, взаимосвязи между митохондриальной ДНК от разных людей представлены в виде гаплотипа. Паттерны в этих генных деревьях можно использовать для вывода эволюционной истории популяций. Классическим примером этого эволюционная генетика человека, где молекулярные часы люди для обозначения новой даты митохондриальной Евы. Это часто интерпретируется как решительная поддержка недавней экспансии современного человечества из Африки. Другой пример человека - это секвенирование митохондриальной ДНК из костей неандертальца. Относительно большое эволюционное расстояние между механизмами митохондриальной ДНК неандертальцев и живых людей было истолковано как свидетельство отсутствия межпородного скрещивания между неандертальцами и анатомически современными людьми.
Однако митохондриальная ДНК только история самок в населенном поселении. население и поэтому может не отражать историю населения в целом. Частично это можно преодолеть за счет использования отцовских генетических последовательностей, таких как нерекомбинирующий участок Y-хромосомы. В более широком смысле, только исследования, которые также включают ядерную ДНК, предоставляют полную эволюционную историю популяции.
Недавние измерения молекулярных часов митохондриальной ДНК сообщили о 1 мутации каждые 7884 лет, относящееся к последнему общему предку людей и обезьян, что согласуется с оценками частоты мутаций аутосомной ДНК (10 на основе поколения.
Повреждение и последующая дисфункция митохондрий важными факторами ряда заболеваний человека из-за их влияния на клеточный метаболизм., включая аутизм. Они также могут проявляться как миопатия, диабет, множественная эндокринопатия и ряд других систем расстройств. мтДНК, включая Синдром Кирнса - Сейра, синдром MELAS ome и. В подавляющем большинстве случаев этих заболеваний передаются от женщины ее детям, так как зигота получает свои митохондрии и, следовате льно, свою мтДНК из яйцеклетки. Считается, что такие заболевания, как синдром Кернса-Сейра, синдром Пирсона и прогрессирующая внешняя офтальмоплегия, вызваны крупномасштабными перестройками мтДНК, тогда как другие заболевания, такие как синдром MELAS, наследственная оптика Лебера. нейропатия, миоклоническая эпилепсия с рваными красными волокнами (MERRF) и другие возникают из-за точечных мутаций в мтДНК.
При других заболеваниях дефекты ядерных генов приводят к дисфункции митохондриальных белков. Это имеет место при атаксии Фридрейха и болезни Вильсона. Эти заболевания наследуются по принципу доминирования, как и большинство других генетических заболеваний. Различные нарушения могут быть вызваны ядерными мутациями ферментов окислительного фосфорилирования, такими как дефицит кофермента Q10 и синдром Барта. Влияние окружающей среды может взаимодействовать с наследственной предрасположенностью и вызывать митохондриальные заболевания. Например, может существовать связь между воздействием пестицида и более поздним началом болезни Паркинсона. Другие патологии, этиология связанных с митохондриальной дисфункцией, включают шизофрению, биполярное расстройство, деменцию, болезнь Альцгеймера, болезнь Паркинсона, эпилепсию, инсульт, сердечно-сосудистые заболевания, синдром хронической усталости, пигментный ретинит и сахарный диабет.
Митохондрии- опосредованный окислительный стресс играет роль в кардиомиопатии у диабетиков 2 типа. Повышенная доставка жирных кислот приводит к увеличению поглощения жирных кислот кардиомиоцитами, что приводит к усилению окисления жирных кислот в этих клетках. Этот процесс увеличивает количество соответствующих эквивалентов, доступных электронной транспортной цепи митохондрий, в конечном итоге увеличивая производство активных форм кислорода (АФК). АФК увеличивает разъединяющие белки (UCP) и усиливает утечку протонов через транслокатор аденин-нуклеотидов (ANT), комбинация которого разъединяет митохондрии. Увеличивает потребление кислорода митохондриями, усугубляя усиление окисления жирных кислот. Это создается порочный круг разъединения; более того, даже если потребление кислорода увеличивается, синтез АТФ не увеличивает пропорционально, что митохондрии не связаны. Меньшая доступность АТФ в этой таблице приводит к дефициту энергии, проявляющемуся в снижении сердечной эффективности и сократительной дисфункции. Проблема усугубляется тем, что нарушение высвобождения кальция в саркоплазматическом ретикулуме и снижение обратного захвата пик митохондриями ограничивают уровень цитозольного важного сигнального иона во время сокращения мышц. Снижение внутримитохондриальной накопления кальция дегидрогеназы и синтез АТФ. Таким образом, путем снижения синтеза АТФ из-за окисления жирных кислот, синтез АТФ также нарушается плохой передачи сигналов кальция, вызывая сердечные проблемы у диабетиков.
цепи роли митохондрии, являющиеся источником энергии клетки, могут иметь место некоторая утечка высокоэнергетических электронов в дыхательной среде с образованием активных форм кислорода. Считалось, что это приводит к значительному окислительному стрессу в митохондриях с высокой скоростью мутации митохондриальной ДНК (мтДНК). Предполагаемые связи между старением и окислительным стрессом не были предложены в 1956 году, что позже было переработано в митохондриальную свободнорадикальную теорию старения. Считается, что возникает порочный цикл, приводящий к окислительному стрессу митохондриальной ДНК.
В процессе старения в митохондриях может произойти ряд изменений. В тканях пациентов пожилого возраста наблюдается снижение ферментативной активности белков дыхательной цепи. Однако мутированная мтДНК может быть обнаружена только примерно в 0,2% очень старых клеток. Предполагается, что большие делеции в митохондриальном геноме приводят к высоким уровням окислительного стресса и гибели нейронов при болезни Паркинсона. Дисфункция митохондрий также проявляется в боковом амиотрофическом склерозе.
Мадлен Л'Энгл 1973 года научная фантастика роман Ветер в Дверь заметно выделяет митохондрии главного героя Чарльза Уоллеса Мэрри, поскольку они населены существами, известными как фарандолы. В романе также есть другие персонажи, путешествующие внутри одной из митохондрий Марри.
1995 фантастика ужасов роман Parasite Eve автора Хидэаки Сена изображает митохондрии как обладающие некоторым сознанием и способности контролировать разум, пытаясь использовать их, чтобы обогнать эукариот как доминирующую форму жизни. Этот текст был адаптирован в одноименный фильм, видеоигру и продолжение видеоигры, все с похожей предпосылкой.
Во франшизе Звездных войн микроорганизмы, называемые «мидихлорианами», дают некоторым персонажам способность ощущать и использовать Силу. Джордж Лукас, режиссер фильма 1999 года Звездные войны: Эпизод I - Призрачная угроза, в котором были представлены мидихлорианы, описал их как «нечеткое изображение митохондрий». Вымышленный род бактерий Midichloria позже был назван в честь мидихлориан из «Звездных войн».
В результате того, что митохондрии широко используются в современном американском научном образовании, фраза «митохондрии - это электростанция клетки» стала интернет-мемом.
Общие
| На Викискладе есть материалы, связанные с Митохондриями. |