 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Emcyt, Estracyt |
| Другие названия | ЭМИ; Leo 299; NSC-89199; Ro 21-8837 / 001; Эстрадиол, нормустин фосфат; Эстрадиол 3-нормустин 17β-фосфат; Эстрадиол 3- (бис (2-хлорэтил) карбамат) 17β- (дигидрофосфат) |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a608046 |
| Данные лицензии |
|
| Беременность. категория |
|
| Способы введения. | Внутрь |
| Класс препарата | Химиотерапевтическое средство ; эстроген ; Сложный эфир эстрогена |
| Код ATC | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Биодоступность | 44–75% (как эстрамустин и эстрромустин) |
| Связывание с белками | • Эстрадиол: 98%. • Эстрон: 96% |
| Метаболизм | Печень, кишечник |
| Метаболиты | • Эстрамустин. • Эстромустин. • Эстрадиол. • Эстрон. • Фосфорная кислота. • Нормустин |
| Период полувыведения | • EMP: 1,27 часа. • Эстромустин: 10–14 часов. • Эстрон: 15–17 часов |
| Выведение | Желчь, кал (2,9–4,8%) |
| Идентификаторы | |
наименование IUPAC
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBan k | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL <81756>817>CompTox Dashboard (EPA ) | |
| ECHA InfoCard | 100.023.193 |
| Химические и физические данные | |
| Формула | C23H32Cl2NO6P |
| Молярная масса | 520,38 г · моль |
| 3D-модель (JSmol ) | |
УЛЫБКИ
| |
InChI
| |
Эстрамустинфосфат (EMP ), также известный как эстрадиол-нормустинфосфат и продаваемый под торговыми марками Emcyt и Estracyt, представляет собой двойной эстроген и химиотерапевтический препарат, который используется для лечения рака простаты у мужчин. Его принимают несколько раз в день перорально или инъекцией в вену.
Побочные эффекты ЭМИ включают тошноту, рвоту, гинекомастия, феминизация, демаскулинизация, сексуальная дисфункция, тромбы и сердечно-сосудистые осложнения. EMP представляет собой двойное цитостатическое и, следовательно, химиотерапевтическое средство и гормональное противоопухолевое средство типа эстроген. Это пролекарство эстрамустина и эстромустина с точки зрения его цитостатических эффектов и пролекарство эстрадиола по отношению к его эстрогенные эффекты. EMP оказывает сильное эстрогенное действие в типичных клинических дозировках и, следовательно, имеет отмеченные антигонадотропные и функциональные антиандрогенные эффекты.
EMP был представлен для медицинского применения в начале 1970-х годов. Он доступен в США, Канаде, Соединенном Королевстве, других европейских странах и в других странах мира.
EMP показан в США для паллиативного лечения метастатического метастатического и / или прогрессирующий рак простаты, тогда как в Соединенном Королевстве он показан для лечения неотзывчивого или рецидивирующего рака простаты. Лекарство обычно предназначено для применения в случаях гормонорезистентного рака простаты, хотя оно также использовалось в качестве монотерапии первой линии. Показатели эффективности при раке простаты с ЭМИ эквивалентны обычным высокие дозы эстрогена терапия.
Из-за своих относительно серьезных побочных эффектов и токсичности ЭМП редко использовался при лечении рака простаты. Это особенно верно в странах Запада сегодня. В результате, а также из-за редких побочных эффектов модуляторов гонадотропин-рилизинг-гормона (модуляторов GnRH), таких как лейпрорелин, от ЭМП почти отказались. Однако обнадеживающие результаты клинических исследований привели к возобновлению интереса к ЭМП для лечения рака простаты.
ЭМИ использовался в дозах от 140 до 1400 мг / день перорально. Было обнаружено, что низкие дозы, такие как 280 мг / день, имеют сравнимую эффективность с более высокими дозами, но с улучшенной переносимостью и пониженной токсичностью. Дозы 140 мг / день были описаны как очень низкие дозы. EMP использовался в дозах от 240 до 450 мг / день внутривенно.
EMP и другие эстрогены, такие как полиэстрадиолфосфат и этинилэстрадиол, намного дешевле, чем новые методы лечения такие как модуляторы гонадолиберина, ацетат абиратерона и энзалутамид. Кроме того, эстрогены могут иметь значительные преимущества по сравнению с другими средствами андрогенной депривации, например, в отношении потери костной массы и переломов, приливов, познание и метаболический статус.
EMP использовался для предотвращения обострения тестостерона в начале терапии агонистом GnRH у мужчин с раком простаты.
| Маршрут / форма | Эстроген | Дозировка | |
|---|---|---|---|
| Пероральный | Эстрадиол | 1-2 мг 3 раза в день | |
| Конъюгированные эстрогены | 1,25–2,5 мг 3 раза в день | ||
| Этинилэстрадиол | 0,15–3 мг / день | ||
| Сульфонат этинилэстрадиола | 1-2 мг 1 раз в неделю | ||
| Диэтилстильбестрол | 1–3 мг / день | ||
| Диенестрол | 5 мг / день | ||
| Гексестрол | 5 мг / день | ||
| Фосфестрол | 100–480 мг 1–3 раза в день | ||
| Хлортрианизен | 12–48 мг / день | ||
| Квадросилан | 900 мг / день | ||
| Эстрамустин фосфат | 140–1400 мг / день | ||
| Трансдермальный пластырь | Эстрадиол | 2–6x 100 мкг / день. Скро тал: 1x 100 мкг / день | |
| IM или SCинъекция | бензоат эстрадиола | 1,66 мг 3 раза в неделю | |
| дипропионат эстрадиола | 5 мг 1x / нед | ||
| валерат эстрадиола | 10 –40 мг 1x / 1-2 недели | ||
| эстрадиола ундецилат | 100 мг 1x / 4 недели | ||
| Полиэстрадиолфосфат | самостоятельно: 160-320 мг 1x / 4 недели. перорально EE : 40–80 мг 1 раз в 4 недели | ||
| Эстрон | 2–4 мг 2–3 раза в неделю | ||
| IVинъекция | Фосфестрол | 300–1200 мг 1–7 раз в неделю | |
| Эстрамустин фосфат | 240–450 мг / день | ||
| Примечание: Дозировки не обязательно эквивалентны. Источники: См. Шаблон. | |||
EMP существует или был доступен в форме как капсул (140 мг, 280 мг) для перорального введения, и водной растворы (300 мг) для внутривенной инъекции.
EMP противопоказан при применении у детей, пациентов гиперчувствительности к эстрогенам или азотные иприты, пациенты с пептической язвой (язва в пищеварительном тракте ), пациенты с тяжелым нарушением функции печени, со слабыми сердечными мышцами (также известными как миокардиальная недостаточность ) и с тромбоэмболическими расстройствами или осложнениями, связанными с задержка жидкости.
Побочные эффекты ЭМИ в целом были описаны как относительно серьезные. Сообщалось, что наиболее частыми побочными эффектами EMP являются побочные эффекты со стороны желудочно-кишечного тракта, такие как тошнота, рвота и диарея с тошнотой и рвота встречается у 40% мужчин. Обычно они легкой или средней степени тяжести, а тошноту и рвоту можно контролировать с помощью профилактических противорвотных препаратов. Тем не менее, в тяжелых случаях побочных эффектов со стороны желудочно-кишечного тракта при приеме ЭМП может потребоваться снижение дозы или прекращение терапии. Хотя тошнота и рвота, как сообщается, являются наиболее частыми побочными эффектами ЭМП, было обнаружено, что гинекомастия (развитие мужской груди) встречается у 83% мужчин, получавших ЭМИ, и частота возникновения эректильная дисфункция, возможно, аналогична риску гинекомастии или немного меньше его. Как правило, феминизация, гиноидное распределение жира, демаскулинизация и импотенция встречаются практически или почти у 100% мужчин, получавших терапия высокими дозами эстрогенов. Сообщалось также о снижении сексуальной активности у мужчин, получавших EMP. Эти побочные эффекты обусловлены высоким уровнем эстрогена и низким уровнем тестостерона. Профилактическое облучение груди может использоваться для уменьшения частоты и тяжести гинекомастии с помощью эстрогенов.
Тяжелыми побочными эффектами ЭМП являются тромбоэмболия и сердечно-сосудистые осложнения, включая тромбоэмболию легочной артерии, тромбоз глубоких вен, инсульт, тромбофлебит, коронарную артерию заболевание (ишемическая болезнь сердца; например, инфаркт миокарда ), тромбофлебит и застойная сердечная недостаточность с задержкой жидкости. ЭМП вызывает сердечно-сосудистую токсичность, как и диэтилстильбестрол, но в меньшей степени по сравнению с низкими дозами (например, 280 мг / день перорального ЭМИ против 1 мг / день перорального диэтилстильбестрола). Состояние рака предстательной железы также увеличивает риск тромбоэмболии, а комбинация с доцетакселом также может повысить риск тромбоэмболии. Мета-анализы из клинических испытаний показали обнаружили, что общий риск тромбоэмболии при ЭМП составляет от 4 до 7% по сравнению с 0,4% для схем химиотерапии без ЭМП. Тромбоэмболия является основной причиной токсичности прекращения ЭМП. Антикоагулянтная терапия такими лекарствами, как аспирин, варфарин нефракционированные и низкомолекулярные гепарины и антагонисты витамина K могут быть полезны для снижения риска тромбоэмболии с помощью EMP и других эстрогенов, таких как диэтилстильбестрол и этинилэстрадиол.
Неблагоприятные тесты функции печени обычно наблюдаются при ЭМП, но тяжелая дисфункция печени возникает редко. Центральная Побочные эффекты нервной системы редко наблюдаются при ЭМП, хотя сообщалось о увеличении желудочков и нейрональной пигментации у обезьян, получавших очень высокие дозы ЭМП ( 20–140 мг / кг / день) в течение 3–6 месяцев. EMP, по-видимому, не оказывает цитостатического действия в нормальной мозговой ткани. У женщин, получавших EMP в клинических исследованиях, наблюдалось несколько случаев незначительных гинекологических кровоизлияний. ЭМП описывается как относительно хорошо переносимая цитостатическими противоопухолевыми препаратами и азотно-ипритными агентами, редко или совсем не связана со значительной гематологической токсичностью, такой как миелосупрессия (костная подавление костного мозга), желудочно-кишечная токсичность или другая более выраженная токсичность, связанная с такими агентами. В отличие от большинства других цитостатических агентов, которые часто вызывают миелосупрессию, лейкопения (снижение количества лейкоцитов ) и нейтропения (уменьшение нейтрофилов count), EMP фактически вызывает лейкоцитоз (увеличение количества лейкоцитов) в качестве побочного эффекта.
В небольшом исследовании с низкой дозой 280 мг / день перорально EMP в течение 150 дней, переносимость была значительно улучшена, при этом раздражение желудочно-кишечного тракта наблюдалось только у 15% мужчин, и не было случаев тяжелой сердечно-сосудистой токсичности или тромбоза глубоких вен. Кроме того, никаких других побочных эффектов, кроме небольшого преходящего повышения уровня ферментов печени, не наблюдалось. Эти данные свидетельствуют о том, что более низкие дозы перорального ЭМИ могут быть более безопасным вариантом, чем более высокие дозы для лечения рака простаты.
Клинического опыта передозировки ЭМП не было. Передозировка EMP может привести к выраженным проявлениям известных побочных эффектов лекарства. Специфического противоядия от передозировки ЭМП не существует. В случае передозировки следует использовать промывание желудка для эвакуации содержимого желудка по мере необходимости, а лечение должно быть симптоматическим и поддерживающим. В случае опасно низкого количества эритроцитов, лейкоцитов или тромбоцитов, цельная кровь может быть предоставлена по мере необходимости.. Функцию печени следует контролировать при передозировке ЭМИ. После передозировки ЭМП необходимо продолжать мониторинг гематологических и печеночных параметров в течение как минимум 6 недель.
ЭМИ использовался в высоких дозах, равных 1260 мг / день перорально и 240-450 мг / день внутривенной инъекцией.
EMP, как сообщается, увеличивает эффективность и токсичность трициклических антидепрессантов, таких как амитриптилин и имипрамин. Когда продукты, содержащие кальций, алюминий и / или магний, например молочные продукты, такие как молоко, различные продукты пищевые добавки и антациды потребляются одновременно с EMP, нерастворимым хелатным комплексом / фосфат соль между ЭМП и этими металлами может образовываться, и это может заметно ухудшить всасывание и, следовательно, перорально биодоступность ЭМП. Может быть повышенный риск ангионевротического отека у тех, кто одновременно принимает ингибиторы АПФ.
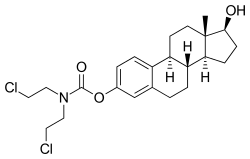 Эстрамустин, основная активная цитостатическая форма эстрамустинфосфата..
Эстрамустин, основная активная цитостатическая форма эстрамустинфосфата..  Эстрадиол, основная активная эстрогенная форма эстрамустинфосфата.
Эстрадиол, основная активная эстрогенная форма эстрамустинфосфата. EMP, также известный как эстрадиол-нормустинфосфат, представляет собой комбинированный сложный эфир эстрогена и азотистого иприта сложный эфир. Он состоит из эстрадиола, эстрогена, связанного с сложным эфиром фосфата, а также сложного эфира нормустина, азотистого иприта. С точки зрения своих фармакодинамических эффектов, EMP является пролекарством эстрамустина, эстромустина и эстрадиола. В качестве пролекарства эстрадиола EMP является эстрогеном и, следовательно, агонистом рецепторов эстрогена . Сам по себе EMP имеет очень слабое сродство к рецепторам эстрогена. Молекулярная масса препарата примерно на 91% выше, чем у эстрадиола, из-за присутствия в нем C3-нормустина и сложных фосфатных эфиров C17β. Поскольку ЭМП является пролекарством эстрадиола, его можно рассматривать как естественную и биоидентичную форму эстрогена, хотя он обладает дополнительной цитостатической активностью через эстрамустин и эстрромустин.
EMP действует по двойному механизму действия : 1) прямая цитостатическая активность посредством ряда действий; и 2) в виде формы терапии высокими дозами эстрогена посредством опосредованного рецептором эстрогена антигонадотропного и функционального антиандрогенного эффектов. Антигонадотропные и функциональные антиандрогенные эффекты EMP состоят в сильном подавлении гонадальной андрогена продукции и, следовательно, уровней циркулирующих андрогенов, таких как тестостерон ; значительно повышенные уровни глобулина, связывающего половые гормоны, и, следовательно, снижение доли свободных андрогенов в кровообращении ; и прямое антиандрогенное действие на клетки простаты. Индекс свободных андрогенов при пероральном ЭМП оказался в среднем в 4,6 раза ниже, чем при орхиэктомии. Таким образом, терапия ЭМП приводит к значительно более сильной андрогенной депривации, чем орхиэктомия. Метаболиты EMP, включая эстрамустин, эстрромустин, эстрадиол и эстрон, действуют как слабые антагонисты рецептора андрогена (EC50 = 0,5–3,1 мкМ), хотя клиническое значение этого неизвестно.
Чрезвычайно высокие уровни эстрадиола и эстрона возникают во время терапии ЭМП. Эстрогенные метаболиты ЭМП ответственны за его наиболее частые побочные эффекты и его сердечно-сосудистую токсичность. В некоторых публикациях ЭМП описывается как имеющий относительно слабый эстрогенный эффект. Тем не менее, он показал, по существу, те же уровни и степень эстрогенных эффектов, таких как болезненность груди, гинекомастия, сердечно-сосудистая токсичность, изменения в синтезе белка в печени и подавление тестостерона в виде высоких доз диэтилстильбестрола и этинилэстрадиола в клинических исследованиях. Представление о том, что EMP обладает относительно слабой эстрогеновой активностью, могло быть основано на исследованиях на животных, которые показали, что EMP оказывает в 100 раз более низкий утеротрофический эффект у крыс, чем эстрадиол, и может не иметь с учетом очень высоких доз ЭМП, используемых в клинических условиях у людей.
Механизм действия цитостатических эффектов ЭМП сложен и изучен лишь частично. Считается, что EMP в основном является ингибитором митоза, ингибирующим механизмы, участвующие в фазе митоза клеточного цикла . В частности, он связывается с белками, связанными с микротрубочками и / или с тубулином, и вызывает деполимеризацию микротрубочек (Kd= 10–20 мкМ для эстрамустина.), что приводит к остановке деления клеток в фазе G2/ M (в частности, метафазе ). Первоначально считалось, что EMP опосредует его цитостатические эффекты как пролекарство нормустина, азотистого иприта, и, следовательно, считалось алкилирующим противоопухолевым агентом. Однако последующие исследования показали, что EMP лишен алкилирующего действия и что влияние EMP на микротрубочки опосредуется интактным эстрамустином и эстромустином, при этом нормустин или эстрадиол сами по себе оказывают лишь незначительные или незначительные эффекты. Таким образом, уникальные свойства структур эстрамустина и эстромустина , содержащих связь карбамат --сложный эфир , по-видимому, ответственны за цитостатические эффекты ЭМП. В дополнение к антимитотическому действию, EMP также вызывает другие цитостатические эффекты, включая индукцию апоптоза, вмешательство в синтез ДНК, взаимодействие ядерного матрикса, изменения клеточной мембраны, индукция активных форм кислорода (свободных кислородных радикалов) и, возможно, дополнительные механизмы. Было обнаружено, что ЭМП оказывает радиосенсибилизирующее действие на рак простаты и глиомные клетки, а также улучшает чувствительность к лучевой терапии.
Цитостатик метаболиты EMP накапливаются в тканях селективным способом, например, в клетках рака простаты . Это может быть связано с присутствием специфического белка, связывающего эстрамустин (EMBP) (K d = 10–35 нМ для эстрамустина), также известного как простатин или белок секрета простаты (PSP), который был обнаружен в клетках рака простаты, глиомы, меланомы и рака груди. Утверждается, что из-за своей тканевой селективности EMP оказывает минимальное цитостатическое действие в здоровых тканях, и его тканевая селективность может быть ответственной за его терапевтическую цитостатическую эффективность против клеток рака простаты.
EMP изначально был разработан как пролекарство с двойным эфиром. эстрогена и нормустина в качестве противоопухолевого средства, алкилирующего азот иприта, которое из-за сродства эстрогеновой части к рецепторам эстрогена будет избирательно накапливаться в тканях-мишенях эстрогена и, следовательно, в опухоли, положительной по рецептору эстрогена ячеек. Следовательно, считалось, что EMP будет предпочтительно доставлять алкилирующую нормустиновую составляющую к этим тканям, позволяя снизить цитостатические эффекты в здоровых тканях и, следовательно, улучшить эффективность и переносимость. Однако последующие исследования показали, что существует очень ограниченное и медленное расщепление сложного эфира нормустина и что EMP лишен алкилирующей активности. Кроме того, похоже, что эстрамустин и эстрромустин могут преимущественно накапливаться в тканях-мишенях эстрогена не из-за сродства к рецепторам эстрогена, а из-за сродства к отдельным EMBP.
Чрезвычайно высокий, беременность -подобные уровни эстрадиола могут быть ответственны за лейкоцитоз (повышенное количество лейкоцитов ), который наблюдается у лиц, получавших EMP. Этот побочный эффект отличается от большинства других цитотоксических агентов, которые вместо этого вызывают миелосупрессию (подавление костного мозга ), лейкопению (снижение количества лейкоцитов) и нейтропения (снижение количества нейтрофилов ).
Было обнаружено, что ЭМП в дозе 280 мг / день подавляет уровень тестостерона у мужчин в диапазон кастрации (до 30 нг / дл) в течение 20 дней и в диапазон низкой кастрации (до 10 нг / дл) в течение 30 дней. Точно так же доза ЭМИ в дозе 70 мг / день подавляла уровни тестостерона до уровня кастрации в течение 4 недель.
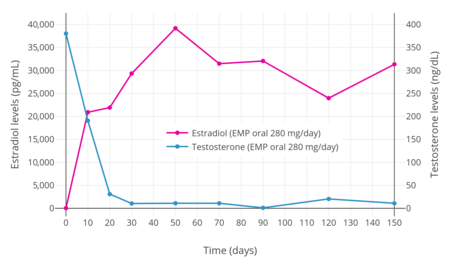 Уровни эстрадиола и тестостерона во время терапии 280 мг / день пероральным ЭМП у мужчин с раком простаты ( n = 11).
Уровни эстрадиола и тестостерона во время терапии 280 мг / день пероральным ЭМП у мужчин с раком простаты ( n = 11). | Параметр | IV300 мг | Перорально 420 мг |
|---|---|---|
| Cмакс | 506 ± 61 нг / мл | 362 ± 38 нг / мл |
| Tмакс | 2,6 ± 0,4 часа | 2,2 ± 0,2 часа |
| t1/2 | 10,3 ± 0,95 часа | 13,6 ± 3,09 часа |
| AUC 0–32 | 4,82 ± 0,62 | 2,88 ± 0,34 |
| Биодоступность | 100,0% | 43,7% ± 4,6% |
| Источники: | ||
| Метаболит | Плазма | Соотношение |
|---|---|---|
| Эстрамустин | 20,000–23,000 пг / мл | 1: 9,6–9,8 |
| Эстромустин | 191,000–267,000 пг / мл | |
| Эстрадиол | 4,900–9,000 пг / мл | 1: 9,4–11,8 |
| эстрон | 71000–85000 пг / мл | |
| Источники: | ||
При пероральном приеме ЭМП быстро и полностью дефосфорилируется фосфатазами до эстрамустин во время первого прохождения в желудочно-кишечном тракте. Эстрамустин также частично, но значительно окисляется в эстромустин с помощью 17β-гидроксистероиддегидрогеназ во время первого прохождения. Таким образом, EMP достигает циркуляции в виде эстрамустина и эстромустина, а основным метаболитом EMP является эстромустин. Ограниченное количество примерно от 10 до 15% эстрамустина и эстромустина далее медленно метаболизируется посредством гидролиза сложного эфира нормустина до эстрадиол и эстрон соответственно. Эта реакция, как полагают, катализируется карбамидазами, хотя гены, кодирующие ответственные ферменты, не охарактеризованы. Уровни циркулирующего нормустина, образованного из EMP, незначительны. Высвобождение азотного иприта газа из нормустина в результате расщепления группы карбоновой кислоты группы не было продемонстрировано и, похоже, не происходит. 405>
Пероральная биодоступность ЭМП низкая, что связано с глубоким метаболизмом первого прохождения; в частности, дефосфорилирование EMP. Пероральная биодоступность ЭМП, в частности эстрамустина и эстромустина, составляет от 44 до 75%, что позволяет предположить, что всасывание может быть неполным. В любом случае существует линейная зависимость между пероральной дозой EMP и циркулирующими уровнями эстрамустина и эстрромустина. Потребление кальция, алюминия или магния с пероральным ЭМП может заметно ухудшить его биодоступность из-за уменьшения всасывания из кишечника, и это может повлиять на его терапевтическую эффективность в низких дозах.
После однократного перорального приема 420 мг EMP у мужчин с раком простаты максимальный уровень эстромустина составлял от 310 до 475 нг / мл (475000 пг / мл) и произошло через 2-3 часа. Было обнаружено, что уровни эстрадиола при пероральном приеме ЭМП 280 мг / день повышаются до очень высоких концентраций в течение одной недели терапии. В одном исследовании уровни эстрадиола превышали 20 000 пг / мл через 10 дней, составляли около 30 000 пг / мл через 30 дней и достигали пика примерно 40 000 пг / мл через 50 дней. Другое исследование показало более низкие уровни эстрадиола от 4900 до 9000 пг / мл во время хронической терапии пероральным приемом ЭМИ 560 мг / день. Дополнительное исследование показало, что уровни эстрадиола составляют около 17000 пг / мл при пероральном приеме ЭМИ 140 мг / день и 38000 пг / мл при пероральном приеме 280 мг / мл. Сообщалось, что циркулирующие уровни эстрадиола и эстрона во время терапии ЭМП превышают нормальные уровни у мужчин более чем в 100 и 1000 раз соответственно. Уровни эстрамустина и эстрадиола в кровотоке заметно ниже, чем у эстрромустина и эстрона, соответственно, при соотношении примерно 1:10 в обоих случаях. Тем не менее, уровни эстрадиола во время терапии ЭМП, по-видимому, аналогичны уровням, которые наблюдаются в середине и конце беременности, и варьируются от 5000 до 40 000 пг / мл. При пероральном введении в кровотоке не наблюдается неизмененного EMP.
Фармакокинетика EMP отличается при внутривенной инъекции. После однократной внутривенной инъекции 300 мг EMP уровни EMP были выше, чем уровни его метаболитов в течение первых 8 часов. Вероятно, это происходит из-за обхода метаболизма первого прохождения. Однако через 24 часа после введения дозы неизмененный ЭМИ больше не обнаруживался в кровотоке. клиренс EMP из плазмы крови составляет 4,85 ± 0,684 л / ч. объемы распределения EMP при внутривенной инъекции были небольшими; в модели с двумя отсеками объем распределения для центрального отсека составлял 0,043 л / кг, а для периферийного отсека составлял 0,11 л / кг. Связывание EMP с белками плазмы высокое. Эстрамустин накапливается в опухолевой ткани, например в ткани рака простаты и глиомы, при этом уровни эстрамустина в этих тканях намного выше, чем в плазме (например, 6,3- и В 15,9 раза соответственно). Напротив, уровни эстромустина в опухоли по сравнению с плазмой аналогичны (1,0 и 0,5 раза, соответственно). Эстрамустин и эстромустин, по-видимому, накапливаются в жировой ткани.
. Период полувыведения эстрромустина при пероральном приеме ЭМП составлял в среднем 13,6 часа с диапазоном от 8,8 до 22,7 часа. Напротив, период полувыведения эстромустина при внутривенной инъекции составлял 10,3 часа с диапазоном от 7,36 до 12,3 часа. Для сравнения, соответствующие периоды полувыведения эстрона составляли 16,5 и 14,7 часа для перорального и внутривенного введения, соответственно. Estramustine and estromustine are mainly excreted in bile and hence in feces. They are not believed to be excreted in urine.
 Metabolism of oral estramustine phosphate in humans.
Metabolism of oral estramustine phosphate in humans.EMP, also known as estradiol 3-normustine 17β-phosphate or as estradiol 3-(bis(2-chloroethyl)carbamate) 17β-(dihydrogen phosphate), is a synthetic estrane steroid and a derivative of estradiol. It is an estrogen ester ; specifically, EMP is a diester of estradiol with a C3 normustine (nitrogen mustard –carbamate moiety ) ester and a C17β phosphate ester. EMP is provided as the sodium or meglumine salt. EMP is similar as a compound to other estradiol esters such as estradiol sulfate and estradiol valerate, but differs in the presence of its nitrogen mustard ester moiety.Antineoplastic agents related to EMP, although none of them were marketed, include alestramustine, atrimustine, cytestrol acetate, estradiol mustard, ICI-85966, and phenestrol.
Due to its hydrophilic phosphate ester moiety, EMP is a readily water-soluble compound. This is in contrast to most other estradiol esters, which are fatty acid esters and lipophilic compounds that are not particularly soluble in water. Unlike EMP, estramustine is highly lipophilic, practically insoluble in water, and non-ionizable. The phosphate ester of EMP was incorporated into the molecule in order to increase its water solubility and allow for intravenous administration.
| Estrogen | Structure | Ester(s) | Relative. mol. weight | Relative. E2content | logP | ||||
|---|---|---|---|---|---|---|---|---|---|
| Position(s) | Moiet(ies) | Type | Length | ||||||
| Estradiol | – | – | – | – | 1.00 | 1.00 | 4.0 | ||
| Estradiol acetate | C3 | Ethanoic acid | Straight-chain fatty acid | 2 | 1.15 | 0.87 | 4.2 | ||
| Estradiol benzoate | C3 | Benzenecarboxylic acid | Aromatic fatty acid | – (~4–5) | 1.38 | 0.72 | 4.7 | ||
| Estradiol dipropionate | C3, C17β | Propanoic acid (×2) | Straight-chain fatty acid | 3 (×2) | 1.41 | 0.71 | 4.9 | ||
| Estradiol valerate | C17β | Pentanoic acid | Straight-chain fatty acid | 5 | 1.31 | 0.76 | 5.6–6.3 | ||
| Estradiol benzoate butyrate | C3, C17β | Benzoic acid, butyric acid | Mixed fatty acid | – (~6, 2) | 1.64 | 0.61 | 6.3 | ||
| Estradiol cypionate | C17β | Cyclopentylpropanoic acid | Aromatic fatty acid | – (~6) | 1.46 | 0.69 | 6.9 | ||
| Estradiol enanthate | C17β | Heptanoic acid | Straight-chain fatty acid | 7 | 1.41 | 0.71 | 6.7–7.3 | ||
| Estradiol dienanthate | C3, C17β | Heptanoic acid (×2) | Straight-chain fatty acid | 7 (×2) | 1.82 | 0.55 | 8.1–10.4 | ||
| Estradiol undecylate | C17β | Undecanoic acid | Straight-chain fatty acid | 11 | 1.62 | 0.62 | 9.2–9.8 | ||
| Estradiol stearate | C17β | Octadecanoic acid | Straight-chain fatty acid | 18 | 1.98 | 0.51 | 12.2–12.4 | ||
| Estradiol distearate | C3, C17β | Octadecanoic acid (×2) | Straight-chain fatty acid | 18 (×2) | 2.96 | 0.34 | 20.2 | ||
| Estradiol sulfate | C3 | Sulfuric acid | Water-soluble conjugate | – | 1.29 | 0.77 | 0.3–3.8 | ||
| Estradiol glucuronide | C17β | Glucuronic acid | Water-soluble conjugate | – | 1.65 | 0.61 | 2.1–2.7 | ||
| Estramustine phosphate | C3, C17 β | Normustine, phosphoric acid | Water-soluble conjugate | – | 1.91 | 0.52 | 2.9–5.0 | ||
| Polyestradiol phosphate | C3–C17β | Phosphoric acid | Water-soluble conjugate | – | 1.23 | 0.81 | 2.9 | ||
| Footnotes:= Length of ester in carbon atoms for straight-chain fatty acids or approximate length of ester in carbon atoms for arom атиновые жирные кислоты. = Относительное содержание эстрадиола по массе (т. Е. Относительное эстрогенное воздействие). = Экспериментальный или прогнозируемый коэффициент распределения октанол / вода (т.е. липофильность / гидрофобность ). Получено из PubChem, ChemSpider и DrugBank. = Также известен как фосфат эстрадиола и нормустина. = Полимер из эстрадиолфосфата (~ 13 повторяющихся единиц ). = Относительная молекулярная масса или содержание эстрадиола на повторяющуюся единицу. = logP повторяющейся единицы (т. е. эстрадиолфосфата). Источники: См. Отдельные статьи. | |||||||||
ЭМИ был впервые синтезирован в середине 1960-х годов и был запатентован в 1967 году. Первоначально он был разработан для лечения рака груди.. Идея EMP была вдохновлена поглощением и накоплением радиоактивно меченных эстрогенов в ткани рака груди. Однако первоначальные клинические результаты ЭМП у женщин с раком груди были неутешительными. Впоследствии было обнаружено, что радиоактивно меченый ЭМП поглощается и накапливается в предстательной железе крысы, и это открытие привело к тому, что лекарство было перепрофилировано для лечения рака простаты. ЭМИ был введен для медицинского применения при лечении этого состояния в начале 1970-х годов и был одобрен в Соединенных Штатах для этого показания в 1981 году. Первоначально ЭМИ был введен для использования посредством внутривенных инъекций. Впоследствии был введен пероральный состав, а от внутривенного препарата почти отказались в пользу перорального варианта.
EMP предоставляется в качестве натрия соль для перорального введения, имеющая родовые названия эстрамустинфосфат натрия (USAN ) и эстрамустина натрия фосфата (BANM, JAN ), а также в качестве соли меглумина для внутривенного введения, которая имеет общее название эстрамустинфосфат меглумин. INNM представляет собой эстрамустин фосфат. Название эстрамустинфосфат является сокращением эстрадиол-нормустинфосфата. EMP также известен под кодовыми названиями Leo 299, Ro 21-8837 и Ro 21-8837 / 001.
EMP чаще всего продается под торговыми марками Estracyt. и Emcyt, но также продавался под рядом других торговых марок, включая Amsupros, Biasetyl, Cellmustin, Estramustin HEXAL, Estramustina Filaxis, Estranovag, Multosin, Multosin Injekt, Proesta, Prostamustin и Suloprost.
EMP продается в Соединенных Штатах, Канаде и Мексике под торговой маркой Emcyt, тогда как лекарство продается под торговой маркой назовите Estracyt в Соединенном Королевстве и в других местах по всей Европе, а также в Аргентине, Чили и Гонконге. Он был прекращен в ряде стран, включая Австралию, Бразилию, Ирландию и Норвегию.
. EMP был изучен при лечении других раковых заболеваний, таких как глиома и рак груди. Было обнаружено, что он незначительно улучшает качество жизни у людей с глиомой в течение первых 3 месяцев терапии.
| journal =()