 Шаровидная модель молекулы спирта (R 3 COH). Красные и белые шары представляют собой гидроксильную группу (-ОН). Три "R" обозначают углеродные заместители или атомы водорода.
Шаровидная модель молекулы спирта (R 3 COH). Красные и белые шары представляют собой гидроксильную группу (-ОН). Три "R" обозначают углеродные заместители или атомы водорода.  Угол связи между гидроксильной группой (-OH) и цепочкой атомов углерода (R)
Угол связи между гидроксильной группой (-OH) и цепочкой атомов углерода (R) В химии, спирт представляет собой органическое соединение, которое несет по крайней мере одну гидроксильную функциональную группу (-OH), связанную с насыщенным атом углерода. Термин алкоголь первоначально относился к первичному спирту этанол (этиловый спирт), который используется в качестве лекарственного средства и является основным алкоголем, присутствующим в алкогольных напитках. Важный класс спиртов, из которых метанол и этанол являются простейшими членами, включает все соединения, для которых общая формула C nH2n + 1 OH. Простые одноатомные спирты, которые являются предметом данной статьи, включают первичные (RCH 2 OH), вторичные (R 2 CHOH) и третичные (R 3 COH) спирты.
Суффикс -ol появляется в химическом названии ИЮПАК всех веществ, в которых гидроксильная группа является функциональной группой с наивысшим приоритетом. Когда в соединении присутствует группа с более высоким приоритетом, в его имени IUPAC используется префикс гидрокси-. Суффикс -ol в названиях, не принадлежащих ИЮПАК (например, парацетамол или холестерин ), также обычно указывает на то, что это вещество является алкоголем. Однако многие вещества, которые содержат гидроксильные функциональные группы (особенно сахара, такие как глюкоза и сахароза ), имеют названия, которые не включают ни суффикса -ol, ни префикса гидрокси-.
Дистилляция спирта, возможно, возникла в цивилизации долины Инда еще в 2000 году до нашей эры. Народ Индии употреблял алкогольный напиток под названием сура, приготовленный из ферментированного риса, ячменя, пальмового сахара и цветов дерева мадхьяка. Дистилляция алкоголя была известна исламским химикам еще в восьмом веке.
араб химик аль-Кинди недвусмысленно описал дистилляцию вина в трактате под названием как «Книга химии парфюмерии и дистилляций».
персидский врач и эрудит, Мухаммад ибн Закария ар-Рази открыл алкоголь как химическое соединение.
Слово «алкоголь» происходит от арабского kohl (арабский : الكحل, латинизированный : аль-куḥл), порошок, используемый в качестве подводки для глаз. Al- - арабский определенный артикль, эквивалентный английскому. Первоначально спирт использовался для очень тонкого порошка, полученного посредством сублимации природного минерала стибнита с образованием трисульфида сурьмы Sb. 2S. 3. Считалось, что это суть или «дух» этого минерала. Его использовали как антисептик, подводку для глаз и косметическое средство. Значение алкоголя было расширено до дистиллированных веществ в целом, а затем сузилось до этанола, когда «спиртные напитки» стали синонимом крепких напитков.
Бартоломью Трахерон в его переводе 1543 года Иоанна оф. Виго вводит это слово как термин, используемый «варварскими» авторами для обозначения «мелкого порошка». Виго писал: «варварские аукторы употребляют алкоголь или (как я его иногда понимаю) алкофолл, что означает moost fine poudre».
Lexicon Chymicum 1657 года Уильяма Джонсона интерпретирует это слово как «antimonium sive stibium». " В более широком смысле, это слово стало обозначать любую жидкость, полученную путем дистилляции, в том числе «винный спирт», дистиллированную эссенцию вина. Либавий в Алхимии (1594 г.) относится к «винному алкоголю vel vinum alcalisatum». Джонсон (1657) описывает алкогольное вино как «quando omnis superfluitas vini a vino separatur, ita ut Accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat». Значение этого слова стало ограничиваться «винным спиртом» (химическое вещество, известное сегодня как этанол ) в 18 веке, а после 1850 года оно было расширено до класса веществ, так называемых «спирты» в современной химии.
Термин этанол был изобретен в 1892 году, в нем слово этан соединилось с окончанием «-ol» слова «алкоголь».
Номенклатура ИЮПАК используется в научных публикациях и там, где важна точная идентификация вещества, особенно в тех случаях, когда относительная сложность молекулы не делает такое систематическое название громоздким. При наименовании простых спиртов в названии алкановой цепи теряется конец е и добавляется суффикс -ol, например, как в слове «этанол» от названия алкановой цепи «этан». При необходимости положение гидроксильной группы указывается числом между названием алкана и -ol: пропан-1-ол для CH. 3CH. 2CH. 2OH, пропан-2-ол для CH. 3CH (OH) CH. 3. Если присутствует группа с более высоким приоритетом (такая как альдегид, кетон или карбоновая кислота ), то используется префикс гидрокси-, например, как в 1-гидрокси-2-пропанон (CH. 3C (O) CH. 2OH).
| CH3–CH 2 –CH 2 –OH |  |  |  |  |
 |  |  | ||
| н-пропиловый спирт,. пропан-1-ол или. 1-пропанол | изопропиловый спирт,. пропан-2-ол, или. 2-пропанол | циклогексанол | изобутиловый спирт,. 2-метилпропан-1-ол, или. 2-метил-1-пропанол | трет-амиловый спирт,. 2-метилбутан-2-ол или. 2-метил-2-бутанол |
| Первичный спирт | Вторичный спирт | Вторичный спирт | Первичный спирт | Третичный спирт |
В случаях, когда функциональная группа ОН связана с sp-атомом углерода на ароматическом кольце, молекула имеет вид известен как фенол и назван в соответствии с правилами ИЮПАК для наименования фенолов.
Другими менее формальными В текстах спирт часто называют названием соответствующей алкильной группы, за которым следует слово «спирт», например, метил спирт, этил спирт. Пропил спирт может быть н-пропиловым спиртом или изопропиловым спиртом, в зависимости от того, связана ли гидроксильная группа с концевым или средним углеродом на прямой пропановая цепь. Как описано в разделе систематического наименования, если другая группа в молекуле имеет приоритет, спиртовой фрагмент часто указывается с помощью префикса «гидрокси-».
Затем спирты подразделяются на первичные, вторичные (вторые, второстепенные) и третичный (трет-, т-) в зависимости от количества атомов углерода, связанных с атомом углерода, который несет гидроксил функциональную группу. (Соответствующие числовые сокращения 1 °, 2 ° и 3 ° также иногда используются в неформальных условиях.) Первичные спирты имеют общие формулы RCH 2 OH. Простейшим первичным спиртом является метанол (CH 3 OH), для которого R = H, а следующим является этанол, для которого R = CH 3, метильная группа. Вторичные спирты имеют форму RR'CHOH, простейшим из которых является 2-пропанол (R = R '= CH 3). Для третичных спиртов общая форма - RR'R "COH. Простейшим примером является трет-бутанол (2-метилпропан-2-ол), для которого каждый из R, R 'и R" представляет собой Канал 3. В этих сокращениях R, R 'и R "представляют заместители, алкил или другие присоединенные, обычно органические группы.
В архаической номенклатуре спирты могут быть названы производными метанола с использованием" -carbinol "в качестве окончания. Например, (CH 3)3COH может называться триметилкарбинолом.
| Тип | Формула | IUPAC Имя | Обычное имя |
|---|---|---|---|
| Одноатомные. спирты | CH3OH | Метанол | Древесный спирт |
| C2H5OH | Этанол | Спирт | |
| C3H7OH | Пропан-2-ол | Изопропиловый спирт,. Медицинский спирт | |
| C4H9OH | Бутан-1-ол | Бутанол,. Бутиловый спирт | |
| C5H11OH | Пентан-1-ол | Пентанол,. Амиловый спирт | |
| C16H33OH | Гексадекан-1-ол | Цетиловый спирт | |
| Многоатомные. спирты | C2H4(OH) 2 | Этан-1,2-диол | Этиленгликоль |
| C3H6(OH) 2 | Пропан-1,2-диол | Пропиленгликоль | |
| C3H5(OH) 3 | Пропан-1,2,3-триол | Глицерин | |
| C4H6(OH) 4 | Бутан -1,2,3,4-тетраол | Эритрит,. Треитол | |
| C5H7(OH) 5 | Пентан-1,2,3,4,5-пентол | Ксилит | |
| C6H8(OH) 6 | гексан-1,2,3,4,5,6-гексол | маннитол,. сорбитол | |
| C7H9(OH) 7 | гептан-1,2,3,4,5,6,7- гептол | волемитол | |
| ненасыщенные. алифатические. спирты | C3H5OH | проп-2-ен-1-ол | аллиловый спирт |
| C10H17OH | 3,7-диметилокта-2,6-диен-1-ол | гераниол | |
| C3H3OH | проп-2-ин-1-ол | пропаргиловый спирт | |
| Алициклические. спирты | C6H6(OH) 6 | Циклогексан-1,2,3,4,5,6-гексол | Инозитол |
| C10H19OH | 5 -Метил-2- (пропан-2-ил) циклогексан-1-ол | Ментол |
 Общее зарегистрированное потребление алкоголя на душу населения (15+), в литрах чистого этанола
Общее зарегистрированное потребление алкоголя на душу населения (15+), в литрах чистого этанола Спирты имеют долгую историю бесчисленного множества применений. Для простых одноатомных спиртов, которым посвящена данная статья, наиболее важными промышленными спиртами являются следующие:
Метанол является наиболее распространенным промышленным спиртом, в 1980 году его было произведено около 12 миллионов тонн в год. спирты примерно одинаковы, распределены примерно поровну.
Что касается острой токсичности, простые спирты обладают низкой острой токсичностью. Допускаются дозы в несколько миллилитров. Для пентанолов, гексанолов, октанолов и более длинных спиртов LD50 находится в диапазоне 2–5 г / кг (крысы, перорально). Метанол и этанол менее токсичны. Все спирты являются слабыми раздражителями кожи.
На метаболизм метанола (и этиленгликоля) влияет присутствие этанола, который имеет более высокое сродство к алкогольдегидрогеназе печени. Таким образом, метанол будет выводиться с мочой в неизменном виде.
В общем, гидроксильная группа делает спирты полярными. Эти группы могут образовывать водородные связи друг с другом и с большинством других соединений. Благодаря наличию полярных ОН спирты более растворимы в воде, чем простые углеводороды. Метанол, этанол и пропанол смешиваются с водой. Бутанол с четырехуглеродной цепью умеренно растворим.
Из-за водородной связи спирты обычно имеют более высокие температуры кипения, чем сопоставимые углеводороды и простые эфиры. Температура кипения спирта этанола составляет 78,29 ° C, по сравнению с 69 ° C для углеводорода гексана и 34,6 ° C для диэтилового эфира.
Простые спирты широко распространены в природе. Этанол является наиболее известным, потому что он является продуктом ферментации, основного пути производства энергии. Остальные простые спирты образуются только в следовых количествах. Однако более сложные спирты широко распространены, что проявляется в сахарах, некоторых аминокислотах и жирных кислотах.
В процессе Циглера линейные спирты производятся из этилена и триэтилалюминия с последующим окисление и гидролиз. Показан идеализированный синтез 1-октанола :
В процессе образуется ряд спиртов, которые разделяются дистилляцией.
Многие высшие спирты производятся гидроформилированием алкенов с последующим гидрированием. При применении к концевому алкену, как это обычно бывает, обычно получают линейный спирт:
Такие процессы дают жирные спирты, которые полезны для моющих средств..
Некоторые низкомолекулярные спирты, имеющие промышленное значение, получают путем добавления воды к алкенам. Этанол, изопропанол, 2-бутанол и трет-бутанол производятся этим общим Метод. Используются два варианта реализации: прямой и непрямой методы. Прямой метод позволяет избежать образования стабильных промежуточных продуктов, обычно с использованием кислотных катализаторов. В непрямом методе алкен превращается в сложный эфир сульфата, который впоследствии гидролизуют. Прямая гидратация с использованием этилена (гидратация этилена ) или других алкенов от крекинга фракций дистиллированной сырой нефти.
Гидратация также используется в промышленности для производства диола этиленгликоля из этиленоксида.
Этанол получают ферментацией с использованием глюкозы. получают из сахара в результате гидролиза крахмала в присутствии дрожжей и при температуре менее 37 ° C с получением этанола. Например, такой процесс может происходить путем превращения сахарозы ферментом инвертазы в глюкозу и фруктозу, а затем превращение глюкоза ферментным комплексом зимаза в этанол (и диоксид углерода).
Некоторые виды доброкачественных бактерий в кишечнике используют ферментацию как форму анаэробного метаболизма. Эта метаболическая реакция дает этанол в качестве побочного продукта. Таким образом, человеческие тела содержат некоторое количество алкоголя, эндогенно продуцируемого этими бактериями. В редких случаях этого может быть достаточно, чтобы вызвать «синдром автопивоварни », при котором вырабатываются опьяняющие количества алкоголя.
Подобно этанолу, бутанол может производиться процессами брожения. Известно, что дрожжи Saccharomyces производят эти высшие спирты при температурах выше 75 ° F (24 ° C). Бактерия Clostridium acetobutylicum может питаться целлюлозой для производства бутанола в промышленных масштабах.
Первичные алкилгалогениды реагируют с водным NaOH или КОН в основном с первичными спиртами в нуклеофильном алифатическом замещении. (Вторичные и особенно третичные алкилгалогениды будут давать вместо этого продукт отщепления (алкен)). Реагенты Гриньяра реагируют с карбонильными группами с образованием вторичных и третичных спиртов. Родственными реакциями являются реакция Барбье и реакция Нодзаки-Хиямы.
Альдегиды или кетоны восстанавливаются с помощью борогидрид натрия или алюмогидрид лития (после кислотной обработки). Другое восстановление с помощью изопропилатов алюминия - это восстановление Меервейна-Понндорфа-Верли. Асимметричное гидрирование по Нойори - это асимметричное восстановление β-кетоэфиров.
Алкены участвуют в катализируемой кислотой реакции гидратации с использованием концентрированной серной кислоты в качестве катализатора, который обычно дает вторичные или третичные спирты. гидроборирование-окисление и оксимеркурация-восстановление алкенов более надежны в органическом синтезе. Алкены реагируют с NBS и водой в реакции образования галогидрина. Амины могут быть преобразованы в соли диазония, которые затем гидролизуются.
Показано образование вторичного спирта путем восстановления и гидратации:

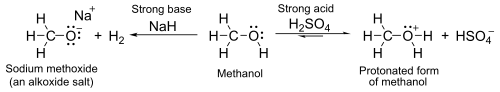
При pKa около 16–19, как правило, кислоты несколько слабее, чем вода. С сильными основаниями, такими как гидрид натрия или натрий, они образуют соли, называемые алкоксиды, с общей формулой R OM.
На кислотность спиртов сильно влияет сольватация. В газовой фазе спирты более кислые, чем в воде.
Группа ОН не является хорошей уходящей группой в нуклеофильном замещении реакции, поэтому нейтральные спирты в таких реакциях не вступают. Однако, если кислород сначала протонируется с образованием R-OH 2, уходящая группа (вода ) намного более стабильна, и может иметь место нуклеофильное замещение. Например, третичные спирты реагируют с соляной кислотой с образованием третичных алкилгалогенидов, где гидроксильная группа заменена на атом хлора на мономолекулярное нуклеофильное замещение. Если первичные или вторичные спирты должны взаимодействовать с соляной кислотой, необходим активатор, такой как хлорид цинка. Альтернативно, преобразование может быть выполнено непосредственно с использованием тионилхлорида.

. Спирты могут быть также преобразованы в алкилбромиды с использованием, например, бромистоводородной кислоты или трибромида фосфора. :
В деоксигенации Бартона-Маккомби спирт деоксигенируется до алкана с гидридом трибутилолова или комплексом триметилборан -вода в реакции радикального замещения.
Между тем, атом кислорода имеет неподеленные пары несвязанных электронов, которые делают его слабо основным в присутствии сильных кислот, таких как серная кислота. Например, с метанолом:
При обработке сильными кислотами спирты подвергаются реакции элиминирования E1 с образованием алкенов. Реакция, как правило, подчиняется Правилу Зайцева, согласно которому образуется наиболее стабильный (обычно наиболее замещенный) алкен. Третичные спирты легко удаляются при температуре чуть выше комнатной, но для первичных спиртов требуется более высокая температура.
Это диаграмма катализируемой кислотой дегидратации этанола с получением этилена :

. Для более контролируемой реакции элиминирования требуется образование.
Третичные спирты реагируют с сильными кислотами с образованием карбокатионов. Реакция связана с их обезвоживанием, например изобутилен из трет-бутилового спирта. Особый вид реакции дегидратации включает трифенилметанол и особенно его аминзамещенные производные. При обработке кислотой эти спирты теряют воду с образованием стабильных карбокатионов, которые являются коммерческими красителями.
 Получение кристаллического фиолетового протонолизом третичного спирта.
Получение кристаллического фиолетового протонолизом третичного спирта. Спирт и карбоновые кислоты реагируют в так называемой этерификации Фишера. Для реакции обычно требуется катализатор, такой как концентрированная серная кислота:
Другие типы сложных эфиров получают аналогичным способом - например, тозил (тозилат) сложные эфиры получают реакцией спирта с п- толуолсульфонил хлоридом в пиридин.
Первичные спирты (R-CH 2 OH) могут быть окислены либо до альдегидов (R-CHO), либо до карбоновые кислоты (R-CO 2 H). Окисление вторичных спиртов (RRCH-OH) обычно заканчивается на стадии кетона (RRC = O). Третичные спирты (RRRC-OH) устойчивы к окислению.
Прямое окисление первичных спиртов до карбоновых кислот обычно протекает через соответствующий альдегид, который превращается через гидрат альдегида (R-CH (OH) 2) реакцией с водой перед ее дальнейшим окислением до карбоновой кислоты.
 Механизм окисления первичных спиртов в карбоновые кислоты через альдегиды и альдегидгидраты
Механизм окисления первичных спиртов в карбоновые кислоты через альдегиды и альдегидгидраты Реагенты, используемые для превращения первичных спиртов в альдегиды, обычно также подходят для окисления вторичных спиртов до кетоны. К ним относятся реагент Коллинза и периодинан Десса-Мартина. Прямое окисление первичных спиртов до карбоновых кислот можно проводить с использованием перманганата калия или реагента Джонса.