| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Этан | |||
| Систематическое название IUPAC Дикарбан (никогда не рекомендуется) | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| Ссылка Beilstein | 1730716 | ||
| ChEBI | |||
| ChEMBL |
| ||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| Номер ЕС |
| ||
| Справочник Gmelin | 212 | ||
| MeSH | Этан | ||
| PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1035 | ||
| Панель управления CompTox (EPA ) | |||
InChI
| |||
УЛЫБКИ
| |||
| Свойства | |||
| Химическая формула | C2H6 | ||
| Молярная масса | 30,070 г · моль | ||
| Внешний вид | Бесцветный газ | ||
| Запах | Без запаха | ||
| Плотность |
544,0 кг / м (жидкость при -88,5 ° C). 206 кг / м (в критической точке 305,32 2 K) | ||
| точка плавления | -182,8 ° C; -296,9 ° F; 90,4 K | ||
| Температура кипения | -88,5 ° C; -127,4 ° F; 184,6 K | ||
| Растворимость в воде | 56,8 мг л | ||
| Давление пара | 3,8453 МПа (при 21,1 ° C) | ||
| Закон Генри. константа (kH) | 19 нмоль Па кг | ||
| Кислотность (pK a) | 50 | ||
| Основность (pK b) | -36 | ||
| Конъюгированная кислота | Этан | ||
| Магнитная восприимчивость (χ) | -37,37 · 10 см / моль | ||
| Термохимия | |||
| Теплоемкость (C) | 52,49 Дж · К · моль | ||
| Стандартная энтальпия. образования (ΔfH298) | -84 кДж · моль | ||
| Стандартная энтальпия. горения (ΔcH298) | −1561,0–−1560,4 кДж моль | ||
| Опасности | |||
| Паспорт безопасности | См.: страница данных. inchem.org | ||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Опасно | ||
| Предупреждения об опасности GHS | H220, H280 | ||
| Меры предосторожности GHS | P210, P410 + 403 | ||
| NFPA 704 (огненный алмаз) |  4 1 0 SA 4 1 0 SA | ||
| Температура вспышки | −135 ° C (−211 ° F; 138 K) | ||
| Температура самовоспламенения. | 472 ° C (882 ° F; 745 K) | ||
| Пределы взрываемости | 2,9–13% | ||
| Родственные соединения | |||
| Родственные алканы | |||
| Родственные соединения | |||
| Страница дополнительных данных | |||
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая постоянная (εr) и т. Д. | ||
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ | ||
| Спектральные данные | UV, IR, ЯМР, MS | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки ink | |||
Ethane (или ) представляет собой органическое химическое соединение с химической формулой C. 2H. 6. При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха . Как и многие углеводороды, этан выделяется в промышленных масштабах из природного газа и как нефтехимический побочный продукт нефти. уточнение. Его основное использование - сырье для производства этилена.
Родственные соединения могут быть образованы заменой атома водорода другой функциональной группой ; этановая группа называется этильной группой. Например, этильная группа, связанная с гидроксильной группой, дает этанол, спирт в напитках.
Этан был впервые синтезирован в 1834 году Майклом Фарадеем, применив электролиз раствора ацетата калия. Он принял углеводородный продукт этой реакции за метан и не стал его исследовать. В период 1847–1849 годов, пытаясь подтвердить радикальную теорию органической химии, Герман Кольбе и Эдвард Франкланд производили этан восстановлением пропионитрила (этилцианид ) и этилйодида металлическим калием, и, как это сделал Фарадей, электролизом водные ацетаты. Они ошибочно приняли продукт реакций за метильный радикал, а не за димер метила, этана. Эта ошибка была исправлена в 1864 году Карлом Шорлеммером, который показал, что продуктом всех этих реакций на самом деле был этан. Этан был обнаружен растворенным в пенсильванской легкой сырой нефти Эдмундом Рональдсом в 1864 году.
Название этан происходит от IUPAC номенклатура органической химии. «Eth-» происходит от немецкого слова «питьевой спирт» (этанол), а «-ane» означает наличие одинарной связи между атомами углерода.
При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха. Он имеет температуру кипения -88,5 ° C (-127,3 ° F) и точку плавления -182,8 ° C (-297,0 ° F). Твердый этан существует в нескольких модификациях. При охлаждении при нормальном давлении первой появляется модификация пластичный кристалл, кристаллизующийся в кубической системе. В этой форме положения атомов водорода не фиксированы; молекулы могут свободно вращаться вокруг длинной оси. Охлаждение этого этана ниже прибл. 89,9 К (-183,2 ° C; -297,8 ° F) превращает его в моноклинный метастабильный этан II (пространственная группа P 21 / n). Этан очень плохо растворяется в воде.
Параметры связи этана были измерены с высокой точностью с помощью микроволновой спектроскопии и электронной дифракции: r C – C = 1,528 (3) Å, r C – H = 1,088 (5) Å, CCH = 111,6 (5) ° с помощью микроволн и r C – C = 1,524 (3) Å, r C – H = 1,089 ( 5) Å, и ∠CCH = 111,9 (5) ° по дифракции электронов (числа в скобках представляют погрешности в последних цифрах).
Этан можно рассматривать как два соединенных метильных групп, то есть димера метильных групп. В лаборатории этан можно легко синтезировать с помощью электролиза по Кольбе. В этом методе водный раствор соли ацетата подвергается электролизу. На аноде ацетат окисляется с образованием диоксида углерода и метил радикалов, а высокореакционные метильные радикалы объединяются с образованием этана:
Синтез путем окисления уксусного ангидрида пероксидами, концептуально похож.
Химия этана включает в основном свободнорадикальные реакции. Этан может реагировать с галогенами, особенно с хлором и бромом, посредством свободнорадикального галогенирования. Эта реакция протекает через распространение радикала этил :
Поскольку галогенированные этаны могут подвергаться дальнейшему свободнорадикальному галогенированию, в результате этого процесса образуется смесь нескольких галогенированных продуктов. В химической промышленности для получения любого конкретного двухуглеродного галогеналкана используются более селективные химические реакции.
При полном сгорании этана выделяется 1559,7 кДж / моль, или 51,9 кДж / г тепла, и образуется диоксид углерода и вода в соответствии с химическим уравнением
Горение также может происходить без избыток кислорода, образуя смесь аморфного углерода и оксида углерода.
Горение происходит посредством сложной серии свободнорадикальных реакций. Компьютерное моделирование химической кинетики горения этана включало сотни реакций. Важной серией реакций при горении этана является комбинация этильного радикала с кислородом и последующее расщепление образующегося пероксида на этоксильный и гидроксильный радикалы.
Основной углерод- продуктами неполного сгорания этана являются одноуглеродные соединения, такие как оксид углерода и формальдегид. Одним из важных путей разрыва углерод-углеродной связи в этане с образованием этих одноуглеродных продуктов является разложение этокси радикала на метил радикал и формальдегид, которые, в свою очередь, могут подвергаться дальнейшему окислению.
Некоторые второстепенные продукты неполного сгорания этана включают ацетальдегид, метан, метанол и этанол. При более высоких температурах, особенно в диапазоне 600–900 ° C (1112–1 652 ° F), этилен является важным продуктом. Он возникает в результате таких реакций:
Подобные реакции (с другими агентами, кроме кислорода в качестве отводящего водорода) участвуют в производстве этилена из этана при паровом крекинге..
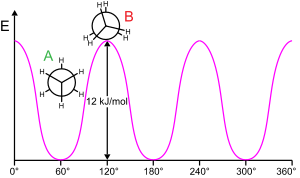 Этан (показан в проекции Ньюмана ) барьер для вращения вокруг углерод-углеродной связи. Кривая представляет собой потенциальную энергию как функцию угла поворота. Энергетический барьер составляет 12 кДж / моль или примерно 2,9 ккал / моль.
Этан (показан в проекции Ньюмана ) барьер для вращения вокруг углерод-углеродной связи. Кривая представляет собой потенциальную энергию как функцию угла поворота. Энергетический барьер составляет 12 кДж / моль или примерно 2,9 ккал / моль.Для вращения молекулярной субструктуры вокруг скручивающейся связи обычно требуется энергия. Минимальная энергия, необходимая для вращения связи на 360 °, называется барьером вращения..
Этан представляет собой классический, простой пример такого барьера вращения, иногда называемого «этановым барьером». Одно из первых экспериментальных свидетельств существования этого барьера (см. Диаграмму слева) было получено путем моделирования энтропии этана. Три атома водорода на каждом конце могут свободно вращаться вокруг центральной углерод-углеродной связи при наличии энергии, достаточной для преодоления барьера. Физическое происхождение барьера до сих пор полностью не выяснено, хотя перекрывающееся (обменное) отталкивание между атомами водорода на противоположных концах молекулы, возможно, является самым сильным кандидатом со стабилизирующим эффектом гиперконъюгации на ступенчатые конформация, способствующая явлению. Однако теоретические методы, использующие подходящую отправную точку (ортогональные орбитали), показывают, что сверхсопряжение является наиболее важным фактором в возникновении барьера вращения этана.
Еще в 1890–1891 годах химики предположили, что молекулы этана предпочитал шахматную конформацию с двумя концами молекулы, расположенными сбоку друг от друга.
После метана этан является вторым по величине компонентом природного газ. Содержание этана в природном газе из различных газовых месторождений варьируется от менее 1% до более 6% по объему. До 1960-х годов этан и более крупные молекулы обычно не отделялись от метанового компонента природного газа, а просто сжигались вместе с метаном в качестве топлива. Сегодня этан является важным нефтехимическим сырьем и отделяется от других компонентов природного газа на большинстве хорошо разработанных газовых месторождений. Этан также может быть отделен от нефтяного газа, смеси газообразных углеводородов, получаемых как побочный продукт переработки нефти. Однако экономика строительства и эксплуатации перерабатывающих предприятий может измениться. Если относительная ценность отправки необработанного природного газа потребителю превышает ценность извлечения этана, извлечение этана может не начаться, что может вызвать эксплуатационные проблемы, связанные с изменением качества газа в последующих системах.
Этан. наиболее эффективно отделяется от метана путем его сжижения при криогенных температурах. Существуют различные стратегии охлаждения: в наиболее экономичном процессе, широко используемом в настоящее время, используется турбодетандер , и он может извлекать более 90% этана в природном газе. В этом процессе охлажденный газ расширяется через турбину, снижая температуру примерно до -100 ° C (-148 ° F). При такой низкой температуре газообразный метан можно отделить от сжиженного этана и более тяжелых углеводородов с помощью дистилляции. Дальнейшая дистилляция затем отделяет этан от пропана и более тяжелых углеводородов.
Этан может быть образован в результате электролиза солей ацетата :
2 CH 3 COONa + 2 H 2 O → C 2H6+ 2 CO 2 + H 2 + 2 NaOH
Основное применение этан - это производство этена (этилена) путем парового крекинга. При разбавлении водяным паром и кратковременном нагревании до очень высоких температур (900 ° C или выше) тяжелые углеводороды распадаются на более легкие углеводороды, и насыщенные углеводороды становятся ненасыщенными. Этан предпочтителен для производства этена, потому что паровой крекинг этана довольно селективен для этена, в то время как паровой крекинг более тяжелых углеводородов дает смесь продуктов, более бедную этеном и более богатую более тяжелыми алкенами (олефинами), такими как пропен (пропилен) и бутадиен, а также в ароматических углеводородах.
Экспериментально этан исследуется как сырье для других товарных химикатов. Окислительное хлорирование этана долгое время казалось потенциально более экономичным способом получения винилхлорида, чем хлорирование этена. Многие способы проведения этой реакции были запатентованы, но низкая селективность для винилхлорида и коррозионных условий реакции (в частности, реакционная смесь, содержащая соляную кислоту при температурах выше 500 ° C) препятствовали коммерциализации большинства из них. В настоящее время INEOS эксплуатирует пилотную установку производства этана в винилхлорид мощностью 1000 т / год (тонн в год ) в Вильгельмсхафене в Германия.
Аналогичным образом Саудовская Аравия фирма SABIC объявила о строительстве завода мощностью 30 000 тонн в год для производства уксусной кислоты путем окисления этана на Янбу. Экономическая жизнеспособность этого процесса может зависеть от низкой стоимости этана вблизи нефтяных месторождений Саудовской Аравии, и он может не конкурировать с карбонилированием метанола где-либо еще в мире.
Этан можно использовать в качестве хладагента в криогенных холодильных системах. В гораздо меньших масштабах в научных исследованиях жидкий этан используется для стеклования богатых водой образцов для электронной микроскопии (криоэлектронной микроскопии ). Тонкая пленка воды, быстро погруженная в жидкий этан при температуре -150 ° C или ниже, замерзает слишком быстро, чтобы вода кристаллизовалась. Методы более медленного замораживания могут генерировать кубические кристаллы льда, которые могут разрушить мягкие структуры, повреждая образцы, и снизить качество изображения из-за рассеивания электронного луча до того, как он достигнет детектора.
При комнатной температуре этан является чрезвычайно легковоспламеняющимся газом. При смешивании с воздухом в количестве 3,0–12,5% по объему он образует взрывоопасную смесь.
Некоторые дополнительные меры предосторожности необходимы при хранении этана в виде криогенной жидкости. Прямой контакт с жидким этаном может привести к сильному обморожению. Пока они не нагреются до комнатной температуры, пары жидкого этана тяжелее воздуха и могут течь по полу или земле, собираясь в низких местах; Если пары сталкиваются с источником возгорания, химическая реакция может вернуться к источнику этана, из которого они испарились.
Этан может вытеснить кислород и стать причиной удушья. Этан не представляет острого или хронического токсикологического риска. Это не канцероген.
 Фотография северных широт Титана. Темные детали кажутся углеводородными озерами, но потребуются дополнительные изображения, чтобы увидеть, остались ли темные пятна такими же (как если бы они были озерами)
Фотография северных широт Титана. Темные детали кажутся углеводородными озерами, но потребуются дополнительные изображения, чтобы увидеть, остались ли темные пятна такими же (как если бы они были озерами) Этан присутствует в виде газовых примесей в атмосфере Земли, имеющий в настоящее время концентрацию на уровне моря 0,5 частей на миллиард, хотя его доиндустриальная концентрация, вероятно, составляла всего около 0,25 части на миллиард, поскольку значительная доля этана в сегодняшнем Атмосфера могла образоваться как ископаемое топливо. Глобальные количества этана менялись во времени, вероятно, из-за сжигания на месторождениях природного газа. Глобальные темпы выбросов этана снизились с 1984 по 2010 год, хотя увеличение добычи сланцевого газа на формации Баккен в США остановило снижение вдвое.
Хотя этан и есть парниковый газ, он гораздо менее распространен, чем метан, имеет срок службы всего несколько месяцев по сравнению с более чем десятилетием, а также менее эффективно поглощает излучение по сравнению с массой. Фактически, потенциал глобального потепления этана в значительной степени является результатом его преобразования в атмосфере в метан. Он был обнаружен как следовой компонент в атмосферах всех четырех планет-гигантов, а также в атмосфере спутника Сатурна Титана.
Атмосферный этан является результатом фотохимическое действие Солнца на газообразный метан, также присутствующий в этих атмосферах: ультрафиолетовые фотоны с более короткими длинами волн, чем 160 нм, могут фотодиссоциировать молекула метана на метил радикал и атом водорода. Когда два метильных радикала рекомбинируют, в результате получается этан:
В атмосфере Земли, гидроксильные радикалы превращают этан в пар метанола с периодом полураспада около трех месяцев.
Когда-то была широко распространена гипотеза, что этан, произведенный таким образом на Титане, снова выплеснулся на поверхность Луны, и со временем скопились в углеводородных морях или океанах, покрывающих большую часть поверхности Луны. Инфракрасные телескопические наблюдения ставят под сомнение эту гипотезу, и зонд Гюйгенс, который приземлился на Титане в 2005 году, не обнаружил никаких жидкостей на поверхности, хотя он сфотографировал детали, которые в настоящее время могут быть сухими дренажными каналами. В декабре 2007 года зонд Кассини обнаружил по крайней мере одно озеро на южном полюсе Титана, которое теперь называется Онтарио Лакус из-за того, что площадь озера аналогична озеру Онтарио на Земле (примерно 20 000 км). Дальнейший анализ данных инфракрасной спектроскопии, представленный в июле 2008 г., предоставил более убедительные доказательства присутствия жидкого этана в озере Онтарио.
В 1996 году этан был обнаружен в комете Хиякутаке, а с тех пор он был обнаружен в некоторых других кометах. Наличие этана в этих далеких телах Солнечной системы может указывать на этан как на первичный компонент солнечной туманности, из которой, как полагают, образовались Солнце и планеты.
В 2006 году Дейл Круикшэнк из НАСА / Исследовательского центра Эймса (соисследователь New Horizons ) и его коллеги объявили о спектроскопическом открытии этана на Плутоне.
| Викискладе есть медиафайлы, связанные с этаном. |