 Димеры карбоновых кислот часто встречаются в паровой фазе.
Димеры карбоновых кислот часто встречаются в паровой фазе. A димер () (ди-, «два» + -мер, «части») представляет собой олигомер, состоящий из двух мономеров, соединенных связями, которые могут быть сильными или слабыми., ковалентный или межмолекулярный. Термин гомодимер используется, когда две молекулы идентичны (например, A – A), и гетеродимер, когда они не идентичны (например, A – B). Обратный процесс димеризации часто называют диссоциацией. Когда два противоположно заряженных иона объединяются в димеры, они называются парами Бьеррума.
Карбоновые кислоты образуют димеры за счет водородной связи кислого водорода и карбонильного кислорода в безводном. Например, уксусная кислота образует димер в газовой фазе, где мономерные звенья удерживаются вместе водородными связями. В особых условиях большинство ОН-содержащих молекул образуют димеры, например димер воды.
боран («BH 3 ») встречается как димер диборан (B2H6) из-за высокой кислотности Льюиса бор центр.
Эксимеры и эксиплексы представляют собой возбужденные структуры с коротким временем жизни. Например, благородные газы не образуют стабильных димеров, но они (димеры) действительно образуют эксимеры Ar2*, Kr 2 * и Xe 2 * под высоким давлением и электростимуляцией.
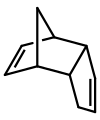 Димер циклопентадиена, хотя это может быть не сразу очевидно при первоначальном осмотре
Димер циклопентадиена, хотя это может быть не сразу очевидно при первоначальном осмотре  1,2-диоксетан, один из двух формальдегид димеры. Как видно из связей этой молекулы, ковалентные димеры обычно структурно не похожи на их мономеры.
1,2-диоксетан, один из двух формальдегид димеры. Как видно из связей этой молекулы, ковалентные димеры обычно структурно не похожи на их мономеры.Молекулярные димеры часто образуются в результате реакции двух идентичных соединений, например: 2A → A-A. В этом примере сказано, что мономер «A» димеризуется с образованием димера «A-A». Примером является диаминокарбен, который димеризуется с образованием тетрааминоэтилена :
Карбены являются обладают высокой реакционной способностью и легко образуют связи.
Дициклопентадиен представляет собой асимметричный димер двух молекул циклопентадиена, которые вступили в реакцию реакции Дильса-Альдера с образованием продукта., он "трескается" (подвергается ретро-реакции Дильса-Альдера) с образованием идентичных мономеров:
Многие неметаллические элементы встречаются в виде димеров: водород, азот, кислород, галогены, т.е. фтор, хлор, бром и йод. Благородные газы могут образовывать димеры, связанные связями Ван-дер-Ваальса, например дигелий или диаргон. Ртуть встречается в виде ртути ( I) катион (Hg 2), формально димерный ион. Другие металлы могут образовывать часть димеров в своем паре. Известные металлические димеры включают Li2, Na2, Rb2 и.
Многие небольшие органические молекулы, самый известный ly формальдегид, легко образуют димеры. Димер формальдегида (CH 2 O) представляет собой диоксетан (C2H4O2).
В контексте полимеров «димер» также относится к степени полимеризации 2, независимо от стехиометрии или реакции конденсации.
Это применимо к дисахаридам. Например, целлобиоза представляет собой димер глюкозы, хотя в результате реакции образования образуется вода :
Здесь димер имеет стехиометрия отличается от пары мономеров.
Аминокислоты также могут образовывать димеры, которые называются дипептидами. Примером является глицилглицин, состоящий из двух молекул глицина, соединенных пептидной связью. Другими примерами являются аспартам и карнозин.
Димеры пиримидина образуются в результате фотохимической реакции из пиримидина оснований ДНК. Это перекрестное связывание вызывает мутации ДНК, которые могут быть канцерогенными, вызывая рак кожи.
| На Викискладе есть материалы, относящиеся к Димеры. |