Фтор - это химический элемент с символом Fи атомный номер 9. Это самый легкий галоген и существует в виде высокотоксичного бледно-желтого двухатомного газа при стандартных условиях. Как наиболее электроотрицательный элемент, он чрезвычайно реактивен, так как реагирует со всеми другими элементами, кроме аргона, неона и гелия <1287.>Среди элементов фтор занимает 24-е место по общему содержанию и 13-е место по содержанию на суше. Флюорит, основной минеральный источник фтора, давший этому элементу название, был впервые описан в 1529 году; поскольку он был добавлен к металлическим рудам для понижения их температур плавления для плавки, латинский глагол fluo, означающий «поток», дал минералу свое название. Предложенный в качестве элемента в 1810 году фтор оказалось трудно и опасно отделить от его соединений, и несколько первых экспериментаторов погибли или получили травмы в результате своих попыток. Только в 1886 году французский химик Анри Муассан выделил элементарный фтор с помощью низкотемпературного электролиза, процесса, который до сих пор используется в современном производстве. Промышленное производство газообразного фтора для обогащения урана, его крупнейшего применения, началось во время Манхэттенского проекта в Второй мировой войне.
. Из-за затрат на очистку чистого фтора большая часть в коммерческих целях используются соединения фтора, при этом примерно половина добываемого флюорита используется в сталеплавильном производстве . Остальной флюорит превращается в коррозионный фтористый водород на пути к различным органическим фторидам или в криолит, который играет ключевую роль в рафинировании алюминия. Молекулы, содержащие связь углерод-фтор, часто обладают очень высокой химической и термической стабильностью; в основном они используются как хладагенты, электрическая изоляция и посуда, последнее - как PTFE (тефлон). Фармацевтические препараты, такие как аторвастатин и флуоксетин, содержат связи C-F. Ион фторида из растворенных фторидных солей подавляет зубные кариесы и поэтому находит применение в зубной пасте и фторировании воды. Мировой объем продаж фторохимической продукции составляет более 15 миллиардов долларов США в год.
Фторуглеродные газы, как правило, парниковые газы с потенциалом глобального потепления от 100 до 23500 раз выше, чем у двуокиси углерода, SF6, имеющей самый высокий потенциал глобального потепления из любое известное вещество. Фторорганические соединения часто остаются в окружающей среде из-за прочности связи углерод-фтор. Фтор не имеет известной метаболической роли у млекопитающих; несколько растений и морских губок синтезируют фторорганические яды (чаще всего монофторацетаты ), которые помогают сдерживать хищников.
Атомы фтора имеют девять электронов, на один меньше, чем неон и электронная конфигурация 1s2s2p: два электрона в заполненной внутренней оболочке и семь во внешней оболочке, требующей заполнения еще одного. Внешние электроны неэффективны при ядерной экранировке и испытывают высокий эффективный ядерный заряд, равный 9-2 = 7; это влияет на физические свойства атома.
Фтор энергия первой ионизации занимает третье место среди всех элементов после гелия и неона, что затрудняет удаление электронов из нейтральных атомов фтора. Он также имеет высокое сродство к электрону , уступающее только хлору, и имеет тенденцию захватывать электрон, чтобы стать изоэлектронным с благородным газом неоном; он имеет самую высокую электроотрицательность из всех элементов. Атомы фтора имеют небольшой ковалентный радиус около 60 пикометров, аналогичный тем, которые имеют его период по соседству с кислородом и неоном.
| Внешнее видео | |
|---|---|
 3D-молекула фтора
3D-молекула фтора Энергия связи у дифтора намного ниже чем у Cl. 2или Br. 2и аналогичен легко расщепляемой пероксидной связи ; это, наряду с высокой электроотрицательностью, объясняет легкую диссоциацию фтора, высокую реакционную способность и прочные связи с атомами, не содержащими фтора. И наоборот, связи с другими атомами очень сильны из-за высокой электроотрицательности фтора. Инертные вещества, такие как стальной порошок, осколки стекла и волокна асбеста , быстро вступают в реакцию с холодным газообразным фтором; древесина и вода самопроизвольно воспламеняются под струей фтора.
Реакции элементарного фтора с металлами требуют различных условий. Щелочные металлы вызывают взрывы, а щелочноземельные металлы проявляют большую активность в массе; Чтобы предотвратить пассивирование от образования слоев фторида металлов, большинство других металлов, таких как алюминий и железо, должны быть измельчены, а благородные металлы требуют чистого газообразного фтора при 300–450 ° C (575 –850 ° F). Некоторые твердые неметаллы (сера, фосфор) активно реагируют с жидким фтором. Сероводород и диоксид серы легко соединяются с фтором, причем последний иногда имеет взрывоопасный характер; серная кислота проявляет гораздо меньшую активность, требуя повышенных температур.
Водород, как и некоторые щелочные металлы, взрывоопасно реагирует с фтором. Углерод, как лампа черный, реагирует при комнатной температуре с образованием фторметана. Графит соединяется с фтором при температуре выше 400 ° C (750 ° F) с образованием нестехиометрического монофторида углерода ; при более высоких температурах образуются газообразные фторуглероды, иногда со взрывами. Диоксид углерода и монооксид углерода реагируют при комнатной температуре или чуть выше нее, тогда как парафины и другие органические химические вещества вызывают сильные реакции: даже полностью замещенные галогеналканы, такие как четыреххлористый углерод, обычно негорючий, может взорваться. Хотя трифторид азота является стабильным, азоту требуется электрический разряд при повышенных температурах, чтобы произошла реакция с фтором из-за очень прочной тройной связи в элементарном азоте; аммиак может взорваться. Кислород не соединяется с фтором в условиях окружающей среды, но его можно заставить реагировать с помощью электрического разряда при низких температурах и давлениях; продукты имеют тенденцию распадаться на составляющие при нагревании. Более тяжелые галогены легко реагируют с фтором, как и благородный газ радон ; из других благородных газов только ксенон и криптон вступают в реакцию, и только в особых условиях.
 Кристаллическая структура β-фтора. Сферы обозначают молекулы F. 2, которые могут принимать любой угол. Другие молекулы ограничены плоскостями.
Кристаллическая структура β-фтора. Сферы обозначают молекулы F. 2, которые могут принимать любой угол. Другие молекулы ограничены плоскостями.  Анимация, показывающая кристаллическую структуру бета-фтора. Молекулы на гранях элементарной ячейки имеют вращение, ограниченное плоскостью.
Анимация, показывающая кристаллическую структуру бета-фтора. Молекулы на гранях элементарной ячейки имеют вращение, ограниченное плоскостью. При комнатной температуре фтор представляет собой газ из двухатомных молекул, бледно-желтый в чистом виде (иногда его называют желто-зеленым). Он имеет характерный галогеноподобный резкий и едкий запах, обнаруживаемый при 20 ppb. Фтор конденсируется в ярко-желтую жидкость при температуре -188 ° C (-306 ° F), температуре перехода, аналогичной температуре кислорода и азота.
Фтор имеет две твердые формы, α- и β-фтор. Последний кристаллизуется при −220 ° C (−364 ° F) и является прозрачным и мягким, с той же неупорядоченной кубической структурой свежеокристаллизованного твердого кислорода, в отличие от орторомбических систем других твердые галогены. Дальнейшее охлаждение до -228 ° C (-378 ° F) вызывает фазовый переход в непрозрачный и жесткий α-фтор, который имеет моноклинную структуру с плотными наклонными слоями молекул. Переход от β- к α-фтору является более экзотермическим, чем конденсация фтора, и может быть резким.
Только один изотоп фтора встречается в природе в большом количестве, стабильный изотоп. F. Он имеет высокое магнитологическое отношение и исключительную чувствительность к магнитным полям; поскольку это также единственный стабильный изотоп, он используется в магнитно-резонансной томографии. Синтезировано семнадцать радиоизотопов с массовыми числами от 14 до 31, из которых . F является наиболее стабильным с периодом полураспада 109,77 минут. Другие радиоизотопы имеют период полураспада менее 70 секунд; большая часть распадается менее чем за полсекунды. Изотопы. F и. F подвергаются β-распаду и захвату электронов, более легкие изотопы распадаются за счет испускания протонов, а те, которые тяжелее. F испытывают β-распад (самые тяжелые с испусканием запаздывающих нейтронов ). Известны два метастабильных изомера фтора,. F с периодом полураспада 162 (7) наносекунды и. F с периодом полураспада 2,2 (1) миллисекунды.
| Атомное. число | Элемент | Относительное. количество |
|---|---|---|
| 6 | Углерод | 4,800 |
| 7 | Азот | 1,500 |
| 8 | Кислород | 8,800 |
| 9 | Фтор | 1 |
| 10 | Неон | 1,400 |
| 11 | Натрий | 24 |
| 12 | Магний | 430 |
Среди более легких элементов содержание фтора 400 ppb (частей на миллиард) - 24-е место среди элементов во Вселенной - является исключительно низким: другие элементы, от углерода до магния, встречаются в двадцать или более раз чаще. Это связано с тем, что процессы звездного нуклеосинтеза обходят фтор, и любые атомы фтора, созданные иным образом, имеют высокое ядерное поперечное сечение, что позволяет дальнейшему слиянию с водородом или гелием генерировать кислород или неон соответственно.
Помимо этого временного существования, присутствию фтора было предложено три объяснения:
Фтор является тринадцатым по распространенным элементом в Земная кора в 600–700 частей на миллион (частей на миллион) по массе. Элементарный фтор не встречается в природе. Вместо этого весь фтор существует в виде фторидсодержащих минералов. Флюорит, фторапатит и криолит являются наиболее промышленно значимыми. Флюорит, также известный как плавиковый шпат (CaF. 2), широко распространенный во всем мире, является основным источником фторида и, следовательно, фтора. Китай и Мексика - основные поставщики. Фторапатит (Ca 5 (PO 4)3F), который содержит большую часть фторида в мире, является непреднамеренным источником фторида как побочного продукта производства удобрений. Криолит (Na <1304)>AlF. 6), используемый в производстве алюминия, является наиболее богатым фтором минералом. Экономически жизнеспособные природные источники криолита исчерпаны, и большая часть в настоящее время синтезируется в промышленных масштабах.
| Основные фторсодержащие минералы | ||
 |  |  |
| Флюорит | Фторапатит | Криолит |
Другие минералы, такие как топаз, содержат фтор. Фториды, в отличие от других галогенидов, нерастворимы и не встречаются в коммерчески выгодных концентрациях в физиологическом растворе При извержениях вулканов и геотермальных источниках были обнаружены следовые количества фторорганических соединений неопределенного происхождения. Существование газообразного фтора в кристаллах, о чем свидетельствует запах измельченного антозонита, вызывает споры; исследование 2012 года показало наличие 0,04% F. 2по массе в антозоните, приписывая эти включения в излучение из-за наличия крошечных количеств урана.
 Сталеплавильное производство. Иллюстрация из De re Metallica
Сталеплавильное производство. Иллюстрация из De re Metallica В 1529 году Георгиус Агрикола описал флюорит как добавку, используемую для понижения температуры плавления металлов во время плавки . Он написал латинское слово fluorés (флюор, поток) для обозначения флюоритовых пород. Позже название превратилось в плавиковый шпат (до сих пор широко используемый), а затем в флюорит. Позднее было определено, что состав флюорита представляет собой дифторид кальция.
Плавиковая кислота использовалась в травлении стекла с 1720 года. Андреас Сигизмунд Маргграф впервые охарактеризовал его в 1764 г., когда он нагрел флюорит с серной кислотой, и полученный раствор разъедал его стеклянный сосуд. Шведский химик Карл Вильгельм Шееле повторил эксперимент в 1771 году и назвал кислотный продукт fluss-spats-syran (плавиковая кислота). В 1810 году французский физик Андре-Мари Ампер предположил, что водород и элемент, аналогичный хлору, составляют плавиковую кислоту. Сэр Хамфри Дэви предложил назвать это неизвестное тогда вещество фтором из фтористоводородной кислоты. кислота и суффикс -ine других галогенов. Это слово с модификациямииспользуется в большинстве европейских языков; Греческий, русский и некоторые другие (по предложению Ампера) используют имя ftor или производные от греческого φθόριος (phthorios, деструктивный). Новое латинское название fluorum дало элементу его текущий символ F ; Fl использовался в ранних работах.
Первоначальные исследования фтора были настолько опасными, что несколько экспериментаторов 19-го века были сочтены «мучениками фтора» после несчастий с плавиковой кислотой. Выделению элементарного фтора препятствия чрезвычайная коррозионная активность как самого элементарного фтора, так и фтороводорода, а также отсутствие простого и подходящего электролита. Эдмон Фреми предположил, что электролиз чистый фтористого водорода с образованием фтора был возможен, и был разработан метод получения безводных образцов из подкисленного бифторида калия ; вместо этого он обнаружил, что полученный (сухой) фтороводород не проводит электричество. Бывший ученик Фреми Анри Муассан проявил настойчивость и после долгих проб и ошибок обнаружил, что смесь бифторида калия и сухого фтористого водорода является проводником, обеспечивающим электролиз. Чтобы предотвратить быструю коррозию платины в своих электрохимических ячейках, он охладил реакцию до низких температур в стандартном ванне и выковал ячейки из более стойкой смеси платины и иридия, и использовали флюоритовые пробки. В 1886 году, после 74 лет усилий многих химиков, Муассан выделил элементарный фтор.
В 1906 году, за два месяца до своей смерти, Муассан получил Нобелевскую премию по химии со следующей цитатой. :
[Я] в знак признания заслуг, данных им в его исследовании и выделении элемента фтора... Весь мир восхищался великим экспериментальным мастерством, с которым вы изучили этого дикого зверя среди элементов.

1887 г. рисунок аппарата Муассана

Нобелевская фотография Муассана
 ампула гексафторида урана или гексагон
ампула гексафторида урана или гексагон . Frigidaire подразделение General Motors (GM) экспериментировала с хлорфторуглеродными хладагентами в конце 1920-х годов, и Kinetic Chemicals была образована как совместное предприятие GM и DuPont в 1930 году в надежде продавать фреон. -12 (CCl. 2F. 2 ) в качестве одного такого хладагента. Он заменил более ранние и более токсичные соединения, повысил спрос на кухонные холодильники и стал прибыльным; к 1949 году DuPont выкупила Kinetic и начала продавать несколько других соединений фреона. Политетрафторэтилен (тефлон) был случайно открыт в 1938 году Роем Дж. Планкеттом во время работы с хладагентами в Kinetic, его превосходная химическая и термическая стойкость позволила ускорить его коммерциализацию и массовое производство к 1941 году.
Крупномасштабное производство элементарного фтора началось во время Второй мировой войны. Германия использовала высокотемпературный электролиз для производства запланированного зажигательного трифторида хлора, в рамках Манхэттенского проекта в огромных количествах производили гексафторид урана для обогащения урана. Требуются специальные материалы UF. 6столь же агрессивен, как и фтор, газодиффузионным установкам : никель для мембран, фторполимеры для уплотнения и жидких фторуглеродов в качестве охлаждающих и смазочных материалов. Эта быстроразвивающаяся ядерная промышленность стимулировала послевоенное развитие фторохимии.
Фтор имеет богатый химический состав, охватывающий органические и неорганические области. Он сочетается с металлами, неметаллами, металлоидами и большинством благородных газов и почти всегда предполагает степень окисления , равную -1. Высокое сродство фтора к электрону приводит к предпочтению ионной связи ; когда он образует ковалентные связи, они полярны, и почти всегда одиночные.
Щелочные металлы образуют ионные и хорошо растворимые монофториды ; они имеют кубическое расположение хлорида натрия и аналогичных хлоридов. Щелочноземельные дифториды обладают прочными ионными связями, но нерастворимые в воде, за исключением дифторида бериллия, также обладает некоторыми ковалентными свойствами и имеет кварц -подобный структуру. Редкоземельные элементы и многие другие образуют в основном ионные трифториды.
Ковалентные связи сначала проявляются в тетрафторидах : цирконии, гафний и несколько актинидов являются ионными с высокими температурами плавления, тогда как таковые из титана, ванадия и ниобия являются полимерными, плавятся или разлагаются при температуре не выше 350 ° C (660 ° F). Пентафториды продолжают эту тенденцию со своими линейными полимерами и олигомерными комплексами. Известно тринадцать металлов гексафторидов, все октаэдрические, и в основном это летучие твердые вещества, но для жидких MoF. 6 и ReF. 6 и газообразных WF. 6.гептафторид рения, единственный охарактеризованный металл гептафторид представляет собой легкоплавкое молекулярное твердое вещество с пентагональной бипирамидальной молекулярной геометрией. Фториды металлов с большим количеством фтора особенно реактивны.
| Структурная последовательность фторидов металлов | ||
 |  |  |
| Фторид натрия, ионный | пентафторидмута, полимерный | гептафторид рения, молекулярный |
 Точки кипения галогенидов водорода и халькогенидов, демонстрирующие необычно высокие значения для фтороводорода и воды
Точки кипения галогенидов водорода и халькогенидов, демонстрирующие необычно высокие значения для фтороводорода и воды Водород и фтор объединяются с образованием фтороводорода, в котором молекулы образуют кластеры за счет водородных связей, более чем напоминающие воду хлороводород. Он кипит при более высокой температуре, чем более тяжелые галогениды водорода, и в отличие от них смешивается с водой. Фтористый водород легко гидратируется при контакте с водой с образованием водного фтороводорода, также известного как плавиковая кислота. В отличие от других галогеноводородных кислот, которые являются сильными, фтористоводородная кислота слабой кислотой при низких концентрациях. Однако он может разрушать стекло, чего не могут сделать другие кислоты.
 Трифторид хлора, коррозионный потенциал которого воспламеняет асбест, бетон, песок и другие антипирены
Трифторид хлора, коррозионный потенциал которого воспламеняет асбест, бетон, песок и другие антипирены Бинарные фториды металлоидов и неметаллов с p- блоком обычно ковалентны и летучие, с различной реакционной способностью. Период 3 и более тяжелые неметаллы могут образовывать гипервалентные фториды.
Трифторид бора планарен и имеет неполный октет. Он действует как кислота Льюиса и соединяется с основаниями Льюиса, такими как аммиак, с образованием аддуктов. Тетрафторид углерода является тетраэдрическим и инертным; его группа аналоги, тетрафторид кремния и германия, также являются тетраэдрическими, но ведут себя как кислоты Льюиса. пниктогены образуют трифториды, реакционную способность и основную способность которых повышается молекулярная масса, хотя трифторид азота сопротивляется гидролизу и не является основным. Пентафториды фосфора, мышьяка и сурьмы более реакционноспособны, чем их соответствующие трифториды, причем пентафторид сурьмы самая сильная из нейтральных кислот Льюиса.
Халькогены содержат различные фториды: нестабильные дифториды для кислорода (единственное известное соединение с кислородом в степени окисления +2), сера и селен; тетрафториды и гексафториды существуют для серы, селена и теллура. Последние стабилизируются большими элементами фтора и более легкими центральными атомами, поэтому гексафторид серы особенно инертен. Каждый хлор, бром и йод могут образовывать моно-, три- и пентафториды, но только гептафторид иода был охарактеризован среди виновных межгалогенных гептафторидов. Многие из них являются мощными источниками фтора, и промышленное применение трифторида хлора требует мер предосторожности, которые используются при использовании фтора.
 Эти кристаллы тетрафторида ксенона были сфотографированы в 1962 году. Синтез соединения, как и в случае с фтором. гексафтороплатинат ксенона, удививший многих химиков.
Эти кристаллы тетрафторида ксенона были сфотографированы в 1962 году. Синтез соединения, как и в случае с фтором. гексафтороплатинат ксенона, удививший многих химиков. Благородные газы, имеющие полные электронные оболочки, не вступали в реакцию с другими элементами до 1962 года, когда Нил Бартлетт сообщил о синтезе гексафтороплатината ксенона ; <С тех пор были выделены 289>дифторид ксенона, тетрафторид, гексафторид и множественные оксифториды. Среди других благородных газов криптон образует дифторид, а радон и фтор образуют твердое вещество, предположительно дифторид радона. Бинарные фториды легких благородных газов исключительно нестабильны: аргон и фтористый водород объединяются в экстремальных условиях с образованием фторгидрида аргона. Гелий и неон не содержат долгоживущих фторидов, и фторид неон никогда не наблюдался; Фторгидрид гелия был обнаружен в течение миллисекунд при высоких давлениях и низких температурах.
 Несмешивающиеся слои окрашенной воды (вверху) и более плотного перфторгептана (внизу) в стакан; золотая рыбка и краб не могут проникнуть за границу; четверти находятся внизу.
Несмешивающиеся слои окрашенной воды (вверху) и более плотного перфторгептана (внизу) в стакан; золотая рыбка и краб не могут проникнуть за границу; четверти находятся внизу. 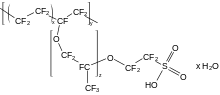 Химическая структура нафиона, фторполимера, используемого в топливных элементах и многих других областей применения
Химическая структура нафиона, фторполимера, используемого в топливных элементах и многих других областей применения связь углерод-фтор является самым сильным по органической химии и придает стабильность фторорганическимм. В природе его практически не существует, но он используется в искусственных соединениях. Исследования в этой области обычно используются с помощью коммерческих приложений; используются соединения разнообразны и отражают сложность, присущую органической химии.
Замена количества водорода в алкане постепенно увеличивающимся численным числом фтора постепенно меняет несколько Свойства: точки плавления и кипения снижаются, плотность увеличивается, растворимость в углеводородах снижается, повышается общая стабильность. Перфторуглероды, в которых все атомы водорода заменены, не используют растворителей, реагируя в условиях окружающей среды только с натрием в жидком аммиаке.
Термин перфторированное соединение используется для сообщения об этом, если бы не присутствие функциональной группы, часто карбоновой кислоты. Эти соединения имеют много общих свойств с перфторуглеродами, такими как стабильность и гидрофобность, в то время как функциональная группа увеличивает их реакционную способность, позволяя им прилипать к поверхностям или действовать как поверхностно-активные вещества ; фторированные поверхностно-активные вещества, в частности, могут снижать поверхностное натяжение воды больше, чем их аналоги на углеводородной основе. Фтортеломеры, которые имеют нефторированные атомы углерода рядом с функциональной группой, также считаются перфторированными.
Полимеры демонстрируют такое же повышение стабильности, что и замещение фтора (для водород) в дискретных молекулах; их температуры плавления обычно также увеличиваются. Политетрафторэтилен (PTFE), простейший фторполимер и перфторовый аналог полиэти со структурной единицей –CF. 2-, демонстрирует это изменение, как и ожидалось, но его очень высокая температура плавления затрудняет формование. Различные производные ПТФЭ менее устойчивы к условиям, но их легче формовать: фторированный этиленпропилен заменяет некоторые атомы фтора на трифтормет группы, перфторалкоксиалканы делают то же самое с трифторметокси группы, и нафион содержит боковые цепи перфторэфира, блокированные группы сульфоновой кислоты. Другие фторполимеры сохраняют некоторые атомы водорода; поливинилиденфторид содержит половину атомов фтора по сравнению с ПТФЭ, а поливинилфторид имеет четверть, но оба ведут себя как перфторированные полимеры.
Элементарный фтор и практически все соединения фтора получают из фтороводорода или его водных растворов, плавиковой кислоты. Фтористый водород получает в печах в результате эндотермической реакции флюорита (CaF 2) с серной кислотой:
Затем газообразный HF может быть абсорбирован водой или сжижен.
Около 20% произведенного HF является побочным продуктом производства удобрений, который производит гексафторкремниевую кислоту (H2SiF 6), которая может разлагаться с выделением HF термически и путем гидролиза:
 Промышленные фторэлементы в Престон
Промышленные фторэлементы в Престон Используется метод Муассана для производства промышленных количеств фтора путем электролиза смеси фторида калия / фтористого водорода : ионы водорода и фтора восстанавливаются и окисляются на стальном контейнере катод и угольный блок анод, напряжение 8–12 вольт, для производства водорода и газообразного фтора соответственно. Повышенные температуры, KF • 2HF плавится при 70 ° C (158 ° F) и подвергается электролизу при 70–130 ° C (158–266 ° F). KF, который действует как катализатор, необходим, поскольку чистый HF не может быть подвергнут электролизу. Фтор можно хранить в стальных баллонах с пассивированными внутренними поверхностями при температурах ниже 200 ° C (392 ° F); в противном случае можно использовать никель. Регулирующие клапаны и трубопроводы изготовлены из никеля, возможно, с использованием никеля Monel. Необходимо проводить частую пассивацию, строго исключая попадание воды и смазки. В лаборатории стеклянная посуда может содержать газообразный фтор при низком давлении и в безводных условиях; некоторые источники вместо этого рекомендуют системы никель-монель-ПТФЭ.
Во время подготовки к конференции 1986 года, посвященной столетию достижений Муассана, Карл О. Кристе рассуждал. что химическое образование фтора должно быть возможным, поскольку некоторые анионы фторидов металлов не имеют стабильных нейтральных аналогов; их подкисление потенциально может вызвать окисление. Он разработал метод выделения фтора с высоким выходом и атмосферным давлением:
Позднее Кристе прокомментировал, что реагенты «были известны более 100 лет, и даже Муассан мог придумать эту схему». Еще в 2008 году в некоторых источниках утверждалось, что фтор слишком реакционноспособен для какой-либо химической изоляции.
Добыча флюорита, обеспечивающая наибольшее количество фтора в мире, достигла пика в 1989 году, когда 5,6 млн метрических тонн руды. Ограничения по хлорфторуглеродам снизили этот показатель до 3,6 млн. Тонн в 1994 году; производство с тех пор увеличивается. В 2003 году было получено около 4,5 миллионов тонн руды и выручка в размере 550 миллионов долларов США; более поздние отчеты оценили мировые продажи фторохимических продуктов в 2011 году в 15 миллиардов долларов и прогнозировали производственные показатели в 2016–2018 годах от 3,5 до 5,9 миллионов тонн, а выручку не менее 20 миллиардов долларов. Пенная флотация разделяет добытый флюорит на два основных металлургических сорта равных Пропорция: 60–85% метиспара почти весь используется в выплавке чугуна, тогда как 97% + чистый кислотный шпат в основном превращается в ключевой промышленный промежуточный продукт фтористый водород.
 Интерактивная диаграмма фторохимической промышленности в зависимости от массы потоки
Интерактивная диаграмма фторохимической промышленности в зависимости от массы потоки  SF. 6трансформаторы на российских железных дорогах
SF. 6трансформаторы на российских железных дорогах Ежегодно производится не менее 17 000 метрических тонн фтора. Он стоит всего 5–8 долларов за килограмм в виде гексафторида урана или серы, но во много раз дороже как элемент из-за проблем с обращением. В большинстве процессов с использованием свободного фтора в больших количествах используется генерация на месте при вертикальной интеграции.
Самым большим применением газообразного фтора, потребляющим до 7000 метрических тонн в год, является подготовка UF. 6для ядерный топливный цикл. Фтор используется для фторирования тетрафторида урана, который образуется из диоксида урана и плавиковой кислоты. Фтор является моноизотопом, поэтому любые различия в массе между молекулами UF. 6связаны с присутствием. U или. U, что позволяет обогащать уран посредством газовой диффузии или газовой центрифуги. Около 6000 метрических тонн в год уходит на производство инертного диэлектрика SF. 6для высоковольтных трансформаторов и автоматических выключателей, что устраняет необходимость в