Ксенон - это химический элемент с символом Xeи атомным номером 54. Это бес запаха, плотный, без запаха благородный газ, обнаруженный в атмосфере Земли в следовых количествах. Хотя ксенон обычно нереактивен, он может подвергаться нескольким химическим реакциям, таким как образование гексафтороплатината ксенона, первый соединения благородного газа, которое необходимо синтезировать.
Ксенон используется в импульсных лампах и дуговых лампах, а также в качестве общего анестетика. В первой конструкции эксимерного лазера использовалась молекула димера ксенона (Xe 2) в качестве среды для генерации, а в самом раннем лазере в конструкции использовала ксеноновые импульсные лампы в качестве насосов . Ксенон используется для поиска гипотетических слабовзаимодействующих массивных частиц и в качестве пропеллента для ионных двигателей в космических кораблях.
Встречающийся в природе ксенон из состоит из семи стабильных изотопов и два долгоживущих радиоактивных изотопа. Более 40 нестабильных изотопов ксенона подвергаются радиоактивному распаду, и изотопные отношения ксенона являются важными инструментами изучения ранней истории Солнечной системы. Радиоактивный ксенон-135 образует эффект бета-распада из йода-135 (продукт ядерного деления ) и является наиболее значимым (и нежелательные) поглотитель нейтронов в ядерных реакторах.
Ксенон был открыт в Англии шотландским химиком Уильямом Рамзи и английский химик Моррис Трэверс в сентябре 1898 года, вскоре после открытия ими элементов криптон и неон. Они представляют ксенон в остатке испаряющихся компонентов жидкого воздуха. Рамзи использует название ксенон для этого газа от греческого слова ξένον xénon, средней формы единственного числа от ξένος xénos, что означает «чужой (эр)», «странный (г)» или «гость». В 1902 году Рамзи оценил долю ксенона в атмосфере Земли в одну 20 миллионов.
В 1930-е годы американский инженер Гарольд Эдгертон начал исследовать стробоскоп технология для высокоскоростной фотографии. Это привело его к изобретению ксеноновой импульсной лампы, которая генерирует пропускание короткого электрического тока через трубку, заполненную газом ксеноном. В 1934 году Эдгертон смог с помощью этого метода вызвать вспышки длительностью в одну микросекунду.
В 1939 году американский врач Альберт Р. Бенке мл. начал изучать причины «пьянства» у глубоководных дайверов. Он проверил влияние изменений дыхательных смесей на своих испытуемых и обнаружил, что это заставляет дайверов ощущать изменение глубины. Из своих результатов он сделал вывод, что газ ксенон может служить анестетиком. Хотя российский токсиколог, по-видимому, изучал анестезию ксеноном в 1941 году, первый опубликованный отчет, подтверждающий анестезию ксеноном, был в 1946 году американским медицинским исследователем Джоном Х. Лоуренсом, который экспериментировал на мышах. Ксенон впервые был использован в качестве хирургического анестетика в 1951 году американским анестезиологом Стюартом Калленом, который успешно применил его на двух пациентах.
 Акриловый куб, специально подготовленный для сборщиков элементов, безопасный сжиженный ксенон
Акриловый куб, специально подготовленный для сборщиков элементов, безопасный сжиженный ксенон Ксенон и другие благородные газы были долгое время полностью химически инертным и не способным образовывать соединения. Однако, преподавая в Универсальной Британской Колумбии, Нил Бартлетт обнаружил, что газ гексафторид платины (PtF 6) был мощным окисляющий агент, который может окислять газообразный кислород (O 2) с образованием диоксигенилгексафтороплатината (O. 2[PtF. 6].). Времен O 2 (1165 кДж / моль) и ксенон (1170 кДж / моль) имеют почти одинаковый первый потенциал ионизации, Бартлетт понял, что гексафторид платины также может окислять ксенон. 23 марта 1962 года он смешал два газа и получил первое известное соединение благородного газа, гексафтороплатинат ксенона.
Бартлетт считал его составом Xe [PtF 6 ], но позже Исследования показали, что это, вероятно, смесь различных ксенон-содержащих солей. С тех пор были обнаружены многие другие соединения благородных газов аргона, криптона и радона, включая аргон. фторгидрид (HArF), дифторид криптона (KrF 2) и фторид радона. К 1971 году было известно более 80 соединений ксенона.
В ноябре 1989 года ученые IBM использовали методы, способную манипулировать отдельным атомами. Программа под названием IBM в атомах использовала сканирующий туннельный микроскоп, чтобы расположить 35 отдельных элементов ксенона на подложке из охлажденного кристалла никеля, чтобы разобрать три письма фирменный инициализм. Это был первый случай, когда атомы были точно расположены на плоской поверхности.
 Слой твердого ксенона, плавающий поверх жидкого ксенона внутри высоковольтного прибора.
Слой твердого ксенона, плавающий поверх жидкого ксенона внутри высоковольтного прибора. 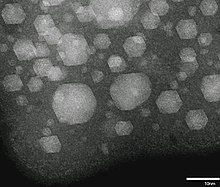 Жидкость (без признаков) и кристаллические твердые наночастицы Хе, полученная имплантацией Хе в алюминий при комнатной температуре.
Жидкость (без признаков) и кристаллические твердые наночастицы Хе, полученная имплантацией Хе в алюминий при комнатной температуре. Ксенон имеет атомный номер 54; то есть его ядро содержит 54 протона. При стандартной температуры и давления чистый газообразный ксенон имеет плотность 5,761 / м, примерно в 4,5 раза плотность атмосферы Земли на уровне моря, 1,217 кг / м. В жидком виде ксенон имеет плотность до 3 100 г / мл, причем максимум плотности на тройную точку. Жидкий ксенон обладает высокой поляризуемостью из-за большого атомного объема и таким образом, является отличным растворителем. Он может растворять углеводороды, биологические молекулы и даже воду. В тех же условиях плотность твердого ксенона, 3 640 г / см, больше, чем средняя плотность гранита, 2,75 г / см. При гигапаскалях от давления ксенон образует металлическую фазу.
Твердый ксенон изменен с гранецентрированной кубической (ГЦК) на гексагональная плотноупакованная кристаллическая фаза (ГПУ) под давлением и начинает превращаться в металлическую при примерно 140 ГПа без заметного изменения объема в ГПУ-фазе. Он полностью металлический при давлении 155 ГПа. В металлизированном состоянии ксенон кажется небесно-голубым, поскольку он поглощает красный свет и другие видимые частоты. Такое поведение необычно для металла и объясняется относительно небольшого диаметра электронного полотна в этом состоянии.
 Ксеноновая вспышка. (анимированная версия )
Ксеноновая вспышка. (анимированная версия )Жидкие или твердые наночастицы ксенона могут быть сформированы при комнатной температуре путем имплантации Xe ионы в твердую матрицу. У многих твердых тел постоянные решетки меньше, чем у твердого Xe. Это приводит к сжатию имплантированного Хе до давлений, которые могут быть достаточными для его разжижения или затвердевания.
Ксенон является членом элементов с нулевой валентностью , которые называются благородными или инертные газы. Он инертен по отношению к обычным обычным функциям (например, к обычному горению), потому что внешняя валентная оболочка содержит восемь электронов. Это создает стабильную конфигурацию с минимальной энергией, в которой внешние электроны плотно связаны.
В газонаполненной трубке ксенон излучает синий или лавандовое свечение при возбуждении электрическим разрядом. Ксенон излучает полосу из эмиссионных линий, которые охватывают визуальный спектр, но наиболее интенсивные линии используют в области синего света, вызывая окраску.
Ксенон - это газовые примеси в атмосфере Земли, содержание составляет 87 ± 1 нл / л (частей на миллиард ), или примерно 1 часть на 11,5 миллионов. Он также входит в состав газов, выделяемых из некоторых минеральных источников.
. Ксенон коммерчески добывается как побочный продукт разделения воздуха на кислород и азот. После этого разделения, обычно выполняемого фракционной перегонкой на двухколонной установке, полученный жидкий кислород будет содержать небольшие количества криптона и ксенона. Путем дополнительной фракционной перегонки жидкий кислород можно обогатить, чтобы он содержал 0,1–0,2% смеси криптон / ксенон, которые экстрагируют либо абсорбцией на силикагеле, либо перегонкой. Наконец, смесь криптона и ксенона может быть разделена на криптон и ксенон дальнейшей дистилляции.
Мировое производство ксенона в 1998 году оценивалось в 5 000–7 000 м3. Из-за своего дефицита ксенон намного дороже, чем более легкие благородные газы - примерные цены на закупку количеств в Европе в 1999 г. составляли 10 евро / л для ксенона, 1 евро / л для криптона и 0,20 евро / л для неона, в то время как более обильный аргон стоит менее цента за литр.
В пределах Солнечной системы доля нуклона ксенона составляет 1,56 × 10, для содержания, составляющего приблизительно одну часть из 630 тысяч от общей массы. Ксенон относительно редко встречается в атмосфере Солнца, на Земле и в астероидах и кометах. Содержание ксенона в атмосфере планеты Юпитер необычно велико, примерно в 2,6 раза больше, чем у Солнца. Это изобилие остается необъяснимым, но могло быть вызвано ранним и быстрым накоплением планетезималей - небольших субпланетных тел - перед нагреванием пресолярного диска. (В противном случае ксенон не попал бы в ловушку в планетезимальных льдах.) Проблема низкого земного ксенона может быть объяснена ковалентной связью ксенона может быть объяснена внутри кварца, уменьшая газ ксенона в атмосфере.
В отличие от благородных газов с меньшей массой, нормальный процесс звездного нуклеосинтеза внутри звезды не приводит к образованию ксенона. Элементы более массивные, чем железо-56, потребляют энергию за счет синтеза, а синтез ксенона не дает энергии для звезды. Вместо этого ксенон образует во время взрыва сверхновой, в классических взрывах новой, в результате медленного процесса захвата нейтронов (s-процесс ) в красном гиганте. звезды, которые исчерпали свой водород в ядре и вошли в асимптотическую ветвь гигантов, а также в результате радиоактивного распада, например, в результате бета-распада конечного йод-129 и спонтанное деление тория, урана и плутония.
Ксенон природного происхождения из семи стабильных изотопов : Xe, Xe и Xe. Теоретически изотопы Хе и Хе предсказывают двойной бета-распад, но этого никогда не наблюдалось, поэтому они считаются стабильными. Кроме того, изучено более 40 нестабильных изотопов. Самыми долгоживущими из этих изотопов являются первичный Xe, который подвергается воздействию электронов с периодом полураспада 1,8 × 10 лет, и Xe, который подвергается двойному бета-распаду с половиной -жизнь 2, 11 × 10 лет Хе образуется в результате бета-распада соединения I с периодом полураспада 16 миллионов лет. Хе, Хе, Хе и Хе являются одними из продуктов деления U и Pu и используются для обнаружения и контроля ядерных взрывов.
Ядра двух стабильных изотопов ксенона, Xe и Xe, имеют ненулевые собственные угловые моменты (ядерные спины, подходящие для ядерного магнитного резонанса ). Ядерные спины могут быть выровнены за пределы обычных уровней поляризации с помощью циркулярно поляризованного света и пара рубидия. Результирующая спиновая поляризация ядер ксенона может иметь значение 50% от своего максимального возможного значения, что значительно превышает теплового равновесия, диктуемое статистикой парамагнитной (обычно 0,001% от максимально возможного при комнатной температуре, даже в самых сильных магнитах ). Такое неравное выравнивание спинов является временным состоянием и называется гиперполяризацией. Процесс гиперполяризации ксенона называется оптической накачкой (хотя этот процесс отличается от накачки лазера ).
, потому что ядро Xe имеет спин 1/2, и, следовательно, ноль электрический квадрупольный момент, ядро Xe не испытывает никаких квадрупольных взаимодействий во время столкновения с другими атомами, и гиперполяризация сохраняется в течение долгого периода времени даже после того, как рождающиеся свет и пар удалены. от нескольких секунд для атомов ксенона, растворенных в крови, до нескольких часов в газовой фазе и нескольких дней в глубоко замороженном твердом ксеноне. Напротив, Xe имеет значение ядерного спина ⁄ 2 и ненулевой квадрупольный момент, а также время релаксации t 1 в миллисекунды и секунды диапазоны.
Некоторые радиоактивные изотопы ксенона (например, Xe и Xe) образуются при не йтронном облучении делящихся материалов l в ядерных реакторах.Xe имеет большое значение при эксплуатации ядерных реакторов деления. Xe имеет огромное сечение для тепловых нейтронов, 2,6 × 10 барн и работает как поглотитель нейтронов или «яд ", который может замедлить или остановить цепную реакцию после определенного периода работы. Это было обнаружено в самых первых ядерных реакторах, построенных в рамках американского Манхэттенского проекта для производства плутония. Однако конструкторы предусмотрели в проекте увеличение реактивности реактора (количество нейтронов на деление, которые переходят к делению других атомов ядерного топлива ). Отравление реактора Xe было основным фактором Чернобыльская катастрофа. Остановка или снижение мощности реактора может привести к накоплению Xe, при этом работа реактора перейдетв состоянии, известное как йодная яма.
. При неблагоприятных условиях относительно концентрации радиоактивных изотопов ксенона могут исходить из трещин топливные стержни, или деление ура на в охлаждающей воде.
Время ксенон является индикатором двух родительских изотопов, отношения изотопов ксенона в метеоритах являются мощным инструментом для изучения образование Солнечной системы. йодно-ксеноновый метод из датировки дает время, прошедшее между нуклеосинтезом и конденсацией твердого объекта из солнечной туманности. В 1960 году физик Джон Х. Рейнольдс обнаружил, что некоторые метеориты содержат изотопную аномалию в виде переизбытка ксенона-129. Он предположил, что это был продукт распада радиоактивного йода-129. Этот изотоп медленно образуется в результате расщепления космическими лучами и ядерного деления, но в больших количествах он образуется только при взрывах сверхновых.
Период полураспада Я сравнительно невелик. Короче говоря в космологическом масштабе времени (16 миллионов лет), это действало между сверхновой и моментом, когда метеориты затвердели и захватили I, прошло очень короткое время. произошли во время ранней истории Солнечной системы, потому что изотоп I, вероятно, был образован незадолго до образования Солнечной системы, заполнив облако солнечного газа изотопами из второго источника. Этот источник сверхновой также мог вызвать коллапс солнечного газового облака.
Аналогичным образом, изотопные отношения ксенона, такие как Xe / Xe и Xe / Xe, являются инструментом для понимания планетарной дифференциации и раннего выделения газа. Например, атмосфера Марса показывает содержание ксенона, аналогичное земному (0,08 частей на миллион), но Марс показывает большее содержание Xe, чем Земля или Солнце. Результатом этого может быть указание на то, что Марс потерял большую часть своей первоначальной атмосферы, возможно, в течение первых 100 миллионов лет после образования планеты. Другим примером избыток Xe, обнаруженный в углекислом газе скважин из Нью-Мексико, как предполагается, результатом распада мантийных газов вскоре после образования Земли..
После открытия Нилом Бартлеттом в 1962 году того факта, что ксенон может образовывать химические соединения, было описано и описано большое количество соединений ксенона. Почти все известные соединения ксенона содержат электроотрицательные атомы фтора или кислород. Химический состав ксенона в каждой степени окисления аналогичный химический составу соседнего элемента йода в более низкой степени окисления.
 Тетрафторид ксенона
Тетрафторид ксенона  XeF 4 кристаллы, 1962 г.
XeF 4 кристаллы, 1962 г. известны три фторида : XeF. 2, XeF. 4 и XeF. 6. Предполагается, что XeF нестабилен. Это отправные точки для синтеза почти всех соединений ксенона.
Твердый кристаллический дифторид XeF. 2образуется, когда смесь фтора и газов ксенона подвергается воздействию ультрафиолетового света. Достаточно ультрафиолетовой составляющей обычного дневного света. Длительное нагревание XeF. 2при высоких температурах под катализатором NiF. 2дает XeF. 6. Пиролиз XeF. 6в присутствии NaF дает XeF. 4.
высокой чистоты. Фториды ксенона ведут себя как акцепторы фторида, так и доноры фторида, образуя соли, содержащие такие катионы, как XeF. и Xe.. 2F. 3и анионы, такие как XeF. 5, XeF. 7и XeF. 8. Зеленый парамагнитный Хе. 2образует в результате восстановления XeF. 2газообразным ксеноном.
XeF. 2также образует координационные комплексы с ионами переходных металлов. Было синтезировано и охарактеризовано более 30 таких комплексов.
фториды ксенона хорошо охарактеризованы, за исключением дихлорида XeCl 2 и XeCl 4, галогениды предоставляют собой Неизвестный. Дихлорид ксенона, образующийся при высокочастотном облучении смесей ксенона, фтора и кремния или четыреххлористого углерода, как сообщается, является эндотермическим бесцветным соединением, которое разлагается на элементы при 80 ° C. Однако XeCl. 2может просто быть молекулой-дер-Ваальса из слабо связанных атомов Xe и молекулами Cl. 2, а не реальным соединением. Теоретические расчеты показывают, что линейная молекула XeCl. 2менее стабильна, чем комплекс Ван-дер-Ваальса. Тетрахлорид ксенона более нестабилен и не может быть синтезирован путем реакции. Он образован в результате радиоактивного. ICl. 4распада.
Три оксида ксенона известны: триоксид ксенона (XeO. 3) и тетроксид ксенона (XeO. 4), оба из которых являются опасно взрывоопасными и сильными окислителями, и оксид ксенона (XeO 2), о котором сообщалось в 2011 году с координационным сообществом, равным четырем. XeO 2 образуется, когда тетрафторид ксенона выливают на лед. Его кристаллическая структура может ему заменить кремний в силикатных минералах. Катион XeOO был идентифицирован с помощью инфракрасной спектроскопии в твердом аргоне.
Ксенон не реагирует напрямую с кислородом; триоксид образует в результате гидролиза XeF. 6:
XeO. 3слабокислый, растворяется в щелочи с образованием нестабильных ксенатных солей, содержащих анион HXeO. 4. Эти нестабильные соли легко диспропорционируют в газообразный ксенон и перксенат соли, внесон XeO. 6.
перксенат бария при обработке концентрированной серной кислотой, дает газообразный четырехокись ксенона:
Для предотвращения образованным таким образом четырехокись ксенона представляет собой быстро охлаждается до бледно-желтого твердого вещества. При температуре выше -35,9 ° C он взрывается и превращается в газообразный ксенон и кислород, но в остальном остается стабильным.
Известен ряд оксифторидов ксенона, включая XeOF. 2, XeOF. 4, XeO. 2F. 2и XeO. 3F. 2. XeOF. 2образует реакцию OF. 2 с газообразным ксеноном при низких температурах. Его также можно получить частичным гидролизом XeF. 4. Он диспропорционирует при -20 ° C на XeF. 2и XeO. 2F. 2. XeOF. 4образует реакцию в результате частичного гидролиза XeF. 6или реакции XeF. 6с перксенатом натрия, Na. 4XeO. 6. Последняя реакция также дает небольшое количество XeO. 3F. 2. XeOF. 4реагирует с CsF с образованием аниона XeOF. 5, а XeOF 3 реагирует с фторидами щелочных металлов KF, RbF и CsF с XeOF. 4
Ксенон может быть непосредственно с менее электроотрицательным элементом, чем фтор или кислород, особенно с углеродом. Электроноакцепторные группы, такие как группы с заменой фтором, необходимы для стабилизации этих соединений. Было охарактеризовано множество таких соединений, в том числе:
Другие соединения, содержащие ксенон, связанный с менее электроотрицательным элементом, включает F-Xe-N (SO. 2F). 2и F-Xe-BF. 2. Последний синтезируется из диоксигенил. тетрафторбората, O. 2BF. 4, при -100 ° C.
Необычным ионом, содержащим ксенон, является катион тетраксеноногольда (II) AuXe. 4, который содержит связь Xe - Au. Этот ион находится в соединении AuXe. 4(Sb. 2F. 11). 2, и примечателен наличием прямых химических связей между двумя заведомо инертными атомами, ксеноном и золотом, причем ксенон действует как лиганд переходного металла.
Соединение Xe. 2Sb. 2F. 11содержит связь Xe-Xe, самую длинную из известных связей элемент-элемент (308,71 пм = 3,0871 Å ).
В 1995 г. М. Расанен и его сотрудники, ученые из Университета Хельсинки в Финляндия объявил получение дигидрида ксенона (HXeH), а затем и гидроксида гидрида ксенона (HXeOH), гидроксеноацетилена (HXeCCH) и других Xe-молекулы. В 2008 году Хряччев и др. сообщили о получении HXeOXeH путем фотолиза воды в криогенной ксеноновой матрице. Были также получены дейтерированные молекулы, HXeOD и DXeOH.
В дополнение к соединениям, в которых ксенон образует химическую связь, ксенон может образовывать клатраты - вещества, в которых атомы или пары ксенона захватываются кристаллическая решетка другого соединения. Одним из примеров является гидрат ксенона (Xe · 5 / 4H2O), где атомы ксенона занимают вакансии в решетке молекул воды. Этот клатрат имеет температуру плавления 24 ° C. Также была произведена дейтерированная версия этого гидрата. Другой пример - гидрид ксенона (Xe (H 2)8), в которой пары (димеры) ксенона) захвачены внутри твердого водорода. Такие клатратные гидраты могут встречаться естественно, в условиях высокого давления, например, в озере Восток под антарктическим ледяным покровом. Образование клатратов можно использовать для фракционной перегонки ксенона, аргона и криптона.
Ксенон также может образовывать эндоэдральные соединения фуллерена, где атом ксенона захвачен внутри молекулы фуллерена. Атом ксенона, захваченный в фуллерен, можно наблюдать с помощью ядерного магнитного резонанса Xe (ЯМР) спектроскопия. Благодаря чувствительному химическому сдвигу атома ксенона в его окружении можно проанализировать химические реакции в молекуле фуллерена. Однако эти наблюдения не лишены недостатков, поскольку атом ксенона имеет электронное влияние на реакционную способность фуллерена.
Когда атомы ксенона находятся в основном энергетическом состоянии, они отталкиваются от каждого атома не образуют связи. Однако когда атомы ксенона возбуждаются, они могут образовывать эксимер (возбужденный димер), пока электроны не вернутся в основном состоянии . Эта сущность сформирована потому, что атом ксенона стремится заполнить внешнюю электронную оболочку, добавив электрон от соседнего атома ксенона. Типичный срок службы эксимера ксенона составляет 1–5 наносекунд, и при распаде высвобождаются фотоны с длинами волн примерно 150 и 173 нм. Ксенон может также образовывать эксимеры с другими элементами, такими как галогены бром, хлор и фтор.
Хотя ксенон используется редко и относительно дорого добывать из атмосферы Земли, он имеет ряд применений.
Ксенон используется в светоизлучающих устройств, называемых ксеными импульсными лампами, в фотографических вспышках и стробоскопических ламп; для возбуждения активной среды в лазерах, которые генерируют когерентный свет ; и, иногда, в бактерицидных лампах. Первый твердотельный лазер, изобретенный в 1960 году, накачивался ксеноновой импульсной лампой, лазеры, использованные для питания термоядерного синтеза с инерционным удержанием, также накачивались ксеноновыми импульсными лампами.
 Ксеноновая лампа с короткой дугой
Ксеноновая лампа с короткой дугой  Space Shuttle Atlantis, освещенная ксеноновыми лампами
Space Shuttle Atlantis, освещенная ксеноновыми лампами  Ксеноновая газоразрядная трубка
Ксеноновая газоразрядная трубка Непрерывная короткая дуга, высокое давление ксеноновые дуговые лампы имеют ую цветовую температуру близко приближается к полуденному солнечному свету и используется в имитаторах солнечной энергии. То есть цветность эти лампочки близко приближается к нагретому излучателю черного тела при температуре Солнца. Впервые представленные в 1940-х годах эти лампы заменили недолговечные угольные дуговые лампы в кинопроекторах. Они также используются в типичных проекционных системах 35 мм, IMAX и цифровых пленочных проекций. Они являются отличным источником коротковолнового ультрафиолетового излучения и имеют интенсивное излучение в ближнем инфракрасном, используемом в некоторых системах ночного видения. Ксенон используется в качестве стартового газа в автомобильных фарах HID и высококлассных «тактических» фонариках.
Отдельные ячейки плазменного дисплея содержат смесь ксенона. и неон, ионизированный электродами . Взаимодействие этой плазмы с электродами генерирует ультрафиолетовые фотоны, которые затем возбуждают покрытие люминофор на передней панели дисплея.
Ксенон используется в качестве «стартера». газ »в натриевых лампах высокого давления. Он имеет самую низкую теплопроводность и самый низкий потенциал ионизации среди всех нерадиоактивных благородных газов. Как благородный газ, он не мешает химическим реакциям, протекающим в операционной лампе. Низкая теплопроводность сводит к минимуму тепловые потери в лампе в рабочем состоянии, а низкий потенциал ионизации приводит к тому, что напряжение пробоя газа становится относительно низким в холодном состоянии, что позволяет лампе быть более прочной.
В 1962 году группа исследователей из Bell Laboratories обнаружила действие лазера в ксеноне, а позже обнаружила, что усиление лазера было улучшено добавлением гелий в лазерную среду. В первом эксимерном лазере использовался димер ксенона (Xe 2), возбуждаемый пучком электронов для получения стимулированного излучения при длина волны ультрафиолета 176 нм. Хлорид ксенона и фторид ксенона также использовались в эксимерных (или, точнее, эксиплексных) лазерах.
Ксенон использовался в качестве общий анестетик, но он дороже обычных анестетиков.
Ксенон взаимодействует со многими различными рецепторами и ионными каналами, и, как и многие теоретически мультимодальные ингаляционные анестетики, эти взаимодействия, вероятно, дополняют друг друга. Ксенон является высокоаффинным антагонистом рецептора NMDA-сайта глицинового участка. Однако ксенон отличается от некоторых других антагонистов рецепторов NMDA тем, что он не нейротоксичен и подавляет нейротоксичность кетамина и закиси азота, в то же время вызывая нейрозащитный эффект. В отличие от кетамина и закиси азота, ксенон не стимулирует отток дофамина в при соседнем ядре.
Как закись азота и циклопропан, ксенон активирует двухпоровый калиевый канал ТРЕК-1. Связанный канал TASK-3, также вовлеченный в действие ингаляционных анестетиков, нечувствителен к ксенону. Ксенон подавляет никотиновые рецепторы ацетилхолина α4β2, которые способствуют спинально-опосредованной анальгезии. Ксенон является эффективным ингибитором Са-АТФазы плазматической мембраны. Ксенон ингибирует Са-АТФазу, связываясь с гидрофобной порами внутри фермента и позволяя ферментировать принимать конформации.
Ксенон является конкурентным ингибитором рецептора серотонина 5-HT 3. Хотя он не является ни анестезирующим, ни антиноцицептивным, он снижает тошноту и рвоту, оказывающие при анестезии.
Ксенон имеет минимальную альвеолярную концентрацию (МАК) 72% в возрасте 40 лет, что делает его на 44% более эффективным, чем N 2 O в качестве анестетика. Таким образом, его можно использовать с кислородом вх, которые имеют меньший риск гипоксии. В отличие от закиси азота (N2O), ксенон не является парниковым газом и считается экологически чистым. Ксенон, выбрасываемый в атмосферу, как и перерабатывается в современных системах, возвращается только к своему первоначальному источнику без ущерба для окружающей среды.
Ксенон вызывает надежную кардиозащиту и нейрозащиту посредством различных механизмов. Благодаря своему влиянию на антагонизм Ca, K, KATP \ HIF и NMDA, ксенон является нейропротекторным при введении до, во время и после ишемических инсультов. Ксенон является антагонистом с высоким сродством к участку глицина рецептора NMDA. Ксенон является кардиопротекторным в условиях ишемии-реперфузии, вызывая фармакологическое неишемическое прекондиционирование. Ксенон оказывает кардиозащитное действие, активирует PKC-эпсилон и нижестий p38-MAPK. Ксенонитирует прекондиционирование нейронов при ишемии, активируя чувствительные к АТФ калиевые каналы. Ксенон аллостерически снижает ингибирование активации АТФ-опосредованного человека независимо от субъединицы рецептора 1 сульфонилмочевины, увеличенная и частоту открытого канала КАТФ.
Вдыхание смеси ксенон / который активирует выработку фактор транскрипта HIF-1-альфа, может привести к увеличению продукции эритропоэтина. Известно, что последний гормон большой объем красных кровяных телец и спортивные. Сообщается, что допинг ксеноном для ингаляций использовался в России с 2004 года, а возможно и раньше. 31 августа 2014 г. Всемирное антидопинговое агентство (WADA) добавило ксенон (и аргон ) в список запрещенных веществ и методов, хотя надежных тестов на допинг для этих газов не проводилось. пока не был разработан. Кроме того, до сих пор не было влияния ксенона на выработку эритропоэтина у людей.
Гамма изображения радиоизотопа Xe ксенона может быть использовано для сердца, легких и мозга, например, с помощью однофотонной эмиссионной компьютерной томографии. Xe также использовался для измерения кровотока.
Ксенон, особенно гиперполяризованный Xe, является полезным контрастным агентом для магнитно-резонансной томографии (МРТ). В газовой фазе он может отображать полости в пористом образце, альвеолы в легких или поток газов в легких. Время ксенон растворим как в воде, так и в гидрофобных растворителях, он может отображать различные мягкие живые ткани.
Ксенонхлоридный эксимерный лазер имеет определенное дерматологическое применение.
Из-за большой гибкой внешней оболочки атома ксенона спектр ЯМР изменяется в зависимости от окружающих условий и может быть использовано для наблюдения за окружающей химической обстановкой. Например, ксенон, раствор в воде, ксенон, растворенный в гидрофобном растворителе, и ксенон, связанный с определенными белками, можно различить с помощью ЯМР.
Гиперполяризованный ксенон может быть химиками-поверхностными. Обычно трудно охтеризовать поверхность с помощью ЯМР, потому что сигналы от поверхности подавляются сигналами ядерных устройств в объеме образца, намного больше, чем ядер на поверхности. Однако ядерные спины на твердых поверхностях могут быть избирательно поляризованы посредством передачи им спиновой поляризации от гиперполяризованного газа ксенона. Это делает поверхностные сигналы достаточно сильными, чтобы их можно было измерить и отличить от объемных сигналов.
В исследованиях ядерной энергии ксенон используется в пузырьковых камерах, зонды и в других областях, где желательны высокая молекулярная масса и инертный химический состав. Побочным ядерным оружием ядерное оружие выброс радиоактивных ксенона-133 и ксенона-135. Эти изотопы контролируются для обеспечения соблюдения договоров о запрещении ядерных испытаний, а также для подтверждения ядерных испытаний такими государствами, как Северная Корея.
 . Прототип ксенонового ионного двигателя проходит испытания в НАСА Лаборатория реактивного движения
. Прототип ксенонового ионного двигателя проходит испытания в НАСА Лаборатория реактивного движения Жидкий ксенон используется в калориметрах для измерения гамма-лучей и в качестве детектора гипотетических слабовзаимодействующих массивных частиц или WIMP. Когда WIMP сталкивается с ядром ксенона, теория предсказывает, что он может вызвать инициирование ионизации и сцинтилляцию. Жидкий ксенон полезен для этих экспериментов, потому что его плотность делает взаимодействие с темной материей более вероятным и позволяет использовать тихий детектор за счет самозащиты.
Ксенон является предпочтительным пропеллентом для ионной силовой установки космического корабля , поскольку он имеет низкий потенциал ионизации на атомный вес и может храниться в виде жидкости при температуре, близкой к комнатной температуре (при высоком давлении), но легко испаряется для питания двигателя. Ксенон инертен, экологически безопасен и менее агрессивен для ионного двигателя, чем другие виды топлива, такие как ртуть или цезий. Ксенон был использован в спутниковых ионных двигателях в 1970-х годах. Позже он использовался в качестве топлива для зонда JPL Deep Space 1, европейского космического корабля SMART-1 и для трех ионных силовых двигателей на космическом корабле НАСА Dawn Spacecraft.
. перксенат используются в качестве окислителей в аналитической химии. Дифторид ксенона используется в качестве травителя для кремния, в частности, при производстве микроэлектромеханических систем (MEMS). Противораковое лекарственное средство 5-фторурацил может быть получено путем взаимодействия дифторида ксенона с урацилом. Ксенон также используется в кристаллографии белков. При приложении давления от 0,5 до 5 МПа (от 5 до 50 атм ) к кристаллу белка атомы ксенона связываются преимущественно в гидрофобных полостях, часто создавая высокоэффективные качественное изоморфное производное с тяжелым атомом, которое можно использовать для решения фазовой проблемы .
| Опасности | |
|---|---|
| NFPA 704 (огненный алмаз) |  0 0 0 SA 0 0 0 SA |
используя они имеют сильной окислительной способностью, многие соединения кислорода - ксенона токсичны; они также взрывоопасны (сильно экзотермичны ), распадаясь на элементарный ксенон и двухатомный кислород (O 2) с гораздо более прочными химическими связями, чем соединения ксенона.
Ксенон можно хранить в обычных герметичных стеклянных или металлических контейнерах при стандартной температуре и давлении. Однако он растворяется в большинстве пластмасс и резины легко выходит из контейнера, запечатанного такими материалами. Ксенон не токсичен, хотя он растворяется в крови и принадлежит к избранной группе веществ, которые проникают через гематоэнцефалический барьер, вызывая от легкой до полной хирургической анестезии при вдыхании в высоких качех с кислородом.
скорость звука в газообразном ксеноне (169 м / с) меньше, чем в воздухе, чем у молекул азота и кислорода в воздухе. Следовательно, ксенон медленнее вибрирует в голосовых связках на выдохе и производит низкие голосовые тона (звуки с усилением низких частот, но основная частота или высота не работает.), эффект, противоположный высокому тону голоса, производимому в гелии. В частности, когда речевой тракт заполнен газом ксеноном, его собственная резонансная частота становится меньше, чем когда он заполнен воздухом. Таким образом, низкие частоты звуковой волны, создаваемые той же прямой вибрацией голосовыми связками, будут усилены, что к изменению тембра звука, усиленного голосовым трактом.. Как и гелий, ксенон не удовлетворяет потребность организма в кислороде, и он является одновременно единым удушающим и более сильным анестетиком, чем закись азота; Следовательно, ксенон стоит дорого, многие университеты запретили голосовой трюк в качестве общей демонстрации химии. Газ гексафторид серы аналогичный ксенону по молекулярной массе (146 против 131), менее дорог и, хотя и обладает удушающим действием, не токсичен и не обезболивает; в этих демонстрациях его часто заменяют.
Плотные газы, такие как ксенон и гексафторид серы, можно безопасно дышать, если они смешаны с минимумом 20% кислорода. Ксенон в этой системе 80% вместе с 20% кислородом быстро бессознательное состояние при общей анестезии (как обсуждалось выше). При дыхании очень эффективно и быстро смешиваются газы разной плотности, так что более тяжелые газы удаляются вместе с кислородом и не накапливаются в нижних частях легких. Однако существует опасность, связанная с любым тяжелым газом в больших количествах: он может незаметно находиться в контейнере, и человек, который входит в зону, заполненную бесцветным газом без запаха, может быть задохнулся без предупреждения. Ксенон редко используется в достаточно больших количествах, чтобы это было проблемой, хотя потенциальная опасность существует, когда резервуар или контейнер с ксеноном хранится в непроветриваемом помещении.
.