 | |||
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное наименование IUPAC Циклопропан | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ЧЭБИ | |||
| ChEMBL |
| ||
| ChemSpider | |||
| ECHA InfoCard | 100.000.771 | ||
| KEGG | |||
| PubChem CID | |||
| UNII | |||
| CompTox Dashboard (EPA ) | |||
InChI
| |||
| Свойства | |||
| Химическая формула | C3H6 | ||
| Молярная масса | 42,08 г / моль | ||
| Внешний вид | Бесцветный газ | ||
| Запах | Сладкий запах | ||
| Плотность | 1,879 г / л (1 атм, 0 ° C) | ||
| Температура плавления | -128 ° C (-198 ° F; 145 K) | ||
| Температура кипения | -33 ° C (-27 ° F; 240 K) | ||
| Кислотность (pK a) | ~ 46 | ||
| Магнитная восприимчивость (χ) | -39,9 · 10 см / моль | ||
| Опасности | |||
| Основные опасности | Легковоспламеняющиеся. Удушающие | ||
| Паспорт безопасности | |||
| NFPA 704 (огненный алмаз) |  4 1 0 4 1 0 | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в ink | |||
Циклопропан - это циклоалкан с молекулярной формулой C 3H6, состоящий из трех атомов углерода связаны друг с другом в кольцо, причем каждый атом углерода несет два атома водорода, что приводит к симметрии молекулы D 3h. Малый размер кольца создает значительную деформацию кольца в структуре.
Циклопропан является анестетиком. В современной анестезиологической практике его вытеснили другие агенты. Из-за его чрезвычайной реакционной способности смеси циклопропан-кислород могут взорваться.
Циклопропан был открыт в 1881 году Августом Фройндом, который также предложил правильную структуру вещества в своем первом бумага. Фрейнд обработал 1,3-дибромпропан с натрием, что вызвало внутримолекулярную реакцию Вюрца, приводящую непосредственно к циклопропану. Выход реакции был улучшен Густавсоном в 1887 году с использованием цинка вместо натрия. Циклопропан не имел коммерческого применения, пока Хендерсон и Лукас не обнаружили его анестезирующие свойства в 1929 году; промышленное производство началось к 1936 году.
Циклопропан был введен в клиническое использование американским анестезиологом Ральфом Уотерсом, который использовал закрытую систему с абсорбцией углекислого газа для сохранения этого тогдашний дорогостоящий агент. Циклопропан является относительно сильнодействующим, нераздражающим и пахнущим агентом с минимальной альвеолярной концентрацией 17,5% и коэффициентом распределения кровь / газ 0,55. Это означало, что введение анестезии путем вдыхания циклопропана и кислорода было быстрым и приятным. Однако по завершении длительной анестезии у пациентов может наблюдаться внезапное снижение артериального давления, что потенциально может привести к сердечной аритмии ; реакция, известная как «циклопропановый шок». По этой причине, а также из-за его высокой стоимости и взрывоопасности, в последнее время он использовался только для индукции анестезии и не был доступен для клинического использования с середины 1980-х годов. Цилиндры и расходомеры окрашены в оранжевый цвет.
Циклопропан неактивен в отношении ГАМК A и рецепторов глицина и вместо этого действует как антагонист рецептора NMDA. Он также подавляет рецептор AMPA и никотиновые рецепторы ацетилхолина и активирует определенные K2Pканалы.
 Перекрытие орбиталей в модели изогнутого связывания циклопропана
Перекрытие орбиталей в модели изогнутого связывания циклопропана Треугольная структура циклопропана требует, чтобы валентные углы между ковалентными связями углерод-углерод составляли 60 °. Это намного меньше термодинамически наиболее стабильного угла 109,5 ° (для связей между атомами с sp гибридизированными орбиталями ) и приводит к значительной деформации кольца. Молекула также имеет торсионную деформацию из-за затменной конформации ее атомов водорода. По существу, связи между атомами углерода значительно слабее, чем в типичном алкане, что приводит к гораздо более высокой реакционной способности.
Связь между углеродными центрами обычно описывается в терминах изогнутых связей. В этой модели углерод-углеродные связи изогнуты наружу, так что межорбитальный угол составляет 104 °. Это снижает уровень деформации связи и достигается за счет искажения sp-гибридизации атомов углерода в технически sp-гибридизацию (т.е. плотность ⁄ 6 s и плотность ⁄ 6 p), так что связи CC имеют более π-характер, чем обычно (в то же время связи углерод-водород приобретают более s-характер). Одно необычное последствие изогнутой связи состоит в том, что, хотя связи CC в циклопропане слабее, чем обычно, атомы углерода также расположены ближе друг к другу, чем в обычной алкановой связи: 151 пм против 153 пм (в среднем алкен связь: 146 мкм).
Стабильность из-за циклической делокализации шести электронов трех СС σ-связей циклопропана была дана Майклом Дж. С. Дьюаром в качестве объяснения лишь немного большего штамм циклопропана («всего» 27,6 ккал / моль) по сравнению с циклобутаном (26,2 ккал / моль) с циклогексаном в качестве эталона с E str = 0 ккал / моль. Эта стабилизация называется σ-ароматичностью, в отличие от обычной π-ароматичности, которая, например, представляет собой сильно стабилизирующий эффект в бензоле. Другие исследования не подтверждают роль σ-ароматичности в циклопропане и существование индуцированного кольцевого тока; такие исследования обеспечивают альтернативное объяснение энергетической стабилизации и аномального магнитного поведения циклопропана.
Циклопропан впервые был получен с помощью сочетания Вюрца, в котором 1,3-дибромпропан был циклизован с использованием натрия. Выход этой реакции можно повысить за счет использования цинка в качестве дегалогенирующего агента и йодида натрия в качестве катализатора.
Циклопропановые кольца обнаружены во множестве биомолекул (например, пиретринов, группа природных инсектицидов) и фармацевтических препаратов. Таким образом, образование циклопропановых колец, обычно называемое циклопропанированием, является активной областью химических исследований.
Из-за повышенного π-характера его СС-связи, циклопропан в некоторых случаях может реагировать как алкен. Например, он подвергается гидрогалогенированию с минеральными кислотами с образованием линейных алкилгалогенидов. Замещенные циклопропаны также вступают в реакцию согласно правилу Марковникова. Замещенные циклопропаны могут окислительно присоединять к переходным металлам в процессе, называемом C – C активацией.

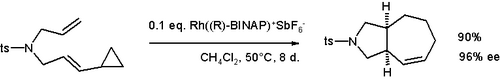
Циклопропильные группы, смежные с винилом группы могут вступать в реакции расширения кольца. Примеры включают винилциклопропановую перегруппировку и дивинилциклопропан-циклогептадиеновую перегруппировку. Эта реакционная способность может быть использована для образования необычных циклических соединений, таких как циклобутены, или бициклических разновидностей, таких как циклогептен, показанный ниже.
Циклопропан легко воспламеняется. Однако, несмотря на свою энергию деформации, он не намного более взрывоопасен, чем другие алканы.
| На Викискладе есть материалы, связанные с Циклопропан. |