Палладий - это химический элемент с символом Pd и атомным номером 46. Это редкий блестящий серебристо-белый металл, открытый в 1803 году английским химиком Уильямом Хайдом Волластоном. Он назвал его в честь астероида Паллада, который сам был назван в честь эпитета греческой богини Афины, приобретенного ею, когда она убила Паллада. Палладий, платина, родий, рутений, иридий и осмий образуют группу элементов, называемых металлами платиновой группы (МПГ). У них схожие химические свойства, но палладий имеет самую низкую температуру плавления и наименее плотный из них.
Более половины запасов палладия и его родственной платины используется в каталитических нейтрализаторах, которые преобразуют до 90% вредных газов в выхлопных газах автомобилей ( углеводороды, монооксид углерода и диоксид азота ) в менее вредные вещества ( азот, диоксид углерода). и водяной пар ). Палладий также используется в электронике, стоматологии, медицине, очистке водорода, химической промышленности, очистке грунтовых вод и ювелирных изделиях. Палладий - ключевой компонент топливных элементов, которые реагируют с водородом и кислородом с образованием электричества, тепла и воды.
Рудные месторождения палладия и других МПГ встречаются редко. Наиболее обширные месторождения были обнаружены в поясе норитов магматического комплекса Бушвельд, охватывающем бассейн Трансвааль в Южной Африке, в комплексе Стиллуотер в Монтане, США; бассейн Садбери и район Тандер-Бей в Онтарио, Канада, и Норильский комплекс в России. Переработка также является источником, в основном из списанных каталитических нейтрализаторов. Многочисленные применения и ограниченные источники поставок приводят к значительному инвестиционному интересу.
Палладий принадлежит к группе 10 в периодической таблице, но конфигурация внешних электронов соответствует правилу Хунда. Электроны на 5- секундной орбитали мигрируют, чтобы заполнить 4d- орбитали, поскольку энергетически более выгодно иметь полностью заполненную оболочку 4d 10 вместо конфигурации 5s 2 4d 8.
| Z | Элемент | Кол-во электронов на оболочку |
|---|---|---|
| 28 год | никель | 2, 8, 16, 2 (или 2, 8, 17, 1) |
| 46 | палладий | 2, 8, 18, 18, 0 |
| 78 | платина | 2, 8, 18, 32, 17, 1 |
| 110 | Дармштадтиум | 2, 8, 18, 32, 32, 16, 2 (прогноз) |
Эта конфигурация 5s 0, уникальная для периода 5, делает палладий самым тяжелым элементом, имеющим только одну неполную электронную оболочку, а все оболочки над ней пусты.
Палладий представляет собой мягкий серебристо-белый металл, напоминающий платину. Он наименее плотный и имеет самую низкую температуру плавления среди металлов платиновой группы. Он мягкий и пластичный при отжиге и значительно увеличивает прочность и твердость при холодной обработке. Палладий медленно растворяется в концентрированной азотной кислоте, в горячей концентрированной серной кислоте и при тонком измельчении в соляной кислоте. Он легко растворяется в царской водке при комнатной температуре.
Палладий не реагирует с кислородом при стандартной температуре (и поэтому не тускнеет на воздухе ). Палладий, нагретый до 800 ° C, образует слой оксида палладия (II) (PdO). Со временем он может постепенно приобретать легкую коричневатую окраску, вероятно, из-за образования поверхностного слоя его монооксида.
Пленки палладия с дефектами, образованными бомбардировкой альфа-частицами при низкой температуре, обладают сверхпроводимостью, имеющей T c = 3,2 К.
Встречающийся в природе палладий состоит из семи изотопов, шесть из которых являются стабильными. Наиболее стабильными радиоизотопами являются 107 Pd с периодом полураспада 6,5 миллионов лет (встречается в природе), 103 Pd с 17 днями и 100 Pd с 3,63 днями. Восемнадцать других радиоизотопов были охарактеризованы с атомными массами от 90,94948 (64) u ( 91 Pd) до 122,93426 (64) u ( 123 Pd). Они имеют период полураспада менее тридцати минут, за исключением 101 Pd (период полураспада: 8,47 часа), 109 Pd (период полураспада: 13,7 часа) и 112 Pd (период полураспада: 21 час).
Для изотопов с атомной единицей массы меньше, чем у наиболее распространенного стабильного изотопа, 106 Pd, первичным режимом распада является захват электрона, причем первичным продуктом распада является родий. Основным способом распада изотопов Pd с атомной массой более 106 является бета-распад, причем основным продуктом этого распада является серебро.
Радиогенный 107 Ag является продуктом распада 107 Pd и был впервые обнаружен в 1978 году в метеорите Санта-Клара в 1976 году. Первооткрыватели предполагают, что слияние и дифференциация малых планет с железными сердцевинами могло произойти через 10 миллионов лет после нуклеосинтетического события. 107 Корреляции между Pd и Ag, наблюдаемые в телах, которые расплавились после аккреции Солнечной системы, должны отражать присутствие короткоживущих нуклидов в ранней Солнечной системе.
Соединения палладия в основном существуют в степени окисления 0 и +2. Также признаются другие менее распространенные состояния. Обычно соединения палладия больше похожи на соединения платины, чем соединения любого другого элемента.

Структура α -PdCl 2

Хлорид палладия (II) является основным исходным материалом для других соединений палладия. Возникает при реакции палладия с хлором. Он используется для приготовления гетерогенных палладиевых катализаторов, таких как палладий на сульфате бария, палладий на угле и хлорид палладия на угле. Растворы PdCl 2 в азотной кислоте реагируют с уксусной кислотой с образованием ацетата палладия (II), который также является универсальным реагентом. PdCl 2 реагирует с лигандами (L) с образованием плоских квадратных комплексов типа PdCl 2 L 2. Одним из примеров таких комплексов является производное бензонитрила PdX 2 (PhCN) 2.
Комплексный дихлорид бис (трифенилфосфин) палладия (II) является полезным катализатором.
 Ацетат палладия (II)
Ацетат палладия (II)  Платино-палладиевая руда из рудника Стиллуотер в горах Медвежий Зуб, Монтана, США
Платино-палладиевая руда из рудника Стиллуотер в горах Медвежий Зуб, Монтана, США  Сульфидный серпентинтит (платино-палладиевая руда) из того же рудника
Сульфидный серпентинтит (платино-палладиевая руда) из того же рудника Палладий образует ряд нульвалентных комплексов с формулой PdL 4, PdL 3 и PdL 2. Например, восстановление смеси PdCl 2 ( PPh 3) 2 и PPh 3 дает тетракис (трифенилфосфин) палладий (0) :
Другой основной комплекс палладия (0), трис (дибензилиденацетон) дипалладий (0) (Pd 2 (dba) 3), получают восстановлением тетрахлорпалладата натрия в присутствии дибензилиденацетона.
Палладий (0), а также палладий (II) являются катализаторами в связывающих реакций, как уже было признано в 2010 году Нобелевской премии по химии для Richard F. Heck, нэгиси, эйити и Akira Suzuki. Такие реакции широко практикуются для синтеза тонких химикатов. Известные реакции сочетания включают сочетание Хека, Сузуки, Соногашира, реакции Стилле и сочетание Кумада. Ацетат палладия (II), тетракис (трифенилфосфин) палладий (0) (Pd (PPh 3) 4 и трис (дибензилиденацетон) дипалладий (0) (Pd 2 (dba) 3) служат либо катализаторами, либо предварительными катализаторами.
Хотя соединения Pd (IV) сравнительно редки, одним из примеров является гексахлорпалладат (IV) натрия, Na 2 [PdCl 6 ]. Известно также несколько соединений палладия (III). Палладий (VI) был заявлен в 2002 году, но впоследствии был опровергнут.
Существуют комплексы палладия со смешанной валентностью, например, Pd 4 (CO) 4 (OAc) 4 Pd (acac) 2 образует бесконечную цепную структуру Pd с альтернативно соединенными между собой звеньями Pd 4 (CO) 4 (OAc) 4 и Pd (acac) 2.
При легировании более электроположительным элементом палладий может приобретать отрицательный заряд. Такие соединения известны как палладиды, например палладид галлия. Палладиды со стехиометрией RPd 3 существуют, где R представляет собой скандий, иттрий или любой из лантаноидов.
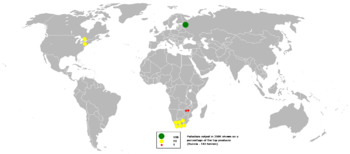 Производство палладия в 2005 г.
Производство палладия в 2005 г. Поскольку в 2016 году общее производство палладия на рудниках достигло 208 000 кг, Россия была ведущим производителем с показателем 82 000 кг, за ней следуют ЮАР, Канада и США. Российская компания « Норильский никель» занимает первое место среди крупнейших производителей палладия в мире, на долю которой приходится 39% мирового производства. производство.
Палладий можно найти в виде свободного металла, легированного золотом и другими металлами платиновой группы, в россыпных месторождениях Уральских гор, Австралии, Эфиопии, Северной и Южной Америки. Для производства палладия эти месторождения играют незначительную роль. Наиболее важные коммерческие источники никель - медные залежи найдены в Садбери бассейне, Онтарио, и Норильск-Талнахские месторождениях в Сибири. Другое крупное месторождение - это месторождение металлов платиновой группы Меренский риф в пределах Бушвельдского магматического комплекса в Южной Африке. Stillwater изверженных комплекс из Монтана и зоны рудного тела Роби в Лак - де - Îles изверженных комплекс Онтарио являются два других источника палладия в Канаде и Соединенных Штатах. Палладий содержится в редких минералах куперите и полярите. Известно еще много минералов Pd, но все они очень редки.
Палладий также производится в ядерных реакторах деления и может быть извлечен из отработавшего ядерного топлива (см. Синтез драгоценных металлов ), хотя этот источник палладия не используется. Ни одно из существующих ядерных перерабатывающих предприятий не оборудовано для извлечения палладия из высокоактивных радиоактивных отходов.
 Поперечное сечение каталитического нейтрализатора с металлическим сердечником
Поперечное сечение каталитического нейтрализатора с металлическим сердечником  Советская памятная палладиевая монета номиналом 25 рублей - редкий пример денежного использования палладия.
Советская памятная палладиевая монета номиналом 25 рублей - редкий пример денежного использования палладия. Сегодня палладий чаще всего используется в каталитических нейтрализаторах. Палладий также используется в ювелирных изделиях, стоматологии, производстве часов, в полосках для определения уровня сахара в крови, свечах зажигания самолетов, хирургических инструментах и электрических контактах. Из палладия также делают профессиональные поперечные (концертные или классические) флейты. Как товар, палладий в слитках имеет коды валюты по ISO XPD и 964. Палладий - один из четырех металлов, имеющих такие коды, а остальные - золото, серебро и платина. Поскольку он адсорбирует водород, палладий был ключевым компонентом спорных экспериментов по холодному синтезу в конце 1980-х годов.
Когда он тонко измельчается, как палладий на угле, палладий образует универсальный катализатор ; он ускоряет гетерогенные каталитические процессы, такие как гидрирование, дегидрирование и крекинг нефти. Палладий также необходим для катализатора Линдлара, также называемого палладием Линдлара. Большому количеству реакций углерод-углеродного связывания в органической химии способствуют катализаторы на основе соединения палладия. Например:
(См. Соединения палладия и реакции сочетания, катализируемые палладием. )
При диспергировании на проводящих материалах палладий является отличным электрокатализатором для окисления первичных спиртов в щелочной среде. Палладий также является универсальным металлом для гомогенного катализа, который используется в сочетании с широким спектром лигандов для высокоселективных химических превращений.
В 2010 году Нобелевская премия по химии была присуждена «за катализируемые палладием перекрестные связи в органическом синтезе» Ричарду Ф. Хеку, Эй-ичи Негиши и Акире Судзуки. Исследование 2008 года показало, что палладий является эффективным катализатором образования углеродно-фторных связей.
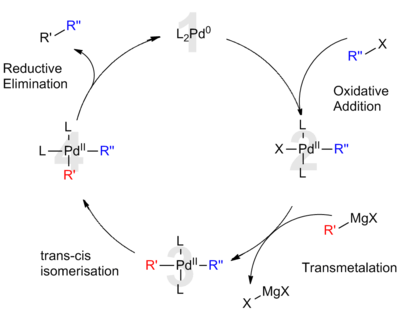 Каталитический цикл для реакции кросс-сочетания Кумады, которая широко используется в синтезе тонких химикатов.
Каталитический цикл для реакции кросс-сочетания Кумады, которая широко используется в синтезе тонких химикатов. Катализ палладием в основном используется в органической химии и промышленных приложениях, хотя его использование все чаще используется как инструмент синтетической биологии ; В 2017 году эффективная каталитическая активность наночастиц палладия in vivo была продемонстрирована на млекопитающих для лечения болезней.
Второе по величине применение палладия в электронике - это многослойные керамические конденсаторы, в которых палладий (и сплав палладий-серебро) используется в качестве электродов. Палладий (иногда легированный никелем) используется или может использоваться для покрытия компонентов и разъемов в бытовой электронике и в материалах для пайки. Согласно отчету Johnson Matthey, в 2006 году сектор электроники потребил 1,07 миллиона тройских унций (33 тонны) палладия.
Водород легко диффундирует через нагретый палладий, и мембранные реакторы с мембранами из Pd используются для производства водорода высокой чистоты. Палладий используется в палладий-водородных электродах в электрохимических исследованиях. Хлорид палладия (II) легко катализирует превращение газообразного монооксида углерода в диоксид углерода и используется в детекторах монооксида углерода.
Палладий легко адсорбирует водород при комнатной температуре, образуя гидрид палладия PdH x с x меньше 1. Хотя это свойство является общим для многих переходных металлов, палладий обладает уникально высокой абсорбционной способностью и не теряет своей пластичности, пока x не приближается к 1. Это свойство имеет были исследованы при разработке эффективной, недорогой и безопасной среды для хранения водородного топлива, хотя сам палладий в настоящее время является чрезмерно дорогим для этой цели. Содержание водорода в палладии может быть связано с магнитной восприимчивостью, которая уменьшается с увеличением содержания водорода и становится равной нулю для PdH 0,62. При любом более высоком соотношении твердый раствор становится диамагнитным.
Палладий используется в небольших количествах (около 0,5%) в некоторых сплавах стоматологической амальгамы для уменьшения коррозии и увеличения металлического блеска окончательной реставрации.
Палладий использовался в качестве драгоценного металла в ювелирных изделиях с 1939 года в качестве альтернативы платине в сплавах, называемых « белое золото », где естественный белый цвет палладия не требует покрытия родием. Палладий намного менее плотен, чем платина. Аналогично золото, палладий может быть избит в лист тонкий, как 100 нм ( 1 / 250,000 дюйма). В отличие от платины, палладий может обесцвечиваться при температурах выше 400 ° C (752 ° F) из-за окисления, что делает его более хрупким и, следовательно, менее подходящим для использования в ювелирных изделиях; чтобы предотвратить это, палладий, предназначенный для ювелирных изделий, нагревают в контролируемых условиях.
До 2004 года основным применением палладия в ювелирных изделиях было производство белого золота. Палладий - один из трех самых популярных металлов для легирования белого золота ( также можно использовать никель и серебро). Палладий-золото дороже, чем никель-золото, но редко вызывает аллергические реакции (хотя может возникнуть определенная перекрестная аллергия на никель).
Когда во время Второй мировой войны платина стала стратегическим ресурсом, многие ювелирные кольца стали делать из палладия. Палладий мало использовался в ювелирном деле из-за технической сложности литья. После решения проблемы литья использование палладия в ювелирных изделиях увеличилось, первоначально потому, что платина выросла в цене, а цена палладия снизилась. В начале 2004 года, когда цены на золото и платину резко выросли, Китай начал производство ювелирных изделий из палладия, потребив 37 тонн в 2005 году. Последующие изменения относительной цены на платину снизили спрос на палладий до 17,4 тонн в 2009 году. Спрос на палладий как катализатор увеличила цену на палладий примерно на 50% по сравнению с платиной в январе 2019 года.
В январе 2010 г. пробирные пробы на палладий были введены пробирными лабораториями Соединенного Королевства, и клейма стала обязательной для всех ювелирных изделий, рекламирующих чистый или легированный палладий. Изделия могут иметь маркировку 500, 950 или 999 частей палладия на тысячу сплава.
Перья перьевых ручек, сделанные из золота, иногда покрывают палладием, когда требуется серебристый (а не золотой) вид. Шеффер десятилетиями использовал покрытие из палладия либо как акцент на золотых перьях, либо как на полное покрытие золота.
В процессе платинотипной печати фотографы делают художественные черно-белые отпечатки с использованием солей платины или палладия. Палладий, часто используемый с платиной, является альтернативой серебру.
| Опасности | |
|---|---|
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| Положения об опасности GHS | H317 |
| Меры предосторожности GHS | P261, P273, P280, P302 + 352, P321, P333 + 313, P363, P501 |
| NFPA 704 (огненный алмаз) |  0 0 0 0 0 0 |
Палладий - это металл с низкой токсичностью, как принято измерять (например, LD 50 ). Недавние исследования механизма токсичности палладия предполагают высокую токсичность, если измерять ее в течение более длительного периода времени и на клеточном уровне в печени и почках. Митохондрии, по-видимому, играют ключевую роль в токсичности палладия из-за коллапса потенциала митохондриальной мембраны и истощения клеточного уровня глутатиона (GSH). До этой недавней работы считалось, что палладий плохо усваивается организмом человека при приеме внутрь. Такие растения, как водный гиацинт, погибают из-за низкого уровня солей палладия, но большинство других растений переносят это, хотя тесты показывают, что при уровнях выше 0,0003% рост нарушается. Большие дозы палладия могут быть ядовитыми; тесты на грызунах предполагают, что он может быть канцерогенным, хотя до недавнего исследования, упомянутого выше, не было четких доказательств того, что этот элемент вредит людям.
Как и другие металлы платиновой группы, палладий в массе довольно инертен. Хотя сообщалось о контактном дерматите, данные о его эффектах ограничены. Было показано, что люди с аллергической реакцией на палладий также реагируют на никель, поэтому рекомендуется избегать использования стоматологических сплавов, содержащих палладий, для людей с такой аллергией.
Некоторое количество палладия выделяется с выхлопными газами автомобилей с каталитическими нейтрализаторами. Такие автомобили выбрасывают от 4 до 108 нг / км частиц палладия, в то время как общее поглощение с пищей оценивается менее 2 мкг на человека в день. Второй возможный источник палладия - это стоматологическая реставрация, потребление палладия из которой, по оценкам, составляет менее 15 мкг на человека в день. Люди, работающие с палладием или его соединениями, могут значительно усвоить его. 99% растворимых соединений, таких как хлорид палладия, выводится из организма в течение 3 дней.
Средняя летальная доза (ЛД 50) растворимых соединений палладия на мышах составляет 200 мг / кг в течение перорального и 5 мг / кг для внутривенного введения.
 Уильям Хайд Волластон
Уильям Хайд Волластон Уильям Хайд Волластон отметил открытие нового благородного металла в июле 1802 года в своей лабораторной книге и назвал его палладием в августе того же года. Волластон очистил некоторое количество материала и предложил его, не называя первооткрывателя, в небольшом магазине в Сохо в апреле 1803 года. После резкой критики Ричарда Ченевикса за то, что палладий представляет собой сплав платины и ртути, Волластон анонимно предложил вознаграждение в размере 20 фунтов стерлингов. для 20 зерен синтетического сплава палладия. Ченевикс получил медаль Копли в 1803 году после публикации своих экспериментов с палладием. Волластон опубликовал открытие родия в 1804 году и упоминает некоторые из своих работ по палладию. Он сообщил, что он был первооткрывателем палладия в публикации 1805 года.
Он был назван Волластоном в 1802 году в честь астероида 2 Паллада, открытого двумя месяцами ранее. Уолластон найдено палладия в сырой платиновой руды из Южной Америки путем растворения руды в царской водке, нейтрализации раствора гидроксида натрия, и осаждении платины, как хлороплатинат аммония с хлоридом аммония. Он добавил цианид ртути с образованием цианида палладия (II), который нагревали для извлечения металлического палладия.
Одно время для лечения туберкулеза назначали хлорид палладия из расчета 0,065 г в день (примерно один миллиграмм на килограмм веса тела). Это лечение имело множество отрицательных побочных эффектов, и позже оно было заменено более эффективными лекарствами.
Чаще всего палладий используется в каталитических нейтрализаторах в автомобильной промышленности. В период до 2000 г. поставки палладия из России на мировой рынок неоднократно задерживались и прерывались; по политическим причинам экспортная квота не была предоставлена вовремя. Последовавшая паника на рынке привела к тому, что в январе 2001 года цена достигла рекордного уровня в 1340 долларов за тройскую унцию (43 доллара за г ). Примерно в то же время Ford Motor Company, опасаясь, что производство автомобилей будет остановлено из-за нехватки палладия, накопила запасы палладия. металл. Когда в начале 2001 года цены упали, Ford потерял почти 1 миллиард долларов США.
Мировой спрос на палладий увеличился со 100 тонн в 1990 году до почти 300 тонн в 2000 году. По данным Геологической службы США, мировое производство палладия на рудниках в 2006 году составило 222 тонны. Многие были обеспокоены стабильными поставками палладия после аннексии Крыма Россией, отчасти потому, что санкции могут помешать российскому экспорту палладия; любые ограничения на экспорт палладия из России могли усугубить уже ожидаемый большой дефицит палладия в 2014 году. Эти опасения подняли цены на палладий до самого высокого уровня с 2001 года. В сентябре 2014 года они превысили отметку в 900 долларов за унцию. Однако в 2016 году палладий стоил около 614 долларов за унцию, поскольку России удалось сохранить стабильные поставки. В январе 2019 года фьючерсы на палладий впервые за всю историю превысили 1344 доллара за унцию, в основном из-за высокого спроса со стороны автомобильной промышленности. 6 января 2020 года цена палладия достигла 2024,64 доллара за тройскую унцию (65,094 доллара за г), впервые превысив отметку в 2000 долларов за тройскую унцию.
В 2017 году мировые продажи палладия составили 8,84 млн унций, из которых 86% было использовано в производстве автомобильных каталитических нейтрализаторов, за которыми следовали промышленные, ювелирные и инвестиционные цели. Палладий - это химический элемент, впервые открытый в 1803 году, а с 1980-х годов его основное коммерческое применение находилось в автомобильной промышленности. Более 75% мировой платины и 40% палладия добывается в Южной Африке. Российская горнодобывающая компания « Норильский никель» производит еще 44% палладия, большая часть остального производится на рудниках США и Канады.
Цена на палладий 3 мая 2021 года достигла исторического максимума в размере 2981,40 доллара США за унцию, что было вызвано в основном спекуляциями о спросе на каталитические нейтрализаторы со стороны автомобильной промышленности. Палладий торгуется на спотовом рынке под кодом XPD. При расчетах в долларах США используется код XPDUSD. Позже избыток металла был вызван тем, что российское правительство продавало запасы с советских времен в объеме от 1,6 до 2 миллионов унций в год. Количество и статус этого запаса являются государственной тайной.
WisdomTree Physical Palladium ( LSE : PHPD ) поддерживается выделенными слитками палладия и является первым в мире палладиевым ETF. Он котируется на Лондонской фондовой бирже как PHPD, Xetra Trading System, Euronext и Milan. ETFS Physical Palladium Shares ( NYSE : PALL ) - это ETF, торгуемые на Нью-Йоркской фондовой бирже.
Традиционный способ инвестирования в палладий - покупка инвестиционных монет и слитков из палладия. Доступные палладиевые монеты включают канадский кленовый лист, китайскую панду и американский палладиевый орел. Ликвидность прямых инвестиций палладий в слитках беднее, чем золото и серебро, потому что низкая циркуляция палладиевых монет.