A связь углерод-углерод - это ковалентная связь между двумя атомами углерода атомами. Наиболее распространенной формой является одинарная связь : связь, состоящая из двух электронов, по одному от каждого из двух атомов. Простая связь углерод-углерод представляет собой сигма-связь и образуется между одной гибридизированной орбиталью каждого из атомов углерода. В этане орбитали представляют собой sp- гибридизованные орбитали, но одинарные связи, образованные между атомами углерода с другими гибридизациями, действительно возникают (например, sp в sp). Фактически, атомы углерода в одинарной связи не обязательно должны иметь одинаковую гибридизацию. Атомы углерода могут также образовывать двойные связи в соединениях, называемых алкенами, или тройными связями в соединениях, называемых алкинами. Двойная связь образуется с sp-гибридизированной орбиталью и p-орбиталью, которая не участвует в гибридизации. Тройная связь образуется с sp-гибридизированной орбиталью и двумя p-орбиталями от каждого атома. Использование p-орбиталей образует пи-связь.
Углерод - один из немногих элементов, которые могут образовывать длинные цепочки из собственных атомов, свойство, называемое катенацией. В сочетании с прочностью углерод-углеродной связи это приводит к появлению огромного количества молекулярных форм, многие из которых являются важными структурными элементами жизни, поэтому у углеродных соединений есть своя собственная область исследования: органическая химия.
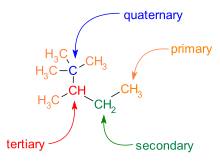 2,2,3-триметилпентан
2,2,3-триметилпентан Ветвление также часто встречается в скелетах C-C. Атомы углерода в молекуле классифицируются по количеству углеродных соседей, которые у них есть:
В «структурно сложных органических молекулах» трехмерная ориентация углерод-углеродных связей в четвертичных локусах определяет форму молекула. Кроме того, четвертичные локусы обнаруживаются во многих биологически активных малых молекулах, таких как кортизон и морфин.
Реакции образования углерод-углеродной связи являются органическими реакциями., в котором образуется новая углерод-углеродная связь. Они важны для производства многих искусственных химикатов, таких как фармацевтические препараты и пластмассы.
Некоторыми примерами реакций, которые образуют углерод-углеродные связи, являются альдольные реакции, реакция Дильса – Альдера, добавление реактива Гриньяра к карбонильной группе, реакция Хека, реакция Майкла и реакция Виттига.
Направленный синтез желаемых трехмерных структур для третичных углеродов был в значительной степени решен в конце 20-го века, но такая же способность к прямому синтезу четвертичного углерода не начала проявляться до тех пор, пока не появились первые десятилетие 21 века.
По сравнению с большинством связей, связь углерод-углерод очень прочная.
| Связь C – C | Молекула | Энергия диссоциации связи (ккал / моль) |
|---|---|---|
| CH3-CH 3 | этан | 90 |
| C6H5-CH 3 | толуол | 102 |
| C6H5−C6H5 | бифенил | 114 |
| CH3C (O) -CH 3 | ацетон | 84 |
| CH3-CN | ацетонитрил | 136 |
| CH3-CH 2 OH | этанол | 88 |
Приведенные выше значения представляют энергии диссоциации связи, которые обычно встречаются; иногда выбросы могут резко отклоняться от этого диапазона. В сильно перегруженном гексакис (3,5-ди-трет-бутилфенил) этане энергия диссоциации связи с образованием стабилизированного триарилметильного радикала составляет всего 8 ккал / моль. С другой стороны, центральная одинарная связь углерод-углерод диацетилена очень прочна при 160 ккал / моль, поскольку одинарная связь соединяет два атома углерода в результате sp-гибридизации. Множественные связи углерод-углерод обычно прочнее; двойная связь этилена и тройная связь ацетилена имеют энергии диссоциации связи 174 и 230 ккал / моль соответственно.
Типичная одинарная связь углерод-углерод имеет длину 154 пм, в то время как типичные двойная связь и тройная связь составляют 134 пм и 120 пм соответственно. Гексакис (3,5-ди-трет-бутилфенил) этан также является следствием его серьезной стерической перегрузки и имеет сильно вытянутую центральную связь длиной 167 мкм. С другой стороны, очень короткая тройная связь 115 пм наблюдалась для разновидностей иодония [HC≡C – IPh] [CF 3SO3] из-за сильно акцептирующего электроны иодониевого фрагмента.