Калий - это химический элемент с символом Hsи атомным номером 108. Калий очень радиоактивен ; его наиболее стабильные известные изотопы имеют период полураспада приблизительно десять секунд. Один из его изотопов, Hs, имеет магические числа как протонов, так и нейтронов для деформированных ядер, что дает ему большую устойчивость против спонтанного деления. Калий - это сверхтяжелый элемент ; он был произведен в лаборатории только в очень малых количествах путем слияния тяжелых ядер с более легкими. Были выдвинуты гипотезы о естественном появлении этого элемента, но так и не было обнаружено.
В периодической таблице элементов, гассий является трансактинидным элементом, членом 7-го периода и группы 8 ; таким образом, это шестой член 6d серии переходных металлов. Химические эксперименты подтвердили, что хассий ведет себя как более тяжелый гомолог к осмию, легко реагируя с кислородом с образованием летучего тетроксида. Химические свойства хассия охарактеризованы лишь частично, но они хорошо сопоставимы с химией других элементов группы 8.
Основным нововведением, которое привело к открытию хассия, была техника холодного синтеза, в которой слитые ядра не различались по массе так сильно, как в более ранних методах. Он полагался на большую стабильность ядер-мишеней, что, в свою очередь, уменьшало энергию возбуждения. Это уменьшило количество нейтронных выбросов во время синтеза, создавая более тяжелые и стабильные ядра. Впервые методика прошла испытания в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Московской области, РСФСР, Советский Союз, 1974 г. ОИЯИ использовал эту технику, чтобы попытаться синтезировать 108-й элемент в 1978, 1983 и 1984 годах; Последний эксперимент привел к утверждению, что элемент 108 был произведен. Позже, в 1984 году, обобщающее заявление последовало из Gesellschaft für Schwerionenforschung (GSI) в Дармштадте, Гессен, Западная Германия. В отчете 1993 года Рабочей группы Transfermium, сформированной Международным союзом чистой и прикладной химии и Международным союзом чистой и прикладной физики, сделан вывод о том, что отчет из Дармштадта является окончательным в отношении своего собственного, а дубненского не было, и большая заслуга была отдана немецким ученым. GSI официально объявила о своем желании назвать элемент hassium в честь немецкой земли Гессен (Hassia на латинском языке), где в 1992 году находился объект; это название было принято окончательным в 1997 году.
 Графическое изображение реакции ядерного синтеза. Два ядра сливаются в одно, испуская нейтрон. Реакции, которые привели к появлению новых элементов к этому моменту, были похожи, с той лишь разницей, что иногда выделялось несколько единичных нейтронов или ни одного.
Графическое изображение реакции ядерного синтеза. Два ядра сливаются в одно, испуская нейтрон. Реакции, которые привели к появлению новых элементов к этому моменту, были похожи, с той лишь разницей, что иногда выделялось несколько единичных нейтронов или ни одного. | Внешнее видео | |
|---|---|
Самые тяжелые атомные ядра образуются в ядерных реакциях, которые объединяют два других ядра разного размера в одно; грубо говоря, чем более неравны два ядра по массе, тем больше вероятность их реакции. Материал, состоящий из более тяжелых ядер, превращается в мишень, которую затем бомбардируют пучком более легких ядер. Два ядра могут сливаться в одно, только если они достаточно близко подходят друг к другу; обычно ядра (все положительно заряженные) отталкиваются друг от друга из-за электростатического отталкивания. сильное взаимодействие может преодолеть это отталкивание, но только на очень коротком расстоянии от ядра; Таким образом, ядра пучка сильно ускоряются, чтобы сделать такое отталкивание незначительным по сравнению со скоростью ядра пучка. Одного сближения недостаточно для слияния двух ядер: когда два ядра сближаются, они обычно остаются вместе примерно на 10 секунд, а затем расходятся (не обязательно в том же составе, что и до реакции), а не образуют единое ядро. Если слияние действительно происходит, временное слияние, называемое составным ядром, представляет собой возбужденное состояние. Чтобы потерять свою энергию возбуждения и достичь более стабильного состояния, составное ядро либо делится, либо испускает один или несколько нейтронов, которые уносят энергию. Это происходит примерно через 10 секунд после первоначального столкновения.
Луч проходит через цель и достигает следующей камеры, сепаратора; если новое ядро произведено, оно переносится этим лучом. В сепараторе вновь образованное ядро отделяется от других нуклидов (от исходного пучка и любых других продуктов реакции) и переносится на детектор с поверхностным барьером , который останавливает ядро. Отмечается точное место предстоящего удара о детектор; также отмечена его энергия и время прибытия. Перевод занимает около 10 секунд; Чтобы ядро было обнаружено, оно должно выжить так долго. Ядро регистрируется снова после регистрации его распада и измерения местоположения, энергии и времени распада.
Стабильность ядра обеспечивается сильным взаимодействием. Однако его диапазон очень мал; по мере того, как ядра становятся больше, его влияние на наиболее удаленные нуклоны (протоны и нейтроны) ослабевает. В то же время ядро разрывается электростатическим отталкиванием между протонами, так как оно имеет неограниченный радиус действия. Таким образом, ядра самых тяжелых элементов предсказаны теоретически и до сих пор наблюдались в основном распадом через моды распада, вызванные таким отталкиванием: альфа-распад и спонтанное деление ; эти режимы преобладают для ядер сверхтяжелых элементов. Альфа-распад регистрируется испускаемыми альфа-частицами, и продукты распада легко определить до фактического распада; если в результате такого распада или серии последовательных распадов образуется известное ядро, исходный продукт реакции можно определить арифметически. Самопроизвольное деление, однако, производит различные ядра в качестве продуктов, поэтому исходный нуклид не может быть определен по его дочерним элементам.
Информация, доступная физикам, стремящимся синтезировать один из самых тяжелых элементов, - это информация, собранная на детекторах: местоположение, энергия и время прибытия частицы к детектору и время ее распада. Физики анализируют эти данные и пытаются сделать вывод, что это действительно было вызвано новым элементом и не могло быть вызвано другим нуклидом, чем заявленный. Часто предоставленных данных недостаточно для вывода о том, что новый элемент определенно был создан, и нет другого объяснения наблюдаемых эффектов; допущены ошибки в интерпретации данных.
 Схема аппарата для создания сверхтяжелых элементов на базе Дубненского газонаполненного сепаратора отдачи, установленного в Лаборатории ядерных реакций им. Флерова в ОИЯИ. Траектория внутри детектора и устройства фокусировки луча изменяется из-за дипольного магнита в первом и квадрупольных магнитов во втором.
Схема аппарата для создания сверхтяжелых элементов на базе Дубненского газонаполненного сепаратора отдачи, установленного в Лаборатории ядерных реакций им. Флерова в ОИЯИ. Траектория внутри детектора и устройства фокусировки луча изменяется из-за дипольного магнита в первом и квадрупольных магнитов во втором. Ядерная энергия реакции, использовавшиеся в 1960-х, приводили к высоким энергиям возбуждения, которые требовали выброса четырех или пяти нейтронов; в этих реакциях использовались мишени из элементов с высокими атомными номерами, чтобы максимально увеличить разницу в размерах между двумя ядрами в реакции. Хотя это увеличивало вероятность синтеза из-за более низкого электростатического отталкивания между целью и снарядом, сформированные составные ядра часто распадались и не выживали, чтобы сформировать новый элемент. Более того, процессы термоядерного синтеза неизбежно приводят к образованию ядер с низким содержанием нейтронов, поскольку более тяжелым элементам требуется больше нейтронов на протон для максимальной стабильности; следовательно, необходимый выброс нейтронов приводит к получению конечных продуктов с обычно более коротким сроком службы. Таким образом, световые лучи (от шести до десяти протонов) позволяли синтезировать элементы только до 106.
Чтобы перейти к более тяжелым элементам, советский физик Юрий Оганесян из Объединенного института ядерной энергетики Исследования (ОИЯИ) в Дубне, Московской области, РСФСР, Советский Союз предложили другой механизм, в котором бомбардируемым ядром будет свинец-208, имеющий магические числа протонов и нейтронов, или другое близкое к нему ядро. Каждый протон и нейтрон имеет фиксированное значение энергии покоя ; протоны всех протонов равны, как и нейтронов. В ядре часть этой энергии уходит на связывание протонов и нейтронов; если в ядре есть магическое число протонов и / или нейтронов, то отводится еще больше его энергии покоя, что придает нуклиду дополнительную стабильность. Эта дополнительная стабильность требует большего количества энергии для внешнего ядра, чтобы сломать существующее и проникнуть в него. Больше энергии, направляемой на связывающие нуклоны, означает меньшую энергию покоя, что, в свою очередь, означает меньшую массу (масса пропорциональна энергии покоя). Более равные атомные номера реагирующих ядер приводят к большему электростатическому отталкиванию между ними, но более низкий избыток массы ядра-мишени уравновешивает его. Это оставляет меньше энергии возбуждения для вновь созданного составного ядра, что требует меньшего количества нейтронных выбросов для достижения стабильного состояния. Из-за этой разницы энергий первый механизм стал известен как «горячий синтез», а второй - как «холодный синтез».
Холодный синтез был впервые объявлен успешным в 1974 г. в ОИЯИ, когда он был испытан для синтеза еще неоткрытый элемент 106. Согласно прогнозам, эти новые ядра будут распадаться в результате спонтанного деления. Физики ОИЯИ пришли к выводу, что элемент 106 был произведен в эксперименте, потому что ни одно из известных в то время делящихся ядер не показывало параметры деления, аналогичные тем, которые наблюдались во время эксперимента, и потому, что изменение любого из двух ядер в реакциях сводило на нет наблюдаемые эффекты. Физики Лаборатории Лоуренса Беркли (LBL; первоначально Radiation Laboratory, RL, а позже Национальная лаборатория Лоуренса Беркли, LBNL) Калифорнийского университета в Беркли, Калифорния, США, также проявили большой интерес к новой технике. Когда его спросили о том, как далеко может зайти этот новый метод и если бы ведущие цели были физикой »Клондайк, Оганесян ответил:« Клондайк может быть преувеличением [...] Но скоро мы попытаемся получить элементы 107... 108 в этих реакциях. "
Впервые попытка синтеза элемента 108 была предпринята в 1978 г. группой исследователей ОИЯИ под руководством Оганесяна. Команда использовала реакцию, которая позволила бы получить элемент 108, в частности, изотоп 108, в результате синтеза радия (в частности, изотопа. 88Ra.) и кальция (. 20Ca.). Исследователи не были уверены в интерпретации своих данных, и в их статье не было однозначного утверждения об открытии этого элемента. В том же году другая группа в ОИЯИ исследовала возможность синтеза 108-го элемента в реакциях между свинцом (. 82Pb.) и железом (. 26Fe.); они были не уверены в интерпретации данных, предполагая возможность того, что элемент 108 не был создан.
 линейный ускоритель частиц GSI UNILAC, где был обнаружен гассий и где впервые был обнаружен его химический состав
линейный ускоритель частиц GSI UNILAC, где был обнаружен гассий и где впервые был обнаружен его химический состав В 1983 году, в ОИЯИ были проведены новые эксперименты. В результате экспериментов, вероятно, был синтезирован элемент 108; висмут (. 83Bi.) бомбардировали марганцем (. 25Mn.) для получения 108, свинец (. 82Pb.,. 82Pb.) бомбардировали железом (. 26Fe.), чтобы получить 108, и калифорний (. 98Cf.) был подвергнут бомбардировке неоном (. 10Ne.), чтобы получить 108. Эти эксперименты не были заявлены как открытие, и Оганесян объявил о них на конференции, а не в письменном отчете.
В 1984 году исследователи ОИЯИ в Дубна проводила эксперименты, идентичные предыдущим; они бомбардировали висмутовые и свинцовые мишени ионами более легких элементов - марганца и железа соответственно. Было зарегистрировано 21 событие спонтанного деления; исследователи пришли к выводу, что они были вызваны 108.
Позже, в 1984 году, группа исследователей под руководством Питера Армбруста и Готфрида Мюнценберга в Gesellschaft für Schwerionenforschung (GSI; Институт исследований тяжелых ионов) в Дармштадте, Гессен, Западная Германия, попытался создать элемент 108. Команда бомбардировала зацепку (. 82Pb.) мишень с ускоренными ядрами железа (. 26Fe.). Эксперимент GSI по созданию элемента 108 был отложен до тех пор, пока они не создали элемент 109 в 1982 году, так как предыдущие расчеты предполагали, что четные-четные изотопы элемента 108 будут иметь период полураспада спонтанного деления. менее одной микросекунды, что затрудняет их обнаружение и идентификацию. Эксперимент с элементом 108, наконец, продолжился после того, как 109 был синтезирован и, как было обнаружено, распадается из-за альфа-излучения, что позволяет предположить, что изотопы элемента 108 будут делать то же самое, и это было подтверждено экспериментом, направленным на синтез изотопов элемента 106. GSI сообщил о синтезе три атома 108. Два года спустя они сообщили о синтезе одного атома четно-четного 108.
В 1985 году Международный союз чистой и прикладной химии (IUPAC) и Международный союз чистой и прикладной физики (IUPAP) сформировали рабочую группу Transfermium (TWG) для оценки открытий и определения окончательных названий для элементов с атомными номерами больше чем 100. Партия провела встречи с делегатами из трех конкурирующих институтов; в 1990 г. они установили критерии признания элемента, а в 1991 г. завершили работу по оценке открытий и распустились. Эти результаты были опубликованы в 1993 году.
Согласно отчету, в работах 1984 г., проведенных ОИЯИ и GSI, одновременно и независимо установлен синтез элемента 108. Из двух работ 1984 г., было заявлено, что достаточно одной работы GSI, поскольку открытие само по себе. Работа ОИЯИ, предшествовавшая работе GSI, «очень вероятно» показала синтез элемента 108. Однако это было определено ретроспективно, учитывая работу из Дармштадта; Работа ОИЯИ была сосредоточена на химической идентификации удаленных внучок изотопов элемента 108 (что не могло исключить возможность того, что у этих дочерних изотопов были другие предшественники), в то время как работа GSI четко идентифицировала путь распада этих изотопов элемента 108. В отчете сделан вывод о том, что основная заслуга должна быть предоставлена GSI. В письменных ответах на это постановление ОИЯИ и GSI согласились с его выводами. В том же ответе GSI подтвердил, что они и ОИЯИ смогли разрешить все конфликты между ними.
Исторически недавно обнаруженный элемент был назван его первооткрывателем. Первое постановление было принято в 1947 году, когда ИЮПАК решил, что на случай противоречия названий следует ввести необходимые правила. Эти вопросы должны были быть решены Комиссией по атомным весам. Они просматривали имена в случае конфликта и выбирали одно; решение будет основываться на ряде факторов, таких как использование, и не будет показателем приоритета требования. Обе комиссии рекомендуют имя Совету ИЮПАК, который будет последней инстанцией. Первооткрыватели имели право назвать элемент, но их имя подлежало утверждению IUPAC. Комиссия по атомным весам в большинстве случаев дистанцировалась от наименования элементов.
Согласно номенклатуре Менделеева для безымянных и неоткрытых элементов, хассий будет известен как «эка- осмий ", как в" первом элементе ниже осмия в периодической таблице "(от санскрит eka, что означает" один "). В 1979 году ИЮПАК опубликовал рекомендации, согласно которым элемент должен был называться «unniloctium» и присвоил соответствующий символ «Uno», систематическое имя элемента в качестве заполнителя до тех пор, пока элемент был обнаружен, затем открытие подтвердилось, и было принято решение о постоянном названии. Хотя эти рекомендации широко применялись в химическом сообществе, конкурирующие физики в этой области игнорировали их. Они либо назвали его «элемент 108» с символами E108, (108) или 108, либо использовали предложенное название «хассиум».
 Фестиваль Hessentag в 2011 году, посвященный культуре немецкого государства Гессен, в честь которого назван хасий
Фестиваль Hessentag в 2011 году, посвященный культуре немецкого государства Гессен, в честь которого назван хасий В 1990 году, пытаясь выйти из тупика в установлении приоритета открытия и наименования нескольких элементов, ИЮПАК подтвердил в своей номенклатуре неорганической химии, что после того, как наличие элемента было установлено, первооткрыватели могли предложить имя. (Кроме того, Комиссия по атомным весам была исключена из процесса присвоения имен.) Первая публикация о критериях открытия элемента, выпущенная в 1991 году, указала на необходимость признания TWG.
Армбрустер и его коллеги, официально признанные немецкие первооткрыватели провели церемонию присвоения имен элементам с 107 по 109, которые все были признаны открытыми GSI, 7 сентября 1992 года. Для элемента 108 ученые предложили название «хассий». Оно происходит от латинского названия Hassia для немецкого государства Гессен, где расположен институт. Это название было предложено ИЮПАК в письменном ответе на их постановление о приоритете требований обнаружения элементов, подписанное 29 сентября 1992 года.
Процесс присвоения имени элементу 108 был частью более крупного процесса присвоения числа элементов, начинающихся с элемент 101 ; три команды - ОИЯИ, GSI и LBL - заявили об открытии нескольких элементов и о праве называть эти элементы. Иногда эти утверждения противоречили друг другу; поскольку открыватель считался имеющим право на имя элемента, конфликты по поводу приоритета открытия часто приводили к конфликтам по поводу имен этих новых элементов. Эти конфликты стали известны как Transfermium Wars. Различные предложения назвать весь набор элементов, начиная с 101 и позже, и иногда они присваивали имена, предложенные одной командой, которые будут использоваться для элементов, обнаруженных другой. Однако не все предложения были встречены одинаково; группы несколько раз открыто возражали против предложений об именах.
В 1994 году Комиссия ИЮПАК по номенклатуре неорганической химии рекомендовала назвать элемент 108 «ганиум» (Hn) в честь немецкого физика Отто Хана поэтому элементы, названные в честь Хана и Лиз Мейтнер (было рекомендовано, чтобы элемент 109 был назван мейтнерием, по предложению GSI), должны были быть рядом друг с другом в честь их совместного открытия ядерного деления; ИЮПАК прокомментировал, что считает предложение Германии неясным. GSI возразила, заявив, что это предложение противоречит давнему соглашению о предоставлении первооткрывателю права предлагать имя; Американское химическое общество поддержало GSI. Название «ханиум», хотя и с другим символом Ha, уже было предложено и использовано американскими учеными для элемента 105, по поводу открытия которого у них возник спор с ОИЯИ; таким образом они протестовали против запутанной путаницы имен. После шума ИЮПАК сформировал специальный комитет из представителей национальных организаций трех стран, в которых находятся конкурирующие институты; в 1995 году они произвели новый набор имен. Элемент 108 снова был назван hahnium; это предложение также было отклонено. Окончательный компромисс был достигнут в 1996 году и опубликован в 1997 году; элемент 108 был назван хассием (Hs). Одновременно название dubnium (Db; из Дубны, местонахождение ОИЯИ) было присвоено элементу 105, а название hahnium не использовалось ни для одного элемента.
Официальное обоснование этого наименования, наряду с darmstadtium для элемента 110 заключался в том, что он завершил набор географических названий для местоположения GSI; этот набор был инициирован названиями 19 века европий и германий. Этот набор будет служить ответом на более раннее присвоение имен америций, калифорний и берклий для элементов, обнаруженных в Беркли. Армбрустер прокомментировал это: «Эта плохая традиция была заложена в Беркли. Мы хотели сделать это для Европы». Позже, комментируя присвоение имени элементу 112, Армбрустер сказал: «Я сделал все, чтобы мы не продолжили сотрудничество с немецкими учеными и немецкими городами».
| Изотоп | Half-life | Decay. mode | Discovery. year | Discovery. реакция | |
|---|---|---|---|---|---|
| Значение | Ref | ||||
| Hs | 760 мкс | α, SF | 2009 | Pb (Fe, n) | |
| Hs | 540 мкс | α, SF | 1986 | Pb (Fe, n) | |
| Hs | 1,96 мс | α, SF | 1984 | Pb (Fe, n) | |
| Hs | 360 мкс | α | 1995 | Pb (Fe, n) | |
| Hs | 3,02 мс | α, SF | 2001 | Ds (-, α) | |
| Hs | 280 мс | α | 2011 | Ds (-, α) | |
| Hs | 55 мс | α | 1995 | U (S, 5n) | |
| Hs | 990 мкс | α | 2004 | U (S, 5n) | |
| Hs | 1,42 с | α | 2010 | U (S, 4n) | |
| Hs | 16 с | α | 1996 | Cn (-, 2α) | |
| Hs | 9 с | α | 2003 | Cm (Mg, 4n) | |
| Hs | 10 с | α | 2008 | Cm (Mg, 3n) | |
| Hs | 510 мс | α | 2010 | Fl (-, 3α) | |
| Hs | 200 мс | α | 2004 | Fl (-, 3α) | |
| Hs | 11 мс | α | 2010 | Fl (-, 3α) | |
| Hs | 11 0 с | SF | 2012 | Lv (-, 4α) | |
Калий не имеет стабильных или встречающихся в природе изотопов. Несколько радиоактивных изотопов были синтезированы в лаборатории либо путем слияния двух атомов, либо путем наблюдения за распадом более тяжелых элементов. По состоянию на 2019 год количество всего когда-либо произведенного хассия составляло порядка сотен атомов. Сообщалось о двенадцати изотопах с массовыми числами от 263 до 277 (за исключением 272, 274 и 276), четыре из которых - хассий-265, -267, -269 и -277 - известны метастабильными говорится в, хотя данные о хассии-277 не подтверждены. Большинство этих изотопов распадаются преимущественно в результате альфа-распада; это самый распространенный изотоп для всех изотопов, для которых доступны полные характеристики распада, за исключением гассия-277, который подвергается спонтанному делению. Более легкие изотопы обычно синтезировались прямым синтезом между двумя более легкими ядрами, тогда как более тяжелые изотопы обычно наблюдались как продукты распада ядер с большими атомными номерами.
Атомные ядра имеют хорошо зарекомендовавшие себя ядерные оболочки, и существование этих оболочек обеспечивает ядрам дополнительную стабильность. Если в ядре есть определенное количество протонов или нейтронов, называемое магическими числами, которые завершают определенные ядерные оболочки, то ядро еще более устойчиво к распаду. Наивысшие известные магические числа 82 для протонов и 126 для нейтронов. Это понятие иногда расширяется, чтобы включить дополнительные числа между этими магическими числами, которые также обеспечивают некоторую дополнительную стабильность и указывают на закрытие «подоболочек». В отличие от более известных более легких ядер, сверхтяжелые ядра деформируются. До 1960-х годов модель жидкой капли была доминирующим объяснением структуры ядра. Он предполагает, что барьер деления исчезнет для ядер с примерно 280 нуклонами. Таким образом, считалось, что спонтанное деление произойдет почти мгновенно, прежде чем ядра смогут сформировать структуру, которая могла бы их стабилизировать; оказалось, что ядра с Z ≈ 103 были слишком тяжелыми, чтобы существовать в течение значительного периода времени.
Более поздняя модель ядерной оболочки предполагала, что ядра с примерно тремя сотнями нуклонов будут образовывать остров стабильности, в котором ядра будут более устойчивы к спонтанному делению и в первую очередь будут подвергаться альфа-распаду с более длинными периодами полураспада, а следующее дважды магическое ядро (имеющее магические числа как протонов, так и нейтронов) ожидается, что он будет находиться в центре острова стабильности в районе Z = 110–114 и предсказанного магического нейтронного числа N = 184. Последующие открытия показали, что предсказанный остров может быть дальше, чем первоначально ожидаемый; они также показали, что ядра, промежуточные между долгоживущими актинидами и предсказанным островом, деформируются и приобретают дополнительную стабильность за счет оболочечных эффектов. Прибавка к устойчивости против спонтанного деления должна быть особенно большой против спонтанного деления, хотя также будет заметным повышение стабильности против альфа-распада. Центр области на диаграмме нуклидов, которая соответствовала бы этой стабильности для деформированных ядер, был определен как Hs, при этом 108 ожидалось, что это магическое число для протонов для деформированных ядер - ядер, далеких от сферической, - а 162 - магическое число. для нейтронов для таких ядер. Эксперименты на более легких сверхтяжелых ядрах, а также на ядерных ядрах, расположенных ближе к ожидаемому острову, показали большую, чем ожидалось ранее, устойчивость к спонтанному делению, показывая важность оболочечных эффектов на ядра.
Теоретические модели предсказывают, что область нестабильности для некоторых изотопов гассия будет лежать около A = 275 и N = 168–170, что находится между предсказанными закрытием нейтронной оболочки при N = 162 для деформированных ядер и N = 184 для сферические ядра. Предполагается, что нуклиды в этой области будут иметь низкую высоту барьера деления, что приведет к коротким частичным периодам полураспада до спонтанного деления. Это предсказание подтверждается наблюдаемым периодом полураспада Hs в 11 миллисекунд и периодом полураспада соседней изобары Mt, поскольку было показано, что мешающие факторы от нечетного нуклона намного ниже, чем ожидалось.. Измеренные периоды полураспада даже ниже, чем предсказанные для четно-четных Hs и Ds, что указывает на разрыв в стабильности вдали от замыканий оболочки и, возможно, ослабление замыканий оболочки в этой области.
В В 1991 году польские физики Зигмунт Патык и Адам Собичевский предсказали, что 108 - это магическое число протона для деформированных ядер, а 162 - это магическое число нейтронов для таких ядер. Это означает, что такие ядра постоянно деформируются в своем основном состоянии, но имеют высокие узкие барьеры деления для дальнейшей деформации и, следовательно, относительно большие времена жизни до спонтанного деления. Вычислительные перспективы стабилизации оболочки Hs сделали его многообещающим кандидатом на роль деформированного дважды магического ядра. Экспериментальных данных мало, но существующие данные интерпретируются исследователями как поддерживающие присвоение N = 162 как магического числа. В частности, к такому выводу пришли данные о распаде Hs, Hs и Hs. В 1997 году польский физик Роберт Смоланьчук подсчитал, что изотоп Hs может быть наиболее устойчивым сверхтяжелым ядром против альфа-распада и спонтанного деления в результате предсказанного закрытия оболочки N = 184.
 Молибденит
Молибденит Калий не встречается в природе на Земле; период полураспада всех его известных изотопов достаточно короткий, чтобы ни один первородный хассий не сохранился до наших дней. Это не исключает возможности существования неизвестных, долгоживущих изотопов или ядерных изомеров, некоторые из которых все еще могут существовать в следовых количествах, если они достаточно долгоживущие. Еще в 1914 году немецкий физик предложил элемент 108 в качестве источника рентгеновских лучей в ледяном щите Гренландии. Хотя Суинн не смог подтвердить это наблюдение и, таким образом, не заявил об открытии, в 1931 году он предположил существование «регионов» долгоживущих трансурановых элементов, в том числе одного с Z = 108.
В 1963 году советский геолог и физик Виктор Чердынцев, который ранее заявлял о существовании первозданного кюрия -247, утверждал, что открыл 108-й элемент, а именно изотоп 108, период полураспада которого предположительно составлял от 400 до 500 миллионов лет. природный молибденит и предложено предварительное название sergenium (символ Sg); это название происходит от названия Шелкового пути и объясняется для него как «происходящее из Казахстана ». Его обоснование для утверждения, что сергений является более тяжелым гомологом осмия, заключалось в том, что минералы, предположительно содержащие сергений, образовывали летучие оксиды при кипячении в азотной кислоте, аналогично осмию.
Чердынцев Выводы подверглись критике со стороны советского физика Владимира Кулакова на том основании, что некоторые свойства, которые, по утверждению Чердынцева, имел сергений, несовместимы с современной ядерной физикой. Главные вопросы, поднятые Кулаковым, заключались в том, что заявленная энергия альфа-распада сергения была на много порядков ниже ожидаемой, а указанный период полураспада был на восемь порядков меньше, чем можно было бы спрогнозировать для альфа-распада нуклида с заявленным распадом. энергия. В то же время скорректированный период полураспада в районе 10 лет был бы невозможен, поскольку это означало бы, что образцы содержали около ста миллиграммов сергения. В 2003 году было высказано предположение, что наблюдаемый альфа-распад с энергией 4,5 МэВ может быть следствием низкоэнергетического и сильно усиленного перехода между различными гипердеформированными состояниями изотопа гассия вокруг Hs, таким образом предполагая, что существование сверхтяжелых элементов в природе было по крайней мере возможным, хотя и маловероятным.
В 2006 году российский геолог Алексей Иванов выдвинул гипотезу, что изомер Hs может иметь период полураспада около (2,5 ± 0,5) × 10 лет, что объясняет наблюдение альфа-частиц с энергией около 4,4 МэВ в некоторых образцах молибденита и осмиридия. Этот изомер Hs может быть получен в результате бета-распада Bh и Sg, который, будучи гомологичным рению и молибдену соответственно, должен встречаться в молибдените вместе с рением и молибденом, если они происходят. в природе. Поскольку хассий гомолог осмию, он должен встречаться вместе с осмием в осмиридии, если встречается в природе. Цепочки распада Bh и Sg являются гипотетическими, и прогнозируемый период полураспада этого гипотетического изомера гассия недостаточен для того, чтобы какое-либо количество оставалось на Земле. Возможно, что больше Hs может осесть на Земле по мере того, как Солнечная система движется по спиральным рукавам Млечного Пути ; это объясняет избыток плутония-239, обнаруженного на дне океана Тихого океана и Финского залива. Однако прогнозируется, что минералы, обогащенные Hs, будут иметь избыток дочерних урана-235 и свинца-207; они также будут иметь разные пропорции элементов, которые образуются при спонтанном делении, таких как криптон, цирконий и ксенон. Естественное присутствие хассия в минералах, таких как молибденит и осмирид, теоретически возможно, но очень маловероятно.
В 2004 году ОИЯИ начал поиск природного хассия в Подземной лаборатории Модана в Модан, Овернь-Рона-Альпы, Франция; это было сделано под землей, чтобы избежать помех и ложных срабатываний от космических лучей. В 2008–09 годах эксперимент, проведенный в лаборатории, привел к регистрации нескольких зарегистрированных событий с множественностью нейтронов (количество испущенных свободных нейтронов после того, как ядро столкнулось с нейтроном и делилось), более трех в естественном осмии, а в 2012– 13, эти результаты были подтверждены в другом эксперименте, проведенном в лаборатории. Эти результаты намекают на натуральный хассий. потенциально может существовать в природе в количествах, которые позволяют его обнаруживать средствами аналитической химии, но этот вывод основан на явном предположении, что существует долгоживущий изотоп гассия, которому можно отнести зарегистрированные события.
Поскольку Hs может быть особенно устойчивым к альфа-распаду и спонтанному делению, он рассматривался как кандидат на существование в природе. Однако предсказывается, что этот нуклид будет очень нестабильным по отношению к бета-распаду, и любые бета-стабильные изотопы гассия, такие как Hs, будут слишком нестабильными в других каналах распада, чтобы их можно было наблюдать в природе. Поиск в 2012 году Hs в природе вместе с его гомологом осмием в лаборатории Майера-Лейбница в Гархинг, Бавария, Германия, не увенчался успехом, установлен верхний предел до его содержания в 3 × 10 граммов хассия на грамм осмия.
Различные расчеты показывают, что хассий должен быть самым тяжелым элементом группы 8 до сих пор, что согласуется с периодический закон. Его свойства в целом должны соответствовать ожидаемым для более тяжелого гомолога осмия; как и в случае всех трансактинидов, ожидается, что некоторые отклонения возникнут из-за релятивистских эффектов.
Было измерено очень мало свойств хассия или его соединений; это связано с его чрезвычайно ограниченным и дорогим производством, а также с тем, что хассий (и его родители) очень быстро разлагаются. Было измерено несколько особых свойств, связанных с химией, таких как энтальпия адсорбции четырехокиси гассия, но свойства металлического хасия остаются неизвестными и доступны только прогнозы.
 Уровни энергии крайних орбиталей атомов гассия и осмия в электронвольтах с учетом и без учета релятивистских эффектов. Обратите внимание на отсутствие спин-орбитального расщепления (и, следовательно, отсутствие различия между d 3/2 и d 5/2 орбиталями) в нерелятивистских расчетах.
Уровни энергии крайних орбиталей атомов гассия и осмия в электронвольтах с учетом и без учета релятивистских эффектов. Обратите внимание на отсутствие спин-орбитального расщепления (и, следовательно, отсутствие различия между d 3/2 и d 5/2 орбиталями) в нерелятивистских расчетах. Релятивистские эффекты на хассии должны возникать из-за высокого заряда его ядер, который заставляет электроны вокруг ядра двигаться быстрее - настолько быстро, что их скорость становится сопоставимой со скоростью света. Существует три основных эффекта: прямой релятивистский эффект, косвенный релятивистский эффект и спин-орбитальное расщепление. (Существующие расчеты не учитывают взаимодействия Брейта, но они незначительны, и их пропуск может привести только к неопределенности текущих расчетов не более чем на 2%.)
Как атомный номер увеличивается, увеличивается электростатическое притяжение между электроном и ядром. Это вызывает увеличение скорости электрона, что приводит к увеличению его массы. Это, в свою очередь, приводит к сокращению атомных орбиталей, в частности s- и p 1/2 орбиталей. Их электроны становятся более плотно прикрепленными к атому, и их труднее вырывать из ядра. Это прямой релятивистский эффект. Первоначально считалось, что она сильна только для самых внутренних электронов, но позже было установлено, что она оказывает существенное влияние и на валентные электроны.
Поскольку s и p 1/2 орбитали ближе к ядра, они берут на себя большую часть электрического заряда ядра («экранируют» его). Это оставляет меньше заряда для притяжения оставшихся электронов, орбитали которых расширяются, что облегчает их оттягивание от ядра. Это косвенный релятивистский эффект. В результате сочетания прямого и косвенного релятивистских эффектов ион Hs по сравнению с нейтральным атомом лишен 6d-электрона, а не 7s-электрона. Для сравнения, у Os отсутствует электрон 6s по сравнению с нейтральным атомом. Ионный радиус (в степени окисления +8) гассия больше, чем у осмия, из-за релятивистского расширения орбиталей 6p 3/2, которые являются крайними орбиталями для иона Hs (хотя на практике такие сильно заряженные ионы были бы слишком поляризованы в химической среде, чтобы иметь большую реальность).
Существует несколько видов электронных орбиталей, обозначаемых буквами s, p, d и f (ожидается, что g-орбитали начнутся быть химически активным среди элементов после элемента 120 ). Каждому из них соответствует азимутальное квантовое число l: s = 0, p = 1, d = 2 и f = 3. Каждому электрону также соответствует квантовое число спина s., который может равняться +1/2 или -1/2. Таким образом, квантовое число полного углового момента j = l + s равно j = l ± 1/2 (за исключением l = 0, для которого для обоих электронов на каждой орбитали j = 0 + 1 / 2 = 1/2). Спин электрона релятивистски взаимодействует со своей орбитой, и это взаимодействие приводит к разделению подоболочки на две с разными энергиями (та, что с j = l - 1/2 имеет меньшую энергию, и поэтому эти электроны труднее извлечь): например, из шести 6p-электронов два становятся 6p 1/2, а четыре становятся 6p 3/2.. Это спин-орбитальное расщепление (иногда также называемое расщеплением подоболочки или jj-связью ). Это наиболее заметно с p-электронами, которые не играют важной роли в химии гасия, но для d- и f-электронов они находятся в пределах того же порядка величины (количественно, спин-орбитальное расщепление выражается в единицах энергии, например электронвольт ).
 Плотности элементов группы 4-12, включая прогнозы для периода 7. По прогнозам, плотность калия почти в два раза выше плотности самых плотных измеренных элементов, осмия и иридия.
Плотности элементов группы 4-12, включая прогнозы для периода 7. По прогнозам, плотность калия почти в два раза выше плотности самых плотных измеренных элементов, осмия и иридия.Эти релятивистские эффекты являются ответственны за ожидаемое увеличение энергии ионизации, уменьшение сродства к электрону и повышение стабильности степени окисления +8 по сравнению с осмием; без них тенденции были бы обратными.Релятивистские эффекты уменьшают энергии атомизации соединений хассия, поскольку спин-орбитальное расщепление d-орбитали снижает энергию связи между электронами и ядром, а также потому, что релятивистские эффекты уменьшают ионный характер связи.
Предыдущие члены группы 8 имеют относительно высокие температуры плавления: Fe, 1538 ° C; Ru, 2334 ° С; Ос, 3033 ° С. Как и они, предсказано, что хассий будет твердым веществом при комнатной температуре, хотя его точка плавления точно не рассчитана. Калий должен кристаллизоваться в гексагональной плотноупакованной структуре (/ a = 1,59), аналогично его более легкому конгенеру осмию. По расчетам, чистый металлический гассий имеет модуль объемной упругости (сопротивление равномерному сжатию) 450 ГПа, что сравнимо с таковым для алмаза, 442 ГПа. Ожидается, что калий будет иметь объемную плотность 41 г / см при стандартном давлении и температуре, что является самым высоким из 118 известных элементов и почти вдвое выше самой высокой плотности элемента, наблюдаемой по сей день (22,6 г /cm).
Атомный радиус хассия ожидается около 126 пм. Из-за релятивистской стабилизации орбитали 7s и дестабилизации орбитали 6d предполагается, что ион Hs будет иметь электронную конфигурацию [Rn ] 5f 6d 7s, отдавая электрон 6d вместо электрона 7s., что противоположно поведению его более легких гомологов. Ожидается, что ион Hs будет иметь электронную конфигурацию [Rn] 5f 6d 7s, аналогичную рассчитанной для иона Os. В химических соединениях хассий рассчитывается для отображения характеристики связывания для элемента d-block, связывание которого будет в первую очередь выполняться элементами 6d 3/2 и 6d 5/2 орбиталей; по сравнению с элементами из предыдущих периодов, более важными должны быть 7s, 6p 1/2, 6p 3/2 и 7p 1/2 орбитали.
| Элемент | Стабильные степени окисления | |||||||
|---|---|---|---|---|---|---|---|---|
| железо | +6 | +3 | +2 | |||||
| рутений | +8 | +6 | +5 | +4 | +3 | +2 | ||
| осмий | +8 | +6 | +5 | +4 | +3 | +2 | ||
Калий является шестым членом 6d ряда переходных металлов и, как ожидается, будет во многом похож на металлы платиновой группы. Некоторые из этих свойств были подтверждены экспериментами по химии газовой фазы. Элементы группы 8 отражают большое разнообразие степеней окисления, но рутений и осмий легко описывают степень своего группового окисления +8; это состояние становится более стабильным в группе. Эта степень окисления встречается крайне редко: среди стабильных элементов только рутений, осмий и ксенон могут достичь его в достаточно стабильных соединениях. Ожидается, что калий будет следовать за своими сородичами и иметь стабильное состояние +8, но, как и они, он должен иметь более низкие стабильные состояния окисления, такие как +6, +4, +3 и +2. Ожидается, что калий (IV) будет более стабильным, чем хассий (VIII) в водном растворе. Калий должен быть скорее благородным металлом. Ожидается, что стандартный восстановительный потенциал для пары Hs / Hs составит 0,4 В.
Элементы группы 8 демонстрируют отличительный химический состав оксида . Все более легкие члены имеют известные или гипотетические тетроксиды, MO 4. Их окислительная способность уменьшается по мере спуска по группе. FeO 4 неизвестен из-за его необычайно большого сродства к электрону - количества энергии, высвобождаемой, когда электрон присоединяется к нейтральному атому или молекуле с образованием отрицательного иона, - что приводит к образованию ямы. известный оксианион феррат (VI), FeO. 4.тетроксид рутения, RuO 4, который образуется при окислении рутения (VI) в кислоте, легко подвергается восстановлению до рутената (VI), RuO. 4. При окислении металлического рутения на воздухе образуется диоксид RuO 2. Напротив, осмий сгорает с образованием стабильного тетроксида, OsO 4, который образует комплекс с гидроксид-ионом с образованием комплекса осмия (VIII) -ат, [OsO 4 (OH) 2 ]. Следовательно, хассий должен вести себя как более тяжелый гомолог осмия, образуя стабильный, очень летучий тетроксид HsO 4, который подвергается комплексообразованию с гидроксидом с образованием хассата (VIII), [HsO 4 (OH) 2 ]. Тетроксид рутения и четырехокись осмия являются летучими из-за их симметричной тетраэдрической геометрии молекулы и потому, что они заряжены нейтрально; Тетроксид хассия также должен быть очень летучим твердым веществом. Экспериментально известно, что тенденция летучести тетроксидов группы 8 составляет RuO 4< OsO4>HsO 4, что подтверждает результаты расчетов. В частности, рассчитанные энтальпии адсорбции - энергия, необходимая для адгезии атомов, молекул или ионов из газа, жидкости или растворенного твердого вещества к a поверхность - HsO 4, - (45,4 ± 1) кДж / моль на кварце, очень хорошо согласуется с экспериментальным значением - (46 ± 2) кДж / моль
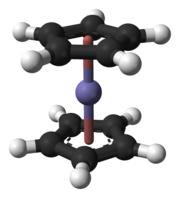 В ферроцене циклопентадиенильные кольца находятся в ступенчатой конформации.
В ферроцене циклопентадиенильные кольца находятся в ступенчатой конформации.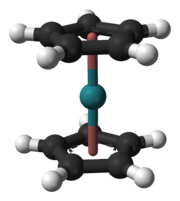 В рутеноцене и осмоцен, циклопентадиенильные кольца находятся в закрытой конформации. Предполагается, что хассоцен имеет такую структуру.
В рутеноцене и осмоцен, циклопентадиенильные кольца находятся в закрытой конформации. Предполагается, что хассоцен имеет такую структуру. Первой целью химических исследований было образование четырехокиси; он был выбран потому, что рутений и осмий образуют летучие тетроксиды, являющиеся единственными переходными металлами, которые демонстрируют стабильное соединение в степени окисления +8. Несмотря на то, что выбор для газофазных химических исследований был очевиден с самого начала, химическая характеристика хассия долгое время считалась сложной задачей. Хотя изотопы хассия были впервые синтезированы в 1984 году, только в 1996 году изотоп хассия, достаточно долгоживущий, был синтезирован для проведения химических исследований. К сожалению, этот изотоп хассия, Hs, был синтезирован косвенно из распада Cn; не только методы непрямого синтеза не подходят для химических исследований, но и реакция, в результате которой был получен изотоп Cn, имела низкий выход - его поперечное сечение составляло всего 1 pb - и, таким образом, не обеспечивала достаточного количества атомов гассия для химического расследование. Прямой синтез Hs и Hs в реакции Cm (Mg, xn) Hs (x = 4 или 5) оказался более перспективным, поскольку сечение этой реакции было несколько больше при 7 pb. Этот выход все еще был примерно в десять раз ниже, чем выход реакции, использованной для химической характеристики бория. Прежде чем хассий можно было успешно охарактеризовать химически, необходимо было внедрить новые методы облучения, разделения и обнаружения.
Рутений и осмий имеют очень похожий химический состав из-за сокращения лантаноидов, но железо показывает некоторые различия от них; например, хотя рутений и осмий образуют стабильные тетроксиды, в которых металл находится в степени окисления +8, железо - нет. При подготовке к химическому описанию хассия, исследования были сосредоточены на рутении и осмии, а не на железе, потому что ожидалось, что хассий будет похож на рутений и осмий, поскольку предсказанные данные по хасию близко совпадают с данными этих двух.
Первые химические эксперименты были выполнены с использованием газовой термохроматографии в 2001 году с использованием синтетических радиоизотопов осмия Os и Os в качестве эталона. В ходе эксперимента было синтезировано семь атомов хассия с использованием реакций Cm (Mg, 5n) Hs и Cm (Mg, 4n) Hs. Затем они были термализованы и окислены в смеси газов гелия и кислорода с образованием молекул четырехокиси гассия.
Измеренная температура осаждения Четырехокись хассия была выше, чем четырехокись осмия, что указывало на то, что первый был менее летучим, и это надежно помещало хасий в группу 8. Измеренная энтальпия адсорбции для HsO 4 составила -46 ± 2 кДж / моль, было значительно ниже прогнозируемого значения, -36,7 ± 1,5 кДж / моль, что указывает на то, что OsO 4 более летуч, чем HsO 4, что противоречит более ранним расчетам, согласно которым подразумевается, что у них должна быть очень похожая волатильность. Для сравнения значение OsO 4 составляет -39 ± 1 кДж / моль. (Расчеты, которые дали более точное соответствие экспериментальным данным, были сделаны после эксперимента в 2008 году.) Возможно, четырехокись гассия по-другому взаимодействует с нитридом кремния, чем с диоксидом кремния, химическими веществами. используется для детектора; необходимы дальнейшие исследования, чтобы установить, существует ли разница между такими взаимодействиями и повлияла ли она на измерения. Такие исследования могли бы включать более точные измерения ядерных свойств Hs и сравнения с RuO 4 в дополнение к OsO 4.
. В 2004 году ученые вступили в реакцию четырехокиси гассия и гидроксида натрия с образованием хасата натрия (VIII), a хорошо известная реакция с осмием. Это была первая кислотно-основная реакция с соединением хассия с образованием гассата натрия (VIII):
Команда из Университета Майнца планировала в 2008 году изучить электроосаждение атомов гассия с использованием новой установки TASCA в GSI. Их целью было использование реакции Ra (Ca, 4n) Hs. Ученые из GSI надеялись использовать TASCA для изучения синтеза и свойств соединения гассия (II) гассоцена, Hs (C5H5 )2), используя реакцию Ra (Ca, xn). Это соединение аналогично более легким соединениям ферроцен, рутеноцен и осмоцен, и ожидается, что два циклопентадиенильных кольца будут находиться в затменной конформации, такой как рутеноцен и осмоцен, а не в ступенчатая конформация как у ферроцена. Хассоцен, который, как ожидается, будет стабильным и высоколетучим соединением, был выбран, потому что он имеет хассий в низкой формальной степени окисления +2, хотя связь между металлом и кольцами в основном ковалентный в металлоценах - в отличие от состояния с высоким +8, которое ранее было исследовано, и релятивистские эффекты, как ожидалось, будут сильнее в более низком состоянии окисления. Высокосимметричная структура гассоцена и его небольшое количество атомов облегчают релятивистские вычисления. По состоянию на 2019 год o экспериментальные отчеты о хассоцене.