 | |
 | |
 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Трифенилфосфан | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.009.124 |
| Номер EC |
|
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C18H15P |
| Молярная масса | 262,292 г · моль |
| Внешний вид | Белое твердое вещество |
| Плотность | 1,1 г см, твердое вещество |
| Точка плавления | 80 ° C (176 ° F; 353 K) |
| Точка кипения | 377 ° C (711 ° F; 650 K) |
| Растворимость в воде | Нерастворимый |
| Растворимость | в органических растворителях |
| Кислотность (pK a) | 7,64 (pK a конъюгированной кислоты в ацетонитриле) |
| Магнитная восприимчивость (χ) | -166,8 · 10 см / моль |
| Показатель преломления (nD) | 1,59; εr и т. Д. |
| Структура | |
| Молекулярная форма | Пирамидальная |
| Дипольный момент | 1,4 - 1,44 D |
| Опасности | |
| Паспорт безопасности | JT Baker |
| ЕС классификация (DSD) (устарело) | Не указано |
| R-фразы (устарело) | R20 R22 R40 R43 R50 R53 |
| S-фразы (устаревшие) | S36 S37 S45 S57 S60 |
| NFPA 704 (огненный алмаз) |  1 2 2 1 2 2 |
| Температура вспышки | 180 ° C (356 ° F; 453 K) |
| Родственные соединения | |
| Родственные третичные фосфины | Триметилфосфин. Фосфин |
| Родственные соединения | Трифениламин. Трифениларсин. Оксид трифенилфосфина. Сульфид трифенилфосфина. Дихлорид трифенилфосфина. Селенид трифенилфосфина, Pd (PPh 3)4 |
| Если не указано иное, данные приведены материалы в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Трифенилфосфин (название IUPAC: трифенилфосфан ) является обычным фосфорорганическое соединение с формулой P (C 6H5)3- часто сокращенно P Ph3 или Ph 3 P. Он широко используется в синтезе органических и металлоорганических соединений. PPh 3 существует в виде относительно устойчивых на воздухе бесцветных кристаллов при комнатной температуре. Растворяется в неполярных органических растворителях, таких как бензол и диэтиловый эфир.
Трифенилфосфин можно получить в лаборатории путем обработки трихлорид фосфора с бромидом фенилмагния или фениллитием. Промышленный синтез включает реакцию между трихлоридом фосфора, хлорбензолом и натрием :
Трифенилфосфин кристаллизуется в триклинной и моноклинной модификации. В обоих случаях молекула принимает пирамидальную структуру с пропеллероподобным расположением трех фенильных групп.
Трифенилфосфин подвергается медленному окислению воздухом с образованием оксида трифенилфосфина, Ph 3 PO:
Эта примесь может быть удалена перекристаллизацией PPh 3 из горячего этанол или горячий изопропанол. Этот метод основан на том факте, что OPPh 3 более полярен и, следовательно, более растворим в полярных растворителях, чем PPh 3.
Трифенилфосфин извлекает серу из полисульфидных соединений, эписульфидов. и элементарная сера. Однако простые сероорганические соединения, такие как тиолы и тиоэфиры, не реагируют. Фосфорсодержащим продуктом является сульфид трифенилфосфина, Ph 3 PS. Эту реакцию можно использовать для определения «лабильного» содержания S в образце, например, вулканизированной резине. Селенид трифенилфосфина, Ph 3 PSe, может быть легко получен обработкой PPh 3 красным (альфа-моноклинным) Se. Соли селеноцианата, SeCN, используются в качестве источника Se. PPh 3 может также образовывать аддукт с Te, хотя этот аддукт в основном существует как (Ph 3P)2Te, а не PPh 3 Te.
Арил азиды реагируют с PPh 3 с образованием фосфаниминов, аналогов OPPh 3, посредством реакции Штаудингера. Иллюстративным примером является получение трифенилфосфинфенилимида :
Фосфанимин может быть гидролизован до амина. Обычно промежуточный фосфанимин не выделяется.
Cl2присоединяется к PPh 3 с получением трифенилфосфиндихлорида ([PPh 3 Cl] Cl), который существует в виде чувствительного к влаге фосфония галогенид. Этот реагент используется для превращения спиртов в алкилхлориды в органическом синтезе. Бис (трифенилфосфин) хлорид иминия ( PPNCl, формула [(C 6H5)3P)2N] Cl получают из трифенилфосфин дихлорида:
PPh 3 - слабое основание. Он образует выделяемые соли с сильными кислотами, такими как HBr. Продукт содержит катион фосфония [HPPh 3 ].
PPh 3 представляет собой пирамидальную форму с хиральным пропеллероподобным расположением трех фенильных колец. Жесткость PPh 3 способствует легкости кристаллизации его производных.
PPh 3 широко используется в органическом синтезе. Свойства, которые определяют его использование, - это его нуклеофильность и его восстанавливающий характер. На нуклеофильность PPh 3 указывает его реакционная способность по отношению к электрофильным алкенам, таким как акцепторы Михаэля, и алкилгалогенидам. Он также используется в синтезе биарильных соединений, таких как реакция Сузуки.
PPh 3 соединяется с алкилгалогенидами с получением соли фосфония. Легкость реакции кватернизации следует обычной схеме, при которой бензильные и аллильные галогениды являются особенно эффективными реагентами:
Эти соли, которые часто могут быть выделены в виде кристаллических твердых веществ, реагируют с сильными основаниями с образованием илидов :
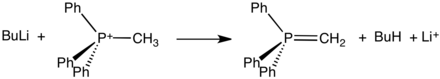
Такие илиды являются ключевыми реагентами в реакциях Виттига, используемых для преобразования альдегидов и кетоны в алкены.
Арилгалогениды будут кватернизовать PPh 3 с образованием солей тетрафенилфосфония :
Однако реакция требует повышенных температур и металлических катализаторов.
В реакции Мицунобу смесь трифенилфосфина и диизопропилазодикарбоксилата («DIAD» или его диэтиловый аналог, DEAD) превращает спирт и карбоновую кислоту в сложный эфир. DIAD восстанавливается, поскольку он служит акцептором водорода, а PPh 3 окисляется до OPPh 3.
В реакции Аппеля смесь PPh 3 и CX 4 (X = Cl, Br) используется для превращения спиртов в алкилгалогениды. Оксид трифенилфосфина (OPPh 3) является побочным продуктом.
Эта реакция начинается с нуклеофильной атаки PPh 3 на CBr 4, что является продолжением реакции кватернизации, указанной выше.
Легкая оксигенация PPh 3 используется для деоксигенации органических пероксидов, что обычно происходит с сохранением конфигурации:
Он также используется для разложения органических озонидов на кетоны и альдегиды, хотя диметилсульфид более популярен для реакции в качестве побочного продукта, диметилсульфоксид легче отделяется от реакционной смеси, чем оксид трифенилфосфина. Ароматические N-оксиды восстанавливаются до соответствующего амина с высоким выходом при комнатной температуре с помощью облучения:

Сульфирование PPh 3 дает трис (3- сульфофенил) фосфин, P (C 6H4-3-SO 3)3(TPPTS ), обычно выделяемый в виде тринатриевой соли. В отличие от PPh 3, TPPTS является водорастворимым, как и его металлические производные. Комплексы родия TPPTS используются в некоторых промышленных реакциях гидроформилирования.
 3,3 ', 3 ″ -тринатриевая соль 3,3', 3 ″ -фосфанетриилтрис (бензолсульфоновой кислоты) представляет собой водорастворимое производное трифенилфосфина.
3,3 ', 3 ″ -тринатриевая соль 3,3', 3 ″ -фосфанетриилтрис (бензолсульфоновой кислоты) представляет собой водорастворимое производное трифенилфосфина. лития в THF, а также Na или K реагируют с PPh 3 с получением Ph2PM (M = Li, Na, K). Эти соли являются универсальными предшественниками третичных фосфинов. Например, 1,2-дибромэтан и Ph 2 PM реагируют с образованием Ph2PCH 2CH2PPh 2. Слабые кислоты, такие как хлорид аммония, превращают Ph 2 PM (M = Li, Na, K) в дифенилфосфин :
Трифенилфосфин хорошо связывается с большинством переходных металлов, особенно с металлами средних и поздних переходов групп 7–10. Что касается стерического объема, PPh 3 имеет угол конуса Толмена , равный 145 °, что является промежуточным между значениями P (C 6H11)3(170 °) и P (CH 3)3(115 °). В раннем применении гомогенного катализа, NiBr 2 (PPh 3)2использовался Уолтер Реппе для синтеза акрилата сложные эфиры алкинов, окиси углерода и спиртов. Использование PPh 3 стало популярным благодаря его использованию в гидроформилировании. катализатор RhH (PPh 3)3(CO).
Полимерные аналоги PPh 3 представляют собой известно, что полистирол модифицируется группами PPh 2 в параграфе позиция. Такие полимеры могут быть использованы во многих областях применения PPh 3 с тем преимуществом, что полимер, будучи нерастворимым, может быть отделен от продуктов простой фильтрацией реакционных суспензий. Такие полимеры получают обработкой 4-литиофенилзамещенного полистирола хлордифенилфосфином (PPh 2 Cl).