| Радон | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | |||||||||||||||||||||||||||||||||
| Внешний вид | бесцветный газ | |||||||||||||||||||||||||||||||||
| Массовое число | [222] | |||||||||||||||||||||||||||||||||
| Радон в периодической таблице | ||||||||||||||||||||||||||||||||||
Радон - это химический элемент с символом Rnи атомным номером 86. Это радиоактивный, бесцветный, без запаха, без вкуса благородный газ. Это происходит естественным образом в ничтожных количествах как промежуточный этап в обычных цепочках радиоактивного распада, через которые торий и уран медленно распадаются на свинец и различные другие короткоживущие радиоактивные элементы. Сам радон является непосредственным продуктом распада радия. Его наиболее стабильный изотоп , Rn имеет период полураспада всего 3,8 дня, что делает его одним из самых редких элементов. Поскольку торий и уран являются двумя наиболее распространенными радиоактивными элементами на Земле, а также имеют три изотопа с периодом полураспада порядка нескольких миллиардов лет, радон будет присутствовать на Земле еще долго, несмотря на его короткий период полураспада. При распаде радона образуется множество других короткоживущих нуклидов, известных как дочерние элементы радона, которые заканчиваются стабильными изотопами свинца. В отличие от всех других промежуточных элементов в вышеупомянутых цепочках распада, радон находится под в стандартных условиях, газообразный и легко вдыхаемый, поэтому опасен для здоровья. Часто это единственный самый большой вклад в дозу фонового излучения человека, но из-за местных различий в геологии уровень воздействия газообразного радона отличается от места к месту. Обычный источник - урансодержащие минералы в земле. Из-за своей плотности он может особенно накапливаться в подземных областях, таких как подвалы. Радон также может присутствовать в некоторых грунтовых водах, таких как родниковые воды и горячие источники. Эпидемиологические исследования показали четкую связь между вдыханием высоких концентраций радона и заболеваемостью раком легких. Радон - это загрязнитель, который влияет на качество воздуха в помещениях во всем мире. Согласно Агентству по охране окружающей среды США (EPA), радон является второй по частоте причиной рака легких после курения сигарет, вызывая 21000 смертей от рака легких в год в США. Около 2900 из этих смертей происходят среди людей, которые никогда не курили. Хотя радон является второй наиболее частой причиной рака легких, по оценкам Агентства по охране окружающей среды, он является причиной номер один среди некурящих. Существуют значительные неопределенности в отношении воздействия на здоровье малых доз облучения. В отличие от самого газообразного радона дочерние компоненты радона представляют собой твердые частицы и прилипают к поверхностям, таким как частицы пыли в воздухе, что может вызвать рак легких при вдыхании. Содержание
Характеристики  Спектр излучения радон, сфотографированный Эрнестом Резерфордом в 1908 году. Числа сбоку от спектра - это длины волн. Средний спектр - это излучение радия (радон), а два внешних - гелий (добавлено для калибровки длин волн). Спектр излучения радон, сфотографированный Эрнестом Резерфордом в 1908 году. Числа сбоку от спектра - это длины волн. Средний спектр - это излучение радия (радон), а два внешних - гелий (добавлено для калибровки длин волн). Физические свойстваРадон - бесцветный, без запаха, и безвкусный газ, и поэтому не может быть обнаружен только человеческими органами чувств. При стандартной температуре и давлении радон образует одноатомный газ с плотностью 9,73 кг / м, что примерно в 8 раз превышает плотность атмосферы Земли на уровне моря., 1,217 кг / м. Радон - один из самых плотных газов при комнатной температуре и самый плотный из благородных газов. Несмотря на то, что при стандартной температуре и давлении он бесцветен, при охлаждении ниже его точки замерзания 202 К (-71 ° C; -96 ° F) радон излучает яркую радиолюминесценцию, которая меняется с желтой до оранжево-красного при понижении температуры. При конденсации радон светится из-за мощного излучения, которое он производит. Радон умеренно растворим в воде, но более растворим, чем более легкие благородные газы. Радон значительно более растворим в органических жидкостях, чем в воде. Уравнение растворимости радона выглядит следующим образом: χ = exp (B / T - A), χ: молярная доля, T: абсолютная температура, A, B: константы растворителя. Химические свойстваРадон является членом элементов с нулевой- валентностью, которые называются благородными газами, и химически не очень реакционноспособен. Период полураспада радона-222 составляет 3,8 дня, что делает его полезным в физических науках в качестве естественного индикатора . Поскольку радон в стандартных условиях является газом, в отличие от его родительских цепочек распада, он может быть легко извлечен из них для исследований. Он инертен для большинства обычных химических реакций, таких как горение, так как внешняя валентная оболочка содержит восемь электронов. Это создает стабильную конфигурацию с минимальной энергией, в которой внешние электроны тесно связаны. Его первая энергия ионизации - минимальная энергия, необходимая для извлечения из него одного электрона - составляет 1037 кДж / моль. В соответствии с периодическими тенденциями радон имеет более низкую электроотрицательность, чем элемент за один период до него, ксенон, и поэтому является более реактивным. Ранние исследования пришли к выводу, что стабильность радона гидрата должна быть того же порядка, что и у гидратов хлора (Cl. 2) или диоксида серы ( SO. 2) и значительно выше, чем стабильность гидрата сероводорода (H. 2S). Из-за его стоимости и радиоактивности экспериментальные химические исследования редко проводятся с радоном, и в результате очень мало сообщенных соединений радона, все либо фториды, либо оксиды. Радон может быть окислен мощными окислителями, такими как фтор, с образованием дифторида радона (RnF. 2). Он разлагается обратно на свои элементы при температуре выше 523 K (250 ° C; 482 ° F) и восстанавливается водой до газообразного радона и фтористого водорода: он также может быть восстановлен до своих элементов водородом газ. Он имеет низкую волатильность и считается RnF. 2. Из-за короткого периода полураспада радона и радиоактивности его соединений невозможно детально изучить это соединение. Теоретические исследования этой молекулы предсказывают, что у нее должно быть расстояние связи Rn – F , равное 2,08 ангстрема (Å), и что это соединение термодинамически более стабильно и менее летучо, чем его более легкий аналог. дифторид ксенона (XeF. 2). Было предсказано, что октаэдрическая молекула RnF. 6имеет еще более низкую энтальпию образования, чем дифторид. Считается, что ион [RnF] образуется в результате следующей реакции:
По этой причине пентафторид сурьмы вместе с трифторидом хлора и N. 2F. 2Sb. 2F. 11рассматривались для Удаление газообразного радона на урановых рудниках за счет образования радон-фторсодержащих соединений. Соединения радона могут образовываться в результате распада радия в галогенидах радия, реакции, которая использовалась для уменьшения количества радона, улетучивающегося из целей во время облучения. Кроме того, известны соли катиона [RnF] с анионами SbF. 6, TaF. 6и BiF. 6. Радон также окисляется дифторидом кислорода до RnF. 2при 173 K (-100 ° C; -148 ° F). Оксиды радона входят в число немногих других известных соединения радона ; подтвержден только триоксид (RnO. 3). Заявлены высшие фториды RnF. 4и RnF. 6, которые, по расчетам, являются стабильными, но сомнительно, что они еще были синтезированы. Они могли наблюдаться в экспериментах, где неизвестные радоносодержащие продукты перегоняли вместе с гексафторидом ксенона : это могли быть RnF. 4, RnF. 6или оба. Нагревание радона в следовых количествах с ксеноном, фтором, пентафторидом брома и либо фторидом натрия, либо фторидом никеля, как утверждается, дает также более высокий фторид, который гидролизуется с образованием RnO. 3. Хотя было высказано предположение, что эти утверждения действительно были вызваны осаждением радона в виде твердого комплекса [RnF]. 2[NiF 6 ], тот факт, что радон совместно осаждается из водный раствор с CsXeO. 3F был принят как подтверждение образования RnO. 3, что подтверждено дальнейшими исследованиями гидролизованного раствора. То, что [RnO 3 F] не образовывалось в других экспериментах, могло быть связано с высокой концентрацией используемого фторида. Исследования электромиграции также предполагают присутствие катионных [HRnO 3 ] и анионных [HRnO 4 ] форм радона в слабокислых водном растворе. (pH>5), процедура была ранее подтверждена исследованием гомологичного триоксида ксенона. Вероятно, что трудность в идентификации высших фторидов радона связана с тем, что радону кинетически препятствует окисление сверх двухвалентного состояние из-за сильной ионности дифторида радона (RnF. 2) и высокого положительного заряда радона в RnF; пространственное разделение молекул RnF 2 может быть необходимо для четкой идентификации высших фторидов радона, из которых RnF. 4, как ожидается, будет более стабильным, чем RnF. 6из-за спин-орбитального расщепление 6p-оболочки радона (Rn будет иметь конфигурацию с замкнутой оболочкой 6s. 6p. 1/2). Следовательно, хотя RnF. 4должен иметь стабильность, аналогичную тетрафториду ксенона (XeF. 4), RnF. 6, вероятно, будет намного менее стабильным, чем гексафторид ксенона (XeF. 6): гексафторид радона также, вероятно, будет правильной октаэдрической молекулой, в отличие от искаженной октаэдрической структуры XeF. 6из-за эффекта инертной пары. Экстраполяция на группу благородных газов также предполагает возможное существование RnO, RnO 2 и RnOF 4, а также первых химически стабильных хлоридов благородных газов RnCl 2 и RnCl 4, но ни один из них еще не обнаружен. Радон карбонил (RnCO) был предсказан как стабильный и имеющий линейная молекулярная геометрия. Было обнаружено, что молекулы Rn. 2и RnXe в значительной степени стабилизированы спин-орбитальной связью. Радон, заключенный внутри фуллерена, был предложен в качестве лекарственного средства для опухолей. Несмотря на существование Xe (VIII), никаких соединений Rn (VIII) не заявлено; RnF 8 должен быть очень нестабильным химически (XeF 8 термодинамически нестабилен). Предполагается, что наиболее стабильным соединением Rn (VIII) будет перрадонат бария (Ba 2 RnO 6), аналогичный перксенату бария. Нестабильность Rn (VIII) обусловлена релятивистской стабилизацией оболочки 6s, также известной как эффект инертной пары. Радон реагирует с жидкими фторидами галогенов ClF, ClF 3, ClF 5, BrF 3, BrF 5 и IF 7 для образования RnF 2. В растворе фторида галогена радон нелетуч и существует в виде катионов RnF и Rn; добавление фторид-анионов приводит к образованию комплексов RnF. 3и RnF. 4, параллельно химическому составу бериллия (II) и алюминия (III). Стандартный электродный потенциал пары Rn / Rn был оценен как +2,0 В, хотя нет никаких доказательств образования стабильных ионов или соединений радона в водном растворе. Изотопы Радий или уран серии Радий или уран серии Радон не содержит стабильных изотопов. Было охарактеризовано тридцать девять радиоактивных изотопов с атомными массами в диапазоне от 193 до 231. Наиболее стабильным изотопом является Rn, который является продуктом распада Ra, продуктом распада У. Незначительное количество (крайне нестабильного) изотопа Rn также находится среди дочерей Rn. Три других изотопа радона имеют период полураспада более часа: Rn, Rn и Rn. Изотоп Rn - это естественный продукт распада наиболее стабильного изотопа тория (Th), который обычно называют тороном. Он имеет период полураспада 55,6 секунды и также испускает альфа-излучение. Точно так же Rn получают из наиболее стабильного изотопа актиния (Ac), называемого «актиноном», и является альфа-излучателем с периодом полураспада 3,96 секунды. В серии распада нептуний (Np) изотопы радона существенно не встречаются, хотя образуется следовое количество (чрезвычайно нестабильного) изотопа Rn. ДочериRn принадлежит к цепочке распада радия и урана-238, и его период полураспада составляет 3,8235 дней. Его четыре первых продукта (исключая схемы предельного распада ) очень недолговечны, а это означает, что соответствующие распады указывают на начальное распределение радона. Его распад происходит в следующей последовательности:
Фактор равновесия радона - это соотношение между активностью всех короткопериодических дочерних продуктов радона (которые ответственны за большинство биологических эффектов радона) и активностью, которая будет находиться в равновесии с родителем радона. Если замкнутый объем постоянно снабжается радоном, концентрация короткоживущих изотопов будет увеличиваться до тех пор, пока не будет достигнуто равновесие, при котором скорость распада каждого продукта распада будет равна скорости распада самого радона. Фактор равновесия равен 1, когда обе активности равны, что означает, что продукты распада оставались близкими к родительскому радону достаточно долго для достижения равновесия в течение нескольких часов. В этих условиях каждый дополнительный пКи / л радона увеличивает экспозицию на 0,01 рабочий уровень (WL, показатель радиоактивности, обычно используемый в горнодобывающей промышленности). Эти условия не всегда соблюдаются; во многих домах коэффициент равновесия обычно составляет 40%; то есть на каждый пКи / л радона в воздухе будет 0,004 WL дочерей. Pb требуется гораздо больше времени (десятилетия), чтобы прийти в равновесие с радоном, но, если окружающая среда допускает накопление пыли в течение продолжительных периодов времени, Pb и продукты его распада также могут влиять на общий уровень радиации. Из-за своего электростатического заряда дочерние продукты радона прилипают к поверхностям или частицам пыли, тогда как газообразный радон - нет. Прикрепление удаляет их из воздуха, что обычно приводит к тому, что коэффициент равновесия в атмосфере становится меньше 1. Фактор равновесия также снижается за счет циркуляции воздуха или устройств фильтрации воздуха и увеличивается из-за переносимых по воздуху частиц пыли, включая сигаретный дым. Фактор равновесия, обнаруженный в эпидемиологических исследованиях, равен 0,4. История и этимология 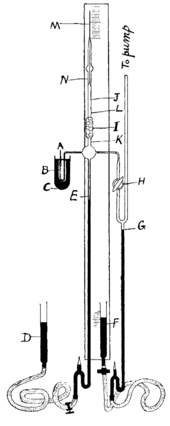 Аппарат, использованный Рамзи и Уитлоу-Греем для выделения радона. M представляет собой капиллярную трубку, из которой изолированы приблизительно 0,1 мм. Радон в смеси с водородом поступал в откачанную систему через сифон A ; ртуть показана черным. Аппарат, использованный Рамзи и Уитлоу-Греем для выделения радона. M представляет собой капиллярную трубку, из которой изолированы приблизительно 0,1 мм. Радон в смеси с водородом поступал в откачанную систему через сифон A ; ртуть показана черным. Радон был пятым радиоактивным элементом, открытым в 1899 году Эрнестом Резерфордом и Робертом Б. Оуэнсом из Университета Макгилла в Монреале после урана, тория, радия и полония. В 1899 году Пьер и Мария Кюри заметили, что газ, испускаемый радием, оставался радиоактивным в течение месяца. Позже в том же году Резерфорд и Оуэнс заметили различия при попытке измерить излучение оксида тория. Резерфорд заметил, что соединения тория непрерывно испускают радиоактивный газ, который остается радиоактивным в течение нескольких минут, и назвал этот газ «эманацией» (от латинского : emanare, вытекать, и emanatio, истечение), а затем «эманация тория» («Th Em»). В 1900 году Фридрих Эрнст Дорн сообщил о некоторых экспериментах, в которых он заметил, что соединения радия испускают радиоактивный газ, который он назвал «излучением радия» («Ра Эм»). В 1901 году Резерфорд и Гарриет Брукс продемонстрировали, что эманации радиоактивны, но приписали Кюри открытие элемента. В 1903 году подобные эманации актиния наблюдал Андре-Луи Дебьерн и был назван «эманацией актиния» («Ac Em»). Вскоре для трех эманаций было предложено несколько сокращенных названий: exradio, exthorio и excinio в 1904 году; радон (Ro), торон (To) и актон или актон (Ao) в 1918 г.; radeon, thoreon и actineon в 1919 г. и, наконец, радон, торон и актинон в 1920 г. (Название радон не связано с именем австрийского математика Иоганна Радона.) Сходство с спектры этих трех газов вместе со спектрами аргона, криптона и ксенона, а также наблюдаемая химическая инерция позволили сэру Уильяму Рамзи предположить в 1904 году, что «эманации» могут содержать новый элемент благородного происхождения. -газовая семья. В начале 20 века в США золото, загрязненное дочерним радоном Pb, проникло в ювелирную промышленность. Это были семена золота, содержащие Rn, который расплавился после распада радона. В 1909 году Рамзи и Роберт Уитлоу-Грей выделили радон и определили его температуру плавления и приблизительную плотность. В 1910 году они определили, что это самый тяжелый из известных газов. Они написали, что «L'expression l'émanation du radium est fort incmode» («выражение« эманация радия »очень неудобно») и предложили новое название нитон (Nt) (от латинского : nitens, сияющий), чтобы подчеркнуть свойство радиолюминесценции, и в 1912 году он был принят Международной комиссией по атомным весам. В 1923 году Международный комитет по химическим элементам и Международный союз чистой и прикладной химии (IUPAC) выбрали среди названий радон (Rn), торон (Tn) и актинон (An). Позже, когда изотопы были пронумерованы, а не названы, элемент получил название наиболее стабильного изотопа, радона, в то время как Tn был переименован в Rn, а An был переименован в Rn, что вызвало некоторую путаницу в литературе относительно его свойств. Открытие, поскольку, хотя Дорн открыл изотоп радон, он не был первым, кто открыл элемент радон. Еще в 1960-х годах этот элемент также назывался просто эманацией. Первое синтезированное соединение радона, фторид радона, было получено в 1962 году. Даже сегодня слово радон может относиться либо к элементу, либо к его изотопу Rn, а торон остается в использовании в качестве краткого названия Rn, чтобы устранить эту двусмысленность. Название актинон для Rn сегодня встречается редко, вероятно, из-за короткого периода полураспада этого изотопа. Опасность сильного облучения радоном в шахтах, где облучение может достигать 1000000 Бк / м, давно известно. В 1530 году Парацельс описал истощающую болезнь шахтеров, mala Metallorum, и Георг Агрикола рекомендовал вентиляцию шахт, чтобы избежать этой горной болезни (Bergsucht). В 1879 году Хартинг и Гессе определили это заболевание как рак легких в ходе исследования шахтеров из Шнеберга, Германия. Первые крупные исследования радона и здоровья были проведены в контексте добычи урана в районе Иоахимсталь в Богемии. В США исследования и меры по смягчению последствий наблюдались только за десятилетиями воздействия на здоровье уранодобытчиков юго-запада США, занятых в начале холодной войны ; стандарты не применялись до 1971 года. Присутствие радона в воздухе помещений было задокументировано еще в 1950 году. Начиная с 1970-х годов, были начаты исследования по изучению источников радона в помещениях, детерминант концентрации, воздействия на здоровье и подходы к смягчению последствий. В США проблема радона в помещениях получила широкую огласку и усиленное расследование после широко разрекламированного инцидента в 1984 году. Во время обычного мониторинга на атомной электростанции в Пенсильвании было обнаружено, что рабочий был заражен радиоактивностью. Впоследствии причиной этого была признана высокая концентрация радона в его доме. Возникновение Единицы концентрации Pb образуется в результате распада Rn. Вот типичная скорость осаждения Pb, наблюдаемая в Японии, как функция времени из-за изменений в концентрации радона. Pb образуется в результате распада Rn. Вот типичная скорость осаждения Pb, наблюдаемая в Японии, как функция времени из-за изменений в концентрации радона. Все обсуждения концентраций радона в окружающей среде относятся к Rn. Хотя средняя скорость образования Rn (из серии распада тория) примерно такая же, как и у Rn, количество Rn в окружающей среде намного меньше, чем у Rn из-за короткого периода полураспада Rn (55 секунд, по сравнению с 3,8 днями соответственно). Концентрация радона в атмосфере обычно измеряется в беккерелях на кубический метр (Бк / м), производной единице СИ. Другая единица измерения, распространенная в США, - пикокюри на литр (пКи / л); 1 пКи / л = 37 Бк / м. Типичное внутреннее воздействие в среднем составляет около 48 Бк / м в помещении, хотя это значение сильно различается, и 15 Бк / м на открытом воздухе. В горнодобывающей промышленности воздействие традиционно измеряется на рабочем уровне (WL), а также совокупное воздействие в месяц рабочего уровня (WLM); 1 WL соответствует любой комбинации короткоживущих дочерних Rn (Po, Pb, Bi и Po) в 1 литре воздуха, который выделяет 1,3 × 10 МэВ потенциальной альфа-энергии; 1 WL эквивалентен 2,08 × 10 джоулей на кубический метр воздуха (Дж / м). Единица кумулятивного воздействия в системе СИ выражается в джоуль-часах на кубический метр (Дж · ч / м). Один WLM эквивалентен 3,6 × 10 Дж · ч / м. Воздействие 1 WL на 1 рабочий месяц (170 часов) равняется 1 WLM кумулятивному воздействию. Кумулятивное воздействие 1 WLM примерно эквивалентно проживанию в течение одного года в атмосфере с концентрацией радона 230 Бк / м. Rn распадается на Pb и другие радиоизотопы. Уровни Pb можно измерить. Скорость осаждения этого радиоизотопа зависит от погоды. Концентрации радона, обнаруженные в естественной среде, слишком низкие, чтобы их можно было обнаружить химическими методами. Концентрация 1000 Бк / м (относительно высокая) соответствует 0,17 пикограмм на кубический метр (пг / м). Средняя концентрация радона в атмосфере составляет около 6 × 10 молярных процентов, или около 150 атомов в каждом миллилитре воздуха. Радоновая активность всей атмосферы Земли возникает только из нескольких десятков граммов радона, которые постоянно замещаются распадом большего количества радия, тория и урана. Естественная концентрация радона рядом с ураном шахта концентрация радона рядом с ураном шахта Радон образуется в результате радиоактивного распада радия-226, который содержится в урановых рудах, фосфатных породах, сланцах, магматических и метаморфических породах, таких как гранит, гнейс и сланец, и, в меньшей степени, в обычных породах например, известняк. Каждая квадратная миля поверхностного слоя почвы на глубине от 6 дюймов (от 2,6 км до глубины 15 см) содержит примерно 1 грамм радия, который в небольших количествах выделяет радон в атмосферу. В глобальном масштабе, по оценкам, 2,4 миллиарда кюри (90 ЭБк) радона ежегодно выделяется из почвы. Концентрация радона может сильно различаться от места к месту. На открытом воздухе она колеблется от 1 до 100 Бк / м, а над океаном еще меньше (0,1 Бк / м). В пещерах, вентилируемых шахтах или плохо вентилируемых домах его концентрация достигает 20–2 000 Бк / м. Концентрация радона может быть намного выше при добыче полезных ископаемых. Нормы вентиляции предписывают поддерживать концентрацию радона в урановых рудниках ниже «рабочего уровня», с 95-м процентилем в диапазоне почти до 3 WL (546 пКи Rn на литр воздуха; 20,2 кБк / м, измеренные с 1976 по 1985 год). Концентрация в воздухе (невентилируемой) Gastein Healing Gallery составляет в среднем 43 кБк / м (1,2 нКи / л) с максимальным значением 160 кБк / м (4,3 нКи / л). Радон в основном появляется в цепочке распада рядов радия и урана (Rn) и незначительно в ряду тория (Rn). Элемент естественным образом выделяется из земли и некоторых строительных материалов по всему миру, где бы ни были обнаружены следы урана или тория, и особенно в регионах с почвами, содержащими гранит или сланец, которые имеют более высокую концентрацию урана. Не все гранитные регионы подвержены высоким выбросам радона. Как инертный газ, он обычно свободно мигрирует через разломы и фрагментированные почвы и может накапливаться в пещерах или в воде. Благодаря очень короткому периоду полураспада (четыре дня для Rn) концентрация радона очень быстро уменьшается при удалении от производственной зоны. Концентрация радона сильно зависит от сезона и атмосферных условий. Например, было показано, что он накапливается в воздухе при метеорологической инверсии и слабом ветре. Высокие концентрации радона можно найти в некоторых родниковых водах и горячих источниках. Города Боулдер, Монтана ; Мисаса ; Бад-Кройцнах, Германия; а в Японии есть богатые радием источники, излучающие радон. Чтобы вода считалась радоновой минеральной, концентрация радона должна быть выше 2 нКи / л (74 кБк / м). Активность радоновой минеральной воды достигает 2000 кБк / м в Мерано и 4000 кБк / м в Лурисиа (Италия). Естественные концентрации радона в атмосфере Земли настолько низки, что они богаты радоном. вода, контактирующая с атмосферой, будет постоянно терять радон в результате улетучивания . Следовательно, грунтовые воды имеют более высокую концентрацию Rn, чем поверхностные воды, потому что радон непрерывно образуется в результате радиоактивного распада Ra, присутствующего в горных породах. Аналогично, насыщенная зона почвы часто имеет более высокое содержание радона, чем ненасыщенная зона из-за диффузионных потерь в атмосферу. В 1971 году Аполлон 15 прошел 110 км (68 миль) над плато Аристарх на Луне и обнаружил значительный рост альфа-частиц предположительно вызвано распадом Rn. Присутствие Rn было установлено позже на основании данных, полученных с помощью спектрометра альфа-частиц Lunar Prospector. Радон обнаружен в некоторых нефти. Поскольку радон имеет такую же кривую давления и температуры, что и пропан, и нефтеперерабатывающие заводы отделяют нефтехимические продукты на основе их точек кипения, трубопроводы, по которым идет свежевыделенный пропан на нефтеперерабатывающих заводах, могут стать радиоактивными из-за разложения радон и его продукты. Остатки нефтяной и газовой промышленности часто содержат радий и его дочерние компоненты. Сульфатная накипь из нефтяной скважины может быть богатой радием, тогда как вода, нефть и газ из скважины часто содержат радон. Радон распадается с образованием твердых радиоизотопов, которые образуют покрытия на внутренней стороне трубопроводов. Накопление в зданиях Типичное логарифмически-нормальное распределение радона в жилищах Типичное логарифмически-нормальное распределение радона в жилищах  Прогнозируемая доля домов в США, имеющих концентрации радона превышают рекомендуемый EPA уровень действия 4 пКи / л Прогнозируемая доля домов в США, имеющих концентрации радона превышают рекомендуемый EPA уровень действия 4 пКи / л Высокие концентрации радона в домах были случайно обнаружены в 1985 году после того, как строгие радиационные испытания, проведенные на новой атомной электростанции, показали, что Stanley Watras, инженер-строитель завода, был заражен радиоактивными веществами, хотя реактор никогда не заправлялся. Типичное внутреннее воздействие составляет около 100 Бк / м (2,7 пКи / л) внутри помещения. Некоторый уровень радона будет во всех зданиях. Радон в основном попадает в здание непосредственно из почвы через самый нижний уровень здания, который контактирует с землей. Высокий уровень радона в системе водоснабжения также может повышать уровень радона в воздухе внутри помещений. Типичными точками проникновения радона в здания являются трещины в прочном фундаменте и стенах, строительные швы, щели в подвесных полах и вокруг коммуникационных труб, полости внутри стен и водопровода. Концентрация радона в одном и том же месте может отличаться вдвое / полвина за час. Кроме того, концентрация в одной комнате здания может значительно отличаться от концентрации в соседней комнате. Характеристики почвы жилищ являются наиболее важным источником радона для первого этажа, и более высокая концентрация радона в помещениях наблюдается на нижних этажах. Большинство высоких концентраций радона зарегистрировано в местах вблизи зон разломов ; следовательно, очевидна связь между скоростью выдоха из-за неисправностей и концентрацией радона в помещениях. Распределение концентраций радона обычно будет отличаться от комнаты к комнате, и значения усредняются в соответствии с нормативными протоколами. Обычно предполагается, что концентрация радона в помещении подчиняется логнормальному распределению на данной территории. Таким образом, среднее геометрическое обычно используется для оценки «средней» концентрации радона на территории. Средняя концентрация колеблется от менее 10 Бк / м до более 100 Бк / м в некоторые европейские страны. Типичные геометрические стандартные отклонения, обнаруженные в исследованиях, находятся в диапазоне от 2 до 3, что означает (с учетом правила 68–95–99.7 ), что ожидается, что концентрация радона будет более чем в сто раз выше средняя концентрация от 2% до 3% случаев. Некоторые из самых высоких радоновых опасностей в США находятся в Айове и в районах Аппалачских гор на юго-востоке Пенсильвании. В Айове самые высокие средние концентрации радона в США из-за значительного оледенения, которое измельчило гранитные породы Канадского щита и отложило его в виде почв, составляющих богатые сельскохозяйственные угодья Айовы. Многие города штата, такие как Iowa City, приняли требования к строительству новых домов с защитой от радона. Вторые по величине значения в Ирландии были обнаружены в офисных зданиях в ирландском городе Мэллоу, графство Корк, что вызвало опасения местных жителей относительно рака легких. В некоторых местах урановые хвосты использовались для свалок и впоследствии были застроены, что привело к возможному увеличению воздействия радона. Поскольку радон представляет собой бесцветный газ без запаха, единственный способ узнать, сколько присутствует в воздухе или воде для проведения испытаний. В США комплекты для тестирования на радон доступны для населения в розничных магазинах, таких как хозяйственные, для домашнего использования, а тестирование доступно у лицензированных профессионалов, которые часто являются домашними инспекторами. Усилия по снижению уровня радона в помещениях называются смягчение последствий радона. В США EPA рекомендует проверять все дома на радон. Промышленное производствоРадон получается как побочный продукт переработки урансодержащих руд после перевода в 1% растворы соляной или бромистоводородные кислоты. Газовая смесь, извлеченная из растворов, содержит H. 2, O. 2, He, Rn, CO. 2, H. 2O и углеводороды. Смесь очищают, пропуская ее над медью при температуре 993 K (720 ° C; 1328 ° F) для удаления H. 2и O. 2, а затем KOH и P. 2O. 5 используются для удаления кислот и влаги с помощью сорбция. Радон конденсируется жидким азотом и очищается от остаточных газов с помощью сублимации. Коммерческое использование радона регулируется, но он доступен в небольших количествах для калибровки систем измерения Rn по цене в 2008 году почти 6000 долларов США. (эквивалентно 7 125 долларам США в 2019 году) на миллилитр раствора радия (который содержит только около 15 пикограммов реального радона в любой момент времени). Радон получают из раствора радия-226 (период полураспада 1600 лет). Радий-226 распадается в результате испускания альфа-частиц, образуя радон, который накапливается над образцами радия-226 со скоростью около 1 мм / день на грамм радия; равновесие достигается быстро, и радон образуется в устойчивом потоке с активностью, равной активности радия (50 Бк). Газообразный Rn (период полураспада около четырех дней) выходит из капсулы в результате диффузии. Шкала концентраций
Приложения МедицинаФормой шарлатанства начала 20 века было лечение болезней в радиотории. Это была небольшая закрытая комната для пациентов, которые подвергались облучению радоном из-за его «лечебных эффектов». Канцерогенность радона из-за его ионизирующего излучения стала очевидной позже. Повреждающая молекулы радона радиоактивность была использована для уничтожения раковых клеток, но она не улучшает здоровье здоровых клеток. Ионизирующее излучение вызывает образование свободных радикалов, что приводит к повреждению клеток, вызывая повышенный уровень заболеваемости, включая рак. Воздействие радона было предложено для смягчения аутоиммунные заболевания, такие как артрит, в процессе, известном как лучевой гормезис. В результате в конце 20-го и начале 21-го века «мины здоровья», установленные в Бейсине, штат Монтана, привлекли людей, ищущих помощи от проблем со здоровьем, таких как артрит, за счет ограниченного воздействия радиоактивной шахтной воды и радона. Такая практика не приветствуется из-за хорошо документированных пагубных последствий высоких доз радиации для тела. Радиоактивные водяные бани применялись с 1906 года в Яхимове, Чешская Республика, но даже раньше открытие радона они были использованы в Бад-Гаштайне, Австрия. Богатые радием пружины также используются в традиционных японских онсэн в Мисаса, префектура Тоттори. Питьевая терапия применяется в Бад-Брамбах, Германия. Ингаляционная терапия проводится в Австрии, в Сверадув-Здруй, Ковары, Лёндек-Здруй, Польша, в Харгита-Бэй, Румыния. и в Боулдер, Монтана. В США и Европе есть несколько "радоновых курортов", где люди сидят в течение нескольких минут или часов в атмосфере с высоким содержанием радона, веря, что низкие дозы радиации придадут им силы или зарядят энергией. Радон был принят. производятся коммерчески для использования в лучевой терапии, но по большей части были заменены радионуклидами, производимыми в ускорителях частиц и ядерных реакторах. Радон использовался в имплантируемых семенах, сделанных из золота или стекла, в основном для лечения рака, известного как брахитерапия. Золотые семена были получены путем заполнения длинной трубки радоном, накачиваемым из источника радия, после чего трубка была разделена на короткие секции путем обжима и резки. Слой золота удерживает радон внутри и отфильтровывает альфа- и бета-излучения, позволяя выходить гамма-лучам (которые убивают пораженные ткани). Активность может варьироваться от 0,05 до 5 милликюри на семя (от 2 до 200 МБк). Гамма-лучи производятся радоном и первыми короткоживущими элементами его цепочки распада (Po, Pb, Bi, Po). Радон и первые продукты его распада очень недолговечны, поэтому затравка остается на месте. После 12 периодов полураспада (43 дня) радиоактивность радона составляет 1/2 000 от исходного уровня. На этой стадии преобладающая остаточная активность происходит от продукта распада радона Pb, период полураспада которого (22,3 года) в 2000 раз больше, чем у радона (и, таким образом, активность которого составляет 1/2 000 радона), и его потомков Bi и Po. НаучныйИзлучение радона из почвы зависит от типа почвы и содержания урана на поверхности, поэтому концентрации радона на открытом воздухе можно использовать для отслеживания воздушных масс в ограниченной степени. Этот факт был использован некоторыми исследователями атмосферы. Из-за быстрой потери радона в воздухе и сравнительно быстрого распада радон используется в гидрологических исследованиях, которые изучают взаимодействие между подземными водами и потоками. Любая значительная концентрация радона в ручье является хорошим индикатором наличия местных поступлений грунтовых вод. Концентрация радона в почве была использована экспериментальным способом для картирования подземных геологических разломов, потому что концентрации обычно выше над разломами. Точно так же он нашел ограниченное применение при поисках геотермальных градиентов. . Некоторые исследователи исследовали изменения в концентрациях радона в подземных водах для прогноза землетрясений. Период полураспада радона составляет примерно 3,8 дня, что означает, что его можно обнаружить только вскоре после того, как он был произведен в цепочке радиоактивного распада. По этой причине была выдвинута гипотеза, что увеличение концентрации радона происходит из-за образования новых подземных трещин, которые позволят увеличить циркуляцию подземных вод, вымывая радон. Не без оснований можно предположить, что образование новых трещин предшествует сильным землетрясениям. В 1970-х и 1980-х годах научные измерения выбросов радона вблизи разломов показали, что землетрясения часто происходят без сигнала радона, а радон часто обнаруживается без последующего землетрясения. Затем многие отвергли его как ненадежный индикатор. По состоянию на 2009 год НАСА. расследует его как возможный предшественник. Радон является известным загрязняющим веществом, выбрасываемым геотермальными электростанциями, поскольку он присутствует в материале, перекачиваемом из глубоких подземных слоев. Он быстро рассеивается, и в ходе различных исследований не было продемонстрировано никакой радиологической опасности. Кроме того, типичные системы повторно закачивают материал глубоко под землю, а не выпускают его на поверхность, поэтому его воздействие на окружающую среду минимально. В 1940-х и 1950-х годах радон использовался для промышленной радиографии. Другие источники рентгеновского излучения, которые стали доступны после Второй мировой войны, быстро заменили радон для этого приложения, поскольку они были дешевле и имели меньшую опасность альфа-излучения. Риски для здоровья В шахтахПродукты распада радона-222 были классифицированы Международным агентством по изучению рака как канцерогенные для человека и как газ, который можно вдыхать, легкие рак вызывает особую озабоченность у людей, длительное время подвергающихся воздействию повышенных уровней радона. В 1940-х и 1950-х годах, когда стандарты безопасности, требующие дорогостоящей вентиляции в шахтах, не применялись широко, облучение радоном было связано с раком легких у некурящих горняков урана и других твердых горных пород на территории нынешней Чешской Республики, а затем и среди горняков. из Юго-Запада США и Южной Австралии. Несмотря на то, что эти опасности были известны в начале 1950-х годов, этот профессиональный риск оставался плохо управляемым на многих рудниках до 1970-х годов. В течение этого периода несколько предпринимателей открыли для широкой публики бывшие урановые рудники в США и рекламировали предполагаемую пользу для здоровья от вдыхания радона под землей. Заявленные преимущества для здоровья включали облегчение боли, пазух носа, астмы и артрита, но они оказались ложными, и правительство запретило такую рекламу в 1975 году. С тех пор вентиляция и другие меры используются для снижения уровня радона в наиболее пострадавших шахтах, которые продолжают работать. В последние годы среднегодовое воздействие на добытчиков урана упало до уровней, аналогичных концентрациям, вдыхаемым в некоторых домах. Это снизило риск профессионального рака, вызванного радоном, хотя проблемы со здоровьем могут сохраняться у тех, кто в настоящее время работает на пораженных шахтах, и у тех, кто работал на них в прошлом. Поскольку относительный риск для горняков снизился, появилась возможность обнаруживать повышенные риски среди этого населения. Остатки от переработки урановой руды также могут быть источником радона. Радон, образующийся из-за высокого содержания радия в открытых свалках и хвостохранилищах, может легко выбрасываться в атмосферу и поражать людей, живущих поблизости. Помимо рака легких, исследователи предположили возможное повышение риска лейкоз из-за облучения радоном. Эмпирические данные исследований населения в целом противоречивы, а исследование уранодобытчиков выявило корреляцию между облучением радоном и хроническим лимфолейкозом. Горняки (а также горняки и рабочие, занимающиеся транспортировкой руды), которые работали в урановой промышленности. в США в период с 1940-х по 1971 г. может иметь право на компенсацию в соответствии с Законом о компенсации за радиационное облучение (RECA). Выжившие родственники также могут подать заявление в случаях, когда ранее работавший человек умер. Следует подчеркнуть, что не только урановые рудники подвержены повышенному уровню радона. В частности, затронуты угольные шахты, так как уголь может содержать больше урана и тория, чем коммерческие урановые шахты. Воздействие на бытовом уровнеОблучение радоном (в основном дочерним радоном) было связано с раком легких в многочисленных исследованиях методом случай-контроль, проведенных в США, Европе и Китае. В США ежегодно умирает около 21 000 человек из-за рака легких, вызванного радоном. Одно из наиболее полных исследований радона, проведенное в США доктором Р. Уильям Филд и его коллеги обнаружили на 50% увеличение риска рака легких даже при длительном воздействии при уровне действия EPA 4 пКи / л. Объединенные анализы Северной Америки и Европы дополнительно подтверждают эти выводы. Однако дискуссия об обратных результатах все еще продолжается, особенно ретроспективное исследование риска рака легких 2008 года, которое показало существенное снижение частоты рака для концентраций радона от 50 до 123 Бк / м. Большинство моделей Облучение радоном в жилых помещениях основано на исследованиях горняков, и более желательна прямая оценка рисков для домовладельцев. Из-за трудностей измерения риска радона по сравнению с курением, модели их воздействия часто используют их. EPA считает радон второй ведущей причиной рака легких и ведущей экологической причиной смертности от рака. Другие пришли к аналогичным выводам в отношении Соединенного Королевства и Франции. Облучение радоном в домах и офисах может быть связано с определенными подземными горными образованиями, а также с некоторыми строительными материалами (например, некоторыми гранитами). Наибольший риск облучения радоном возникает в зданиях, которые герметичны, недостаточно вентилируются и имеют протечки в фундаменте, через которые воздух из почвы попадает в подвалы и жилые помещения. Действие и референтный уровеньВ 2009 году ВОЗ представила рекомендуемый референтный уровень (национальный референтный уровень) 100 Бк / м3 для радона в жилищах. В рекомендации также говорится, что там, где это невозможно, следует выбирать 300 Бк / м в качестве наивысшего уровня. Национальный референсный уровень не должен быть пределом, но должен представлять максимально допустимую среднегодовую концентрацию радона в жилище. Действующая концентрация радона в доме варьируется в зависимости от организации, выполняющей рекомендации, например, EPA рекомендует принимать меры при концентрациях до 74 Бк / м (2 пКи / л), а Европейский Союз рекомендует принимать меры, когда концентрации достигают 400 Бк / м (11 пКи / л). для старых домов и 200 Бк / м (5 пКи / л) для новых. 8 июля 2010 года Агентство по охране здоровья Великобритании выпустило новую рекомендацию, устанавливающую «Целевой уровень» в 100 Бк / м при сохранении «Уровня действия» 200 Бк / м. Те же уровни (как в Великобритании) применяются к Норвегии с 2010 года; во всех новых корпусах следует принимать профилактические меры против накопления радона. Вдыхание и курениеРезультаты эпидемиологических исследований показывают, что риск рака легких увеличивается при воздействии радона в жилых помещениях. Хорошо известным примером источника ошибок является курение, основной фактор риска рака легких. В США курение сигарет, по оценкам, вызывает от 80% до 90% всех случаев рака легких. Согласно EPA, риск рака легких для курильщиков является значительным из-за синергических эффектов радона и курения. Для этой группы населения около 62 человек из 1000 умрут от рака легких по сравнению с 7 людьми из 1000 среди людей, которые никогда не курили. Нельзя исключить, что риск для некурящих следует в первую очередь объяснять комбинированным действием радона и пассивного курения. Радон, как и другие известные или предполагаемые внешние факторы риска рака легких, представляет угрозу для курильщиков и бывшие курильщики. Это было продемонстрировано европейским пулинговым исследованием. В комментарии к объединенному исследованию говорилось: «неуместно говорить просто о риске от радона в домах. Риск связан с курением, усугубляемым синергическим эффектом радона на курильщиков. Без курения эффект кажется таким незначительным. как незначительный ". Согласно европейскому объединенному исследованию, существует разница в риске гистологических подтипов рака легких и воздействия радона. Мелкоклеточная карцинома легких, которая имеет высокую корреляцию с курением, имеет более высокий риск после облучения радоном. Для других гистологических подтипов, таких как аденокарцинома, тип, который в первую очередь поражает некурящих, риск от радона, по-видимому, ниже. Исследование радиации после мастэктомии лучевая терапия показывает, что необходимо разработать простые модели, которые ранее использовались для оценки комбинированных и раздельных рисков, связанных с облучением и курением. Это также подтверждается новым обсуждением метода расчета, линейной беспороговой модели, которая обычно использовалась. Исследование 2001 года, в которое вошли 436 некурящих и один Контрольная группа из 1649 некурящих показала, что облучение радоном увеличивает риск рака легких у некурящих. Группа, подвергавшаяся воздействию табачного дыма в домашних условиях, оказалась подвержена гораздо более высокому риску, в то время как те, кто не подвергался пассивному курению, не показали какого-либо повышенного риска с увеличением воздействия радона. ПроглатываниеЭффекты радона при попадании внутрь неизвестны, хотя исследования показали, что его биологический период полураспада составляет 30–70 минут, а 90% удаляется за 100 минут. В 1999 г. Национальный исследовательский совет США исследовал проблему радона в питьевой воде. Риск, связанный с проглатыванием, считался практически незначительным. Вода из подземных источников может содержать значительное количество радона в зависимости от окружающих горных пород и почвенных условий, тогда как поверхностные источники обычно не содержат. Радон не только попадает в организм с питьевой водой, но и выделяется из воды, когда температура увеличивается, давление снижается и при аэрации воды. Оптимальные условия для выделения радона и воздействия были достигнуты во время принятия душа. Вода с концентрацией радона 10 пКи / л может увеличить концентрацию радона в воздухе внутри помещений на 1 пКи / л при нормальных условиях. Тестирование и смягчение последствий Цифровой детектор радона Цифровой детектор радона  Набор для проверки радона Набор для проверки радона Есть относительно простые тесты на радон. В некоторых странах эти тесты методично проводятся в районах с известными систематическими опасностями. Устройства обнаружения радона коммерчески доступны. Цифровые детекторы радона обеспечивают непрерывные измерения, отображающие средние значения за день, неделю, краткосрочные и долгосрочные результаты на цифровом дисплее. Приборы для краткосрочного тестирования на радон, используемые для целей первичного скрининга, недороги, а в некоторых случаях и бесплатны. Существуют важные протоколы для сдачи краткосрочных тестов на радон, и их необходимо строго соблюдать. В комплект входит коллектор, который пользователь подвешивает на нижнем жилом этаже дома на два-семь дней. Затем пользователь отправляет коллектор в лабораторию для анализа. Также доступны долгосрочные комплекты, рассчитанные на срок до одного года и более. Набор для тестирования открытого грунта может проверить выбросы радона от земли до начала строительства. Концентрации радона могут меняться ежедневно, и точные оценки воздействия радона требуют долгосрочных средних измерений радона в помещениях, где человек проводит значительное количество времени. Уровни радона колеблются естественным образом из-за таких факторов, как переходные погодные условия, поэтому первоначальный тест может не дать точной оценки среднего уровня радона в доме. Уровни радона максимальны в самое прохладное время дня, когда перепады давления максимальны. Следовательно, высокий результат (более 4 пКи / л) оправдывает повторение теста перед тем, как приступить к более дорогостоящим проектам по снижению выбросов. Измерения от 4 до 10 пКи / л требуют долгосрочного анализа на радон. Измерения свыше 10 пКи / л требуют только еще одного краткосрочного теста, чтобы меры по снижению выбросов не были чрезмерно задержаны. Покупателям недвижимости рекомендуется отложить или отклонить покупку, если продавец не снизил уровень радона до 4 пКи / л или менее. Поскольку период полураспада радона составляет всего 3,8 дня, удалив или изолировав source значительно снизит опасность в течение нескольких недель. Еще один метод снижения уровня радона - изменить вентиляцию здания. Как правило, концентрация радона в помещениях увеличивается по мере уменьшения интенсивности вентиляции. В хорошо вентилируемом месте концентрация радона имеет тенденцию соответствовать значениям вне помещения (обычно 10 Бк / м, в диапазоне от 1 до 100 Бк / м). Четыре основных способа снижения количества накапливаемого радона в доме:
Согласно EPA, метод уменьшения содержания радона "... в основном используется в система вентиляционных труб и вентилятор, который вытягивает радон из-под дома и выводит его наружу », что также называется разгерметизацией под плитами, активной разгерметизацией почвы или всасыванием почвы. Как правило, уровень радона внутри помещений можно уменьшить за счет разгерметизации субплит и выпуска такого насыщенного радоном воздуха на улицу, подальше от окон и других проемов здания. «[EPA] обычно рекомендует методы, которые предотвращают проникновение радона. Всасывание почвы, например, предотвращает проникновение радона в ваш дом, втягивая радон из-под дома и выводя его через трубу или трубы в воздух над дома, где он быстро растворяется », и« EPA не рекомендует использовать только герметизацию для снижения содержания радона, потому что герметизация сама по себе не снижает уровень радона значительно или постоянно ». Вентиляция с положительным давлением системы могут быть объединены с теплообменником для рекуперации энергии в процессе обмена воздухом с внешней средой, и простой выпуск воздуха из подвала наружу не обязательно является жизнеспособным решением, так как это может фактически привлечь газ радон в жилище. Дома, построенные на подполье, могут получить пользу от радонового коллектора, установленного под «радоновым барьером» (пластиковым листом, закрывающим подполье). В отношении помещений для ползания, EPA заявляет: «Эффективный метод снижения уровня радона в домах для ползания включает покрытие земляного пола пластиковым листом высокой плотности. Вентиляционная труба и вентилятор используются для отвода радона из-под листа и его вентиляции. Эта форма всасывания почвы называется субмембранным всасыванием, и при правильном применении это наиболее эффективный способ снизить уровень радона в домах для ползания ». См. также
Ссылки Внешние ссылки
Последняя правка сделана 2021-06-03 06:13:44
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное). | ||||||||||||||||||||||||||||||||||