Полоний - это химический элемент с символом Poи атомным номером 84. Редкий и высоко радиоактивный металл без стабильных изотопов, полоний химически подобен селену и теллуру, хотя его металлический характер напоминает характер его горизонтальных соседей в периодической таблицы : таллий, свинец и висмут. Из-за короткого периода полураспада всех его изотопов его естественное появление ограничено крошечными следами мимолетного полония-210 (с периодом полураспада 138 дней) в уран руды, так как это предпоследняя дочь природного урана-238. Хотя существуют немного более долгоживущие изотопы, их намного труднее труднее. Сегодня полоний обычно получают в миллиграммах при нейтронном облучении висмута. Из-за его радиоактивности, которая приводит к радиолизу химическим связям и радиоактивному самонагреванию, его химический состав в основном исследовался только в следовых количествах.
Полоний был открыт в 1898 году Мари и Пьером Кюри, когда он был извлечен из урановой руды настуран и идентифицирован исключительно по его сильному радиоактивности : это был первый элемент, открытым таким образом. Полоний был назван в честь родины Марии Кюри в Польше. Полоний имеет несколько применений, и они связаны с его радиоактивностью: нагреватели в космических зондах, антистатические устройства, источники нейтронов и альфа-частицы и яд. Это очень опасно для человека.
Po является альфа-излучателем с периодом полураспада 138,4 дня; он распадается непосредственно на свой стабильный дочерний изотоп , Pb. Миллиграмм (5 кюри ) По испускает примерно столько же альфа-частиц в секунду, как 5 граммов Ra. Несколько кюри (1 кюри равен 37 гигабеккерелей, 1 Ки = 37 ГБк) По излучают голубое свечение, которое вызвано ионизацией окружающего воздуха.
Примерно одно из 100000 альфа-излучения вызывает возбуждение ядра, которое приводит к испусканию гамма-излучения с максимальной энергией 803 кэВ.
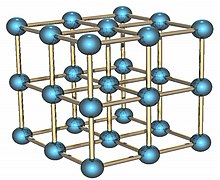 Альфа-форма твердого полония.
Альфа-форма твердого полония. Полоний - это радиоактивный элемент, который существует в двух металлических аллотропах. Альфа-форма является единственным известным примером простой кубической кристаллической структуры в основе одного атома на STP длиной ребра 335,2 пикометров ; бета-форма - ромбоэдрическая. Структура полония была охарактеризована методом рентгеновского излучения дифракции и дифракцииов.
Po (вместе с Pu ) способностью легко переноситься в воздух : если образец нагревается на воздухе до 55 ° C (131 ° F), 50% его испаряется за 45 часов с образованием двухатомных Po2молекул, если даже точка плавления полония составляет 254 ° C (489 ° F).), его температура кипения составляет 962 ° C (1764 ° F). Существует несколько гипотез о том, как полоний это делает; одно предположение состоит в том, что небольшие кластеры атомов полония отщепляются в результате альфа-распада.
Химический состав полония аналогичен химическому составу теллура, хотя он также имеет некоторое сходство со своим соседом висмутом из-за его металлического персонажа. Полоний легко растворяется в разбавленных кислотах, но лишь незначительно растворяется в щелочах. Растворы полония сначала окрашиваются в розовый цвет ионами Po, но затем становятся желтыми, поскольку альфа-излучение полония ионизирует растворитель и превращает Po в Po. Полоний также испускает альфа-частицы после распада, этот процесс сопровождается пузырьками и излучением тепла и света стеклянной посудой из-за поглощенных альфа-частиц; в результате растворы полония летучие и испаряются в течение нескольких дней, если их не закрыть. При pH около 1 ионы полония легко гидролизуются и образуют комплексы с кислотами, такими как щавелевая кислота, лимонная кислота и винная кислота.
Полоний не имеет соединений общих, и почти все его соединения искусственным путем; известно более 50 из них. Наиболее стабильным классом соединения полония являются полониды, которые получают путем прямого взаимодействия двух элементов. Na2Po имеет структуру антифторита, полониды, Pb и лантаноиды образуют решетку NaCl и имеют вюрцит и MgPo арсенид никеля структура. Большинство полонидов разлагаются при нагревании примерно до 600 ° C, за исключением HgPo, который разлагается при ~ 300 ° C, и полонидов лантаноидов, которые не разлагаются, плавятся при температуре выше 1000 ° C, например, PrPo плавится при 1250 ° C, а TmPo при 2200 ° C является одним из очень немногих природных соединений полония, поскольку полоний альфа-распад с образованием свинца.
гидрид полония (PoH. 2) представляет собой летучую жидкость., склонную к диссоциация; он термически нестабилен. Вода - единственный другой известный халькогенид водорода, который является жидким при комнатной температуре; однако это происходит из-за водородных связей. Три оксида, PoO, PoO 2 и PoO 3, представляют собой продукты окисления полония.
Галогениды структуры PoX 2, PoX 4 и PoF 6 известны. Они растворимы в соответствующих галогенидах водорода, то есть PoCl X в HCl, PoBr X в HBr и PoI 4 в HI. Дигалогениды полония образуются прямой реакцией элементов или восстановлением PoCl 4 с SO 2 и с PoBr 4 с H 2 S при комнатной температуре. Тетрагалогениды могут быть вызваны путем взаимодействия диоксида полония с HCl, HBr или HI.
Другие соединения полония включают, как, ацетат, бромат, карбонат, цитрат, хромат, цианид, формиат и гидроксиды, моносульфид, сульфат и.
Определенный ограниченный химический состав полонияорганических соединений, в основном ограниченный диалкил- и диарилполонидами (R 2 Po), галогенилполония (Ar 3 PoX) и дигалогенидами диарилполония (Ar 2 PoX 2). Полоний образует растворимые соединения с некоторыми хелатирующими агентами, такими как 2,3-бутандиол и тиомочевина.
| Формула | Цвет | т.пл. (° C) | Сублимация. темп. (° C) | Симметрия | символ Пирсона | Пространственная группа | No | a (pm) | b (pm) | c (pm) | Z | ρ (г / см) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PoO | черный | ||||||||||||
| PoO 2 | бледно-желтый | 500 (разл.) | 885 | fcc | cF12 | Fm3m | 225 | 563,7 | 563,7 | 563,7 | 4 | 8,94 | |
| PoH 2 | -35,5 | ||||||||||||
| PoCl 2 | темно-рубиново-красный | 355 | 130 | ромбический | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6,47 | |
| PoBr2 | пурпурно-коричневый | 270 (разл.) | |||||||||||
| PoCl 4 | желтый | 300 | 200 | моноклинный | |||||||||
| красный | 330 (разл.) | fcc | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | ||||
| черный |
Оксиды | Гидриды |
|
Полоний имеет 42 известных изотопа, все из которых радиоактивны. Они имеют атомные массы в диапазоне от 186 до 227 u. Po (период полураспада 138,376 дней) наиболее широко доступным путем путем захвата нейтронов природным висмутом. Более долгоживущие Po (период полураспада 125,2 ± 3,3 года, самый долгоживущий из всех изотопов полония) и Po (период полураспада 2,9 года) могут быть получены в результате бомбардировки альфа-, протонами или дейтронами свинца или висмут в циклотроне.
Предварительно названный «радий F », полоний был открыт Мари и Пьером Кюри в 1898 году, и был назван в честь родины Марии Кюри - Польши (лат. : Polonia). Польша в то время находилась под русским, немецким и австро-венгерским разделом и не существовала какая страна. Кюри надеялась, что наименование элемента в честь ее родины раскроет ее отсутствие независимости. Полоний может быть первым, названным, чтобы подчеркнуть политическую полемику.
Этот элемент был первым, обнаруженным Кюри, когда они исследовали причину пятнистой обманки радиоактивности. После удаления радиоактивных элементов уран и торий пичбленда оказалась более радиоактивной, чем уран и торий вместе взятые. Это побудило Кюри искать дополнительные радиоактивные элементы. Они впервые выделили полоний из настуран в июле 1898 года, пять месяцев спустя также выделили радий. Немецкий ученый Вилли Марквальд успешно выделил 3 миллиграмма полония в 1902 году, хотя в то время он считал, что это новый элемент, который он назвал «радиотеллуром», и только в 1905 году это было это былоано. быть таким же, как полоний.
В пределах Штатах полоний производился в рамках Манхэттенского проекта Дейтонского проекта во время Второй мировой войны. Полоний и бериллий были ключевыми ингредиентами инициатора «Urchin » в центре сферической ямы бомбы. «Urchin» инициировал ядерную цепную реакцию в момент мгновенной критичности, чтобы сопротивление, что оружие не взорвется. «Urchin» использовался в раннем оружии США; в последующем американском оружии для той же цели использовался импульсный нейтронный генератор.
Большая часть основ физики полония была засекречена до окончания войны. Тот факт, что он использовался в качестве инициатора, был засекречен до 1960-х.
Комиссия по атомной энергии и Манхэттенский проект финансировали эксперименты на людях использовали полоний на пяти человек в Университете Рочестера в период с 1943 по 1947 год. Людям вводили от 9 до 22 микрокюри (330 и 810 кБк ) полония для изучения его выделение.
Полоний - очень редкий элемент в природе из-за короткого периода полураспада всех его изотопов. Семь изотопов встречаются в следах как продукты распада : Po, Po и Po присутствуют в цепочке распада U ; Po и Po присутствуют в цепочке распада U ; По и По присутствуют в цепочке распада Th. Из них Po является единственным изотопом с периодом полураспада более 3 минут.
Полоний может быть найден в урановой руде в количестве примерно 0,1 мг на метрическую тонну (1 часть из 10), что составляет примерно 0,2% от содержания радия. Количества в земной коре не вредны. Полоний был обнаружен в табачном дыме из листьев табака, выращенных с фосфатными удобрениями.
Сейчас он присутствует в небольших размерах, выделение полония из природных источников утомительно. процесс. Самая большая партия когда-либо извлеченного элемента, выполненная в первой половине 20-го века, содержала всего 40 Ки (1,5 ТБк) (9 мг) полония-210 и была получена переработкой 37 тонн остатков. от производства радия. В настоящее время полоний обычно получают путем облучения висмута нейтронами, протонами высоких энергий.
В 1934 году эксперимент показал, что при бомбардировке природного Bi нейтронами Bi создается, который распадается на Po через бета-минус распад. Окончательная очистка проводится пирохимически с жидкостно-жидкостной экстракцией. Полоний теперь может быть получен в миллиграммах с помощью этой процедуры, в которой используются высокие потоки нейтронов, обнаруженные в ядерных реакторах. Ежегодно производится всего около 100 граммов, практически все это в России, что делает полоний редким.
Этот процесс может вызвать проблемы в свинцово-висмутовых ядерных реакторах с жидкометаллическим охлаждением. реакторы, такие как те, что используются в ВМФ К-27. В этих реакторах может быть принято предупреждение для нежелательной возможности выделения Po из теплоносителя.
Долгоживущие изотопы полония, Po и Po, могут быть образованы протоном или бомбардировка висмута дейтроном с помощью циклотрона. Другие более нейтронодефицитные и более нестабильные изотопы могут быть образованы при облучении платины углеродными ядрами.
Источники альфа-частиц на основе полония были получены в бывшем Советском Союз. Такие источники применялись для измерения толщины промышленных покрытий путем ослабления альфа-излучения.
Из-за интенсивного альфа-излучения образец Po весом один грамм самопроизвольноревается до температуры выше 500 ° C (932 ° F). генерируя около 140 Вт мощности. Следовательно, Po используется в атомном источнике тепла для питания радиоизотопных термоэлектрических генераторов через термоэлектрические материалы. Например, источники тепла Po использовались в марсоходах Луноход 1 (1970) и Луноход 2 (1973) Луноходы для поддержания тепла их внутренних компонентов в течение лунных ночей, а также Спутники Космос 84 и 90 (1965 г.).
Альфа-частицы, испускаемые полонием, могут быть преобразованы в нейтроны с использованием оксида бериллия из расчета 93 нейтрона на миллион альфа-частиц. Таким образом, смеси Po-BeO или сплавы используются в источнике нейтронов, например, в нейтронном триггере или инициаторе для ядерного оружия и для обследования нефтяных скважин. Около 1500 источников этого типа с индивидуальной активностью 1850 Ки (68 ТБк) ежегодно использовались в Советском Союзе.
Полоний также входил в состав щеток или более сложных инструментов, устраняющих статические заряды на фотографиях. пластины, текстильные мельницы, бумажные рулоны, листы пластмассы и на подложках (таких как автомобильные) перед нанесением покрытий. Альфа-частицы, испускаемые полонием, ионизируют молекулы воздуха, которые нейтрализуют заряды на близлежащих поверхностях. Некоторые антистатические щетки содержат до 500 микрокюри (20 МБк) Po в качестве источника заряженных частиц для нейтрализации статического электричества. В США устройства с не более чем 500 мкКи (19 МБк) (запечатанного) Po на единицу могут быть куплены в любом количестве по «генеральной лицензии», что означает, что покупатель не должен регистрироваться какими-либо органами. Полоний необходимо заменять в этих устройствах почти каждый год из-за его короткого периода полураспада; он также очень радиоактивен и поэтому в основном заменен менее опасными источниками бета-частицы.
Небольшое количество Po иногда используются в лаборатории и учебных целях - порядок 4–40 кБк (0,11–1,08 мкКи) в форме обычно закрытых источников с полонием, нанесенным на подложку или в смолу или полимерную матрицу - часто освобождаются от лицензирования NRC и аналогичными средствами, поскольку они не считаются опасными. Небольшие количества Po производятся для продажи в качестве «источников игл» для лабораторных экспериментов, и они реализуются в розницу научными поставщиками-поставщиками. Полоний представляет собой слой гальванического покрытия, который, в свою очередь, покрыт таким материалом, как золото, которое позволяет проходить альфа-излучению (используемому в таких экспериментах, как камера Вильсона), не позволяя полонию высвобождаться и представлять опасность отравления. Согласно United Nuclear, они обычно продают от четырех до восьми таких источников в год.
Полониевые свечи зажигания продавались Firestone с 1940 года. - 1953. Количество излучения от свечей было незначительным и не представляло угрозы для потребителя, увеличилось из-за короткого периода полураспада полония и из-за того, что скопление на проводниках блокировало бытие, улучшенные характеристики двигателя. (Основа, лежащая в полониевой свечи зажигания, а также прототипа Альфреда Мэтью Хаббарда радиевой свечи, которая предшествовала ей, заключалась в том, что излучение улучшило ионизацию топлива в цилиндре и это позволяет двигателю работать быстрее и эффективнее.)
Полоний может быть опасным и не играет биологической роли. По массе полоний-210 примерно в 250 000 более токсичен, чем цианистый водород (LD50 для По составляет менее 1 микрограмма для среднего взрослого человека (см. Ниже) по сравнению с примерно 250 миллиграммов цианистого водорода). Основная опасность заключается в его высокой радиоактивности, что затрудняет безопасное обращение с ним. Даже в количестве микрограмма обращение с опасно, требуя специального оборудования (перчаточный ящик альфа с отрицательным давлением, оборудованного высокопроизводительными фильтрующими фильтрами), адекватного контроля и строгих процедур обращения, чтобы избежать загрязнения. Альфа-частицы, испускаемые полонием, легко повреждают органические ткани, если полоний проглатывается, вдыхается или абсорбируется, хотя они не проникают через эпидермис и, следовательно, не представляют опасности, пока альфа-частицы остаются вне тела. Ношение химически стойких и неповрежденных перчаток является обязательной мерой предосторожности во избежание чрескожной диффузии полония непосредственно через кожу. Полоний, доставленный в концентрированной азотной кислоте, может легко диффундировать через неподходящие перчатки (например, латексные перчатки ), или кислота может повредить перчатки.
Полоний не содержит токсичных химических веществ.
Сообщалось, что некоторые микробы могут метилировать полоний под действием метилкобаламина. Это похоже на то, как ртуть, селен и теллур метилируются в живых организмах с образованием металлоорганических соединений. Исследования метаболизма полония-210 у крыс показали, что только от 0,002 до 0,009% попавшего внутрь полония-210 выделяется в виде летучего полония-210.
Среднее значение летальная доза (LD 50) при остром лучевомении облучения составляет примерно 4,5 Зв. Ожидаемая эффективная эквивалентная доза Po составляет 0,51 мкЗв / Бк при приеме внутрь и 2,5 мкЗв / Бк при вдыхании. Смертельная доза 4,5 Зв может быть вызвана приемом внутрь 8,8 МБк (240 мкКи), примерно 50 нанограмм (нг) или вдыханием 1,8 МБк (49 мкКи), примерно 10 нг. Таким образом, один грамм Po может теоретически отравить 20 миллионов человек, из которых 10 миллионов погибнут. Фактическая токсичность Po ниже, чем эти оценки, вызывает облучение, которое распространяется на несколько недель (биологический период полураспада полония у человека составляет от 30 до 50 дней), несколько менее опасен, чем мгновенная доза.. Было подсчитано, что средняя летальная доза По составляет 15 мегабеккерелей (0,41 мКи) или 0,089 микрограмма (мкг), что все еще является чрезвычайно малым количеством. Для сравнения, одна крупинка поваренной соли составляет около 0,06 мг = 60 мкг.
Помимо острых эффектов, радиационное воздействие (как внутренний, так и внешний) несет в себе долгосрочный риск смерти от рака 5–10% на Зв. Население в целом подвергается воздействию количеств полония в виде дочернего радона в воздухе; Считается, что изотопы Po и Po являются самыми опасными из примерно 15 000–22 000 смертей от рака легких в США каждый год, которые были приписаны радону в помещениях. Курение табака вызывает дополнительное воздействие полония.
Максимально допустимая нагрузка на организм от проглоченного По составляет всего 1,1 кБк (30 нКи), что эквивалентно массе частиц всего 6,8ограмма. Максимально допустимая переносимого по воздуху По на рабочем месте составляет около 10 Бк / м (3 × 10 мкКи / см). Органами-мишенями для полония у человека являются селезенка и печень. Селезенка (150 г) и печень (от 1,3 до 3 кг) намного меньше, чем остальная часть тела, если полоний сконцентрирован в этих жизненно важных органах, это большая угроза для жизни, чем доза, которая будет понесена. (в среднем) по всему телу, если он был распределен по всему телу равномерно, таким же образом, как цезий или тритий (как T 2 O).
По широко используется в промышленности и легко без каких-либо нормативных требований или ограничений. В США в 2007 году была внедрена система управляемой Комиссией по ядерному регулированию, для регистрации покупок полония-210 на сумму более 16 кюри (590 ГБк) (достаточно для получения 5000 смертельных доз). Сообщается, что МАГАТЭ "рассматривает возможность ужесточения правил... Ходят слухи, что оно может ужесточить требования к отчетности по полонию в 10 раз до 1,6 кюри (59 ГБк)". По состоянию на 2013 год, это все еще единственный доступный побочный продукт, излучающий альфа, которое может храниться без лицензии на радиоактивные материалы.
С полонием и его соединениями следует обращаться в перчатках ящик, который дополнительно заключен в другой ящик, в котором поддерживается более высокое давление, чем в перчаточном ящике, чтобы предотвратить утечку радиоактивных материалов. Перчатки из натурального каучука не достаточной защиты от излучения полония; необходимы хирургические перчатки. Неопрен перчатки лучше защищают от излучения полония, чем натуральный каучук.
Полоний вводился людям в экспериментальных целях с 1943 года. к 1947 г.; его вводили четверым госпитализированным пациентом и перорально давали пятому. Подобные исследования финансировались Манхэттенским проектом и AEC и проводились в Университете Рочестера. Цель заключалась в том, чтобы получить данные о выделении полония человеком, чтобы сопоставить их с более обширными данными, полученными на крысах. Пациенты, выбранные в качестве испытуемых, были выбраны, потому что экспериментаторы хотели людей, которые не подверглись полонии ни на работе, ни в результате несчастного случая. У всех испытуемых были неизлечимые заболевания. Наблюдали за выделением полонии, и в это время было проведено вскрытие тела умершего пациента, чтобы определить, какие органы абсорбировали полоний. Возраст наблюдировался от 30 до 40 лет. Эксперименты были в начале 3 «Биологические исследования с полонием, радием и плутонием», National Nuclear Energy Series, Volume VI-3, McGraw-Hill, New York, 1950. Не указан изотоп, изучается, но в то время полоний -210 был наиболее доступным изотопом полония. В информационном бюллетене Министерства энергетики, представлен для этого эксперимента, не сообщалось о последнем наблюдении за этим субъектом.
Также было высказано предположение, что Ирен Жолио-Кюри был первым человеком, умершим от радиационного воздействия полония. Она случайно подверглась воздействию полония в 1946 году, когда запечатанная капсула с ее лабораторным лабораторным тестом. В 1956 году она умерла от лейкемии.
Согласно книге 2008 года «Бомба в подвале», несколько смертей в Израиле в 1957–1969 годах были вызваны По. Утечка была обнаружена в лаборатории института Вейцмана в 1957 году. Следы По были обнаружены в руках профессора Дрора Сада, физика, исследовавшего радиоактивные материалы. Медицинские анализы не показали никакого вреда, но костный мозг не исследовался. Садех умер от рака. Один из его учеников умер от лейкемии, а двое его коллег умерли через несколько лет, оба от рака. Проблема расследовалась тайно, и никогда не было официальной признания того, что связь между утечкой информации и смертями существовала.
Причина смерти в убийстве 2006 г. из Александр Литвиненко, российский агент ФСБ, перешедший на сторону британской разведки МИ6, был признан отравлением По. По словам профессора Ника Приста из Миддлсекского университета, токсиколога-эколога и эксперта по радиации, выступая на Sky News 3 декабря 2006 г., Литвиненко, вероятно, был первым человек умереть от острого α-радиационного воздействия.
В июле 2012 года в одежде и личных вещах лидера Палестины были обнаружены аномально высокие показатели Po. Ясир Арафат, заядлый курильщик, умерший 11 ноября 2004 г. по неустановленным причинам. Представитель Института радиофизики в Лозанне, Швейцария, где эти предметы были проанализированы, согласны, что «клинические симптомы, описанные в медицинских отчетах Арафата, не соответствовали полонию-210, и что нельзя сделать выводы о том, был ли палестинский лидер отравлен он или нет», и что «единственная возможность подтвердить выводы - это эксгумировать тело Арафата, чтобы проверить его на полоний-210». 27 ноября 2012 года были взяты образцы отдельного анализа экспертами из Франции, Швейцарии и России. 12 октября 2013 года The Lancet опубликовал результаты исследования группы, согласно которым высокие уровни этого элемента были обнаружены в крови, моче Арафата и в его зубной щетке. Позже французские испытания показывают количество полония, но заявили, что он «естественного происхождения из окружающей среды». После более поздних тестов в России Владимир Уиба, глава Федерального мед-биологического агентства России, заявил в декабре 2013 года, что Арафат умер естественной смертию, и у них нет планов проводить дальнейшие тесты.
Было высказано предположение, что хелатирующие агенты, такие как British Anti-Lewisite (димеркапрол ), можно использовать для дезактивации людей. В одном эксперименте крысам давали смертельную дозу 1,45 МБк / кг (8,7 нг / кг) Po; все необработанные крысы умерли через 44 дня, но 90% крыс, получавших хелатирующий агент HOEtTTC, остались живы в течение 5 месяцев.
Полоний-210 можно количественно определить в образцах биологических образцов с помощью спектрометрии альфа-частиц для подтверждения отравления госпитализированных пациентов или для предоставления доказательств в судебно-медицинском расследовании смерти. Базовая экскреция полония-210 с мочой у здоровых людей из-за воздействия источников окружающей среды обычно находится в диапазоне 5-15 мБк / день. Уровни, превышающие 30 мБк / день, указывают на чрезмерное воздействие радионуклида.
Полоний-210 широко распространен в биосфере, в том числе в тканях человека из-за его положения в цепочке распада урана-238. Природный уран-238 в земной коре распадается через серию твердых радиоактивных промежуточных продуктов, включая радий-226, в радиоактивный благородный газ радон-222, некоторые из которых в течение 3,8-дневного периода полураспада диффундируют в атмосферу. Там он распадается еще на несколько стадий до полония-210, большая часть которого в течение 138-дневного периода полураспада смывается обратно на поверхность Земли, попадая в биосферу, прежде чем окончательно распасться до стабильного свинца-206..
Еще в 1920-х годах французский биолог [fr ], используя полоний, предоставленный его коллегой Мари Кюри, показал, что этот элемент имеет специфический характер поглощения тканями кролика, с высокими концентрациями, особенно в печени, почках и семенниках. Более свежие данные свидетельствуют о том, что такое поведение является результатом замещения полонием родственной ему серы, также входящей в группу 16 Периодической таблицы, в серосодержащих аминокислотах или родственных молекулах, и что аналогичные закономерности распределения наблюдаются в тканях человека. Полоний действительно является элементом, который естественным образом присутствует у всех людей и вносит заметный вклад в естественную фоновую дозу, с широкими географическими и культурными вариациями, и особенно высокими уровнями, например, у жителей Арктики. 25>в табаке является причиной многих случаев рака легких во всем мире. Большая часть этого полония получена из свинца-210, осажденного на листьях табака из атмосферы; свинец-210 является продуктом газообразного радона-222, большая часть которого, по-видимому, возникает в результате распада радия-226 из удобрений, внесенных в табачные почвы.
498>Присутствие полония в табачном дыме известно с начала 1960-х годов. Некоторые из крупнейших табачных фирм мира безуспешно изучали способы удаления этого вещества в течение 40 лет. Результаты никогда не публиковались.Полоний содержится в пищевой цепи, особенно в морепродуктах.
| На Викискладе есть материалы, связанные с Полонием. |
| Найдите Полоний в Викисловаре, бесплатном словаре. |