| Брахитерапия | |
|---|---|
 Стрелка указывает на брахитерапию, используемую для лечения рака простаты. Стрелка указывает на брахитерапию, используемую для лечения рака простаты. | |
| Другие названия | внутренняя лучевая терапия, лучевая терапия с закрытым способом куриотерапия, эндокуретерапия |
| ICD-10-PCS | D ?1 |
| ICD-9-CM | 92.27 |
| MeSH | D001918 |
| [редактировать в Викиданных ] | |
Брахитерапия - это форма лучевой терапии, при которой герметичный источник излучения размещается внутри или рядом с областью, требующей лечения. Брахи - это греческое для краткости. Брахитерапия обычно используется в качестве эффективного лечения рака шейки матки, простаты, груди, рака пищевода и рака кожи и также может установка для лечения опухолей многих других участков тела. Результаты лечения показали, что показатели лечения рака от брахитерапии либо сопоставимы с хирургическим вмешательством и дистанционной лучевой терапией (ДЛТ), либо повышаются при использовании с этими методами. Брахитерапию можно использовать отдельно или в сочетании с другими методами лечения, такими как хирургия, EBRT и химиотерапия.
Брахитерапия отличается от лучевой терапии с открытием, в которой терапевтический радионуклид (радиоизотоп) вводится в организм для химической локализации ткани, требующей разрушения. Это также отличается от EBRT, при котором рентгеновские лучи высокой энергии (или иногда гамма-лучи от радиоизотопа, такого как кобальт-60 ) направляются на опухоль извне. Вместо этого брахитерапия включает размещение источников ближнего действия (например, радиоизотопов йод-125 или цезий-131 ) непосредственно на месте злокачественной опухоли. Они заключены в защитную капсулу или проволоку, которая позволяет ионизирующему излучению выходить для лечения и уничтожения окружающих тканей, но предотвращает перемещение или растворение заряда радиоизотопа в жидкостях организма. Капсула может быть удалена позже или (с некоторыми радиоизотопами) ей можно остаться на месте.
Особенности брахитерапии является то, что облучение воздействует только на очень локализованную область вокруг источников излучения. Таким образом излучением излучения на здоровые ткани, находящиеся дальше от источников. Кроме того, источник сохраняет свое правильное положение по отношению к опухоли. Эти характеристики брахитерапии обеспечивают преимущества перед ДЛТ - опухоль можно лечить очень высокими дозами локализованного излучения, сниженная при этом вероятность повреждения окружающих здоровых тканей.
Курс брахитерапии может быть завершен за меньшее время, чем другие методы лучевой терапии. Это может помочь снизить вероятность деления и роста выживших раковых клеток в промежутках между каждой дозой лучевой терапии. Пациенты, как правило, должны меньше посещать клинику лучевой терапии по сравнению с ДЛТ и могут получать лечение амбулаторно. Это делает лечение доступным и популярным среди многих пациентов. Эти особенности брахитерапии означают, что другие пациенты очень хорошо переносят брахитерапии.
В 2013 году мировой рынок брахитерапии достиг 680 миллионов долларов США, из которых на сегменты высокой мощности (HDR) и LDR приходилось 70%. Остальные 30% составили микросферы и электронная брахитерапия. Согласно одному анализу, к 2030 году рынок брахитерапии может достичь более 2,4 миллиарда долларов США, ежегодно увеличиваясь на 8%, в основном за счет рынка микросфер, а также электронной брахитерапии, которая вызывает значительный интерес во всем мире как удобная для пользователей технология.
 Участки тела, на брахитерапия может быть лечение для лечения рака.
Участки тела, на брахитерапия может быть лечение для лечения рака. Брахитерапия обычно используется для лечения рака шейки матки, предстательной железы, груди и кожи.
Брахитерапия также может быть при лечении опухолей мозг, глаз, область головы и шеи (губа, дно, язык, носоглотка и ротоглотка ), дыхательные пути (трахея и бронхи ), пищеварительный тракт (пищевод, желчный пузырь, желчные протоки, прямая кишка, анус ), мочевыводящие пути (мочевой пузырь, уретра, половой член ), женские половые пути (матка, влагалище, вульва ) и мягкие ткани.
Доставка лазера на небольшую площадь. Кроме того, они показывают свое положение по отношению к опухоли при движении пациента или при любом движении опухоли внутри тела. Таким образом, источником излучения остается точно нацеленными. Это позволяет клиницистам достичь высокого уровня дозировки, то есть обеспечить получение всей опухоли оптимального уровня излучения. Это также снижает риск повреждения тканей органов.
Использование HDR-брахитерапии позволяет сократить общее время лечения с EBRT. Пациенты, получающие брахитерапию, обычно должны меньше посещать для лучевой терапии по сравнению с EBRT, и общие планы лучевой терапии могут быть выполнены за меньшее время. Многие процедуры брахитерапии выполняются в амбулаторных условиях. Это может быть особенно актуально для пожилых людей, находящихся на некотором расстоянии от лечебных центров, чтобы обеспечить им доступ к терапии и соблюдение планов лечения. Более короткие сроки лечения и амбулаторные процедуры также могут помочь повысить эффективность клиник лучевой терапии.
Брахитерапия может вызвать рак излечения в случаях небольших или местнораспространенных опухолей, при условии, что рак не метастазировал (распространился). к другим частям тела). Аналогичным образом подобранный подход к лечению. Однако при местнораспространенных опухолях хирургическое вмешательство не всегда дает наилучшие шансы на излечение и часто технически невозможно выполнить. В этих случаях лучевая терапия, включая брахитерапию, является единственным шансом на излечение. На более поздних стадиях заболевания брахитерапия может быть знакомство в качестве паллиативного лечения для облегчения симптомов боли и кровотечения.
В случаях, когда опухоль труднодоступна или слишком велика, чтобы обеспечить оптимальное распределение в области лечения, брахитерапию можно комбинировать с другими видами лечения, такими как ДЛТ и / или хирургическое вмешательство. Комбинированная терапия брахитерапией исключительно с химиотерапией встречается редко.
Брахитерапия обычно используется для лечения раннего или локально локализованного рака шейки матки и стандартом лечения во многих странах. Рак шейки матки можно лечить с помощью брахитерапии LDR, PDR или HDR. При использовании в сочетании с брахитерапией EBRT может обеспечить лучшие результаты, чем только EBRT. Точность брахитерапии позволяет доставить тепловое излучение к шейке матки, сводя к минимуму радиационное воздействие на соседние ткани и органы.
Шансы на то, чтобы не заболеть (выжить без болезней) и остаться (общая выживаемость) аналогичны для лечения LDR, PDR и HDR. Однако основным преимуществом лечения HDR является то, что каждая дозу может вводить амбулаторно с коротким временем введения, что обеспечивает большее удобство для многих пациентов.
Исследования показывают, что местнораспространенный рак шейки матки необходимо лечить с помощью комбинации дистанционной лучевой терапии (ДЛТ) и внутриполостной брахитерапии (ICBT).
Брахитерапия для лечения рака простаты может проводиться либо как постоянная имплантация семян LDR, либо как временная брахитерапия HDR.
Постоянная имплантация семян подходит для пациентов с локализованной опухолью и хорошим прогнозом, и было показано, что он является высокоэффективным методом лечения, предотвращающим повторение рака. Показатель выживаемости аналогичен показателю при EBRT или хирургическом вмешательстве (радикальная простатэктомия ), но с меньшим побочными эффектами, таких как импотенция и недержание мочи. Процедура может быть завершена быстро, и пациенты обычно могут вернуться домой в тот же день лечения и вернуться к нормальной деятельности через 1-2 дня. Постоянная имплантация семян является менее инвазивным частым лечением по с хирургическим удалением простаты.
Временная брахитерапия HDR - это новый подход к лечению рака простаты, но в настоящее время он менее распространен, чем имплантация семян. Он используется для дополнительной дополнительной мощности в дополнение к EBRT (известной как «бустерная» терапия), поскольку используется альтернативный метод доставки высокой лучевой терапии, соответствует форме опухоли в простате, при щадя радиационное воздействие на окружающие ткани. Брахитерапия HDR как стимул для лечения рака простаты также означает, что курс EBRT может быть короче, чем при использовании только EBRT.
Лучевая терапия является стандартным лечением для женщин, перенесших лампэктомия или мастэктомия операция и неотъемлемым компонентом терапии по сохранению груди. Брахитерапию можно использовать после операции, перед химиотерапией или паллиативно в случае запущенного заболевания. Брахитерапия для лечения рака груди обычно проводится с помощью временной брахитерапии HDR. Послеоперационная брахитерапия Награда в качестве «стимула» после облучения всей груди (WBI) с использованием EBRT. В последнее время для доставки APBI (ускоренного частичного облучения груди) используется только брахитерапия, включая доставку только в непосредственную область, исходную опухоль.
Основное преимущество брахитерапии груди по сравнению с облучением всей груди в том, что высокая доза радиации может быть точно на опухоль, сохраняя при этом радиацию здоровых тканей и нижних структур, таких как ребра и легкие. APBI обычно можно заполнить в течение недели. Вариант брахитерапии может быть особенно важен для обеспечения того, чтобы работающие женщины, пожилые люди или женщины, не имеющие доступа к лечебным центру, могли получить от терапии с сохранением груди из-за короткого курса лечения по сравнению с WBI (который часто требует большего количества посещений. в течение 1-2 месяцев).
Существует пять методов, которые можно использовать для проведения брахитерапии груди: интерстициальная брахитерапия груди, интраполостная брахитерапия груди, интраоперационная лучевая терапия, постоянная имплантация грудных семян и неинвазивная терапия груди брахитерапия с использованием маммографии для цели и источника HDR.
Интерстициальная брахитерапия груди включает временное размещение нескольких гибких пластиковых катетеров в ткани груди. Они тщательно защищены, чтобы обеспечить оптимальное нацеливание на обрабатываемую область при сохранении окружающей ткани груди. Катеры подключены к устройству инициирования, которое доставляет запланированное дозу облучения в зоне лечения. Интерстициальная брахитерапия Награда за «знакомство» после ДЛТ или как APBI.
Интраоперационная лучевая терапия (ИОЛТ) предусматривает облучение одновременно с операцией по удалению опухоли. опухоль (лампэктомия). Аппликатор помещается в полость, оставшуюся после удаления опухоли, и мобильное электронное устройство генерирует излучение (рентгеновские лучи или электроны) и доставляет его через аппликатор. Радиация подается сразу, и аппликатор удаляется перед закрытием разреза.
Внутриполостная брахитерапия груди (также известная как «баллонная брахитерапия») включает размещение одного катетера в полости, оставшейся после удаления опухоли (лампэктомия). Катетер можно установить во время лампэктомии или после операции. Затем через катетер в полость надувается баллон. Затем катетер подключается к устройству первой загрузки, которое доставляет излучение через катетер в баллон. В настоящее время внутриполостная брахитерапия груди обычно используется только при APBI.
Существуют также устройства, сочетающие в себе функции интерстициальной и внутриполостной брахитерапии груди (например, SAVI). В этих устройствах используется несколько катетеров, но они вводятся через единственную точку входа в грудь. Исследования показывают, что несколько катетеров позволяет врачам более точно нацеливать использование излучения.
Постоянная имплантация грудных семян (PBSI) имплантирует множество радиоактивных «семян» (маленьких гранул) в грудь в области, окружающей области опухоли, аналогично брахитерапии простаты семенами. Семена имплантируются за одну 1-2 часа и в течение следующих месяцев излучают радиацию, поскольку радиоактивный материал внутри них распадается. Риск облучения от имплантатов другим людям (например, партнеру / супругу) был изучен и признан безопасным.
Хирургическая направленная лучевая терапия (STaRT), иначе известная как GammaTile Therapy - это новый тип имплантата для брахитерапии, специально разработанный для использования внутри мозга. GammaTile одобрен FDA для лечения недавно диагностированных качественных злокачественных новообразований (например, опухолей головного мозга) и рецидивирующих внутричерепных новообразований, включая менингиомы, метастазы, глиомы высокой степени злокачественности и глиобластомы.
В клиническом исследовании, Терапия GammaTile улучшил местный контроль по сравнению с предыдущим лечением на том же месте без повышенного риска побочных эффектов.
Для пищевода лучевая терапия брахитерапия является одним из методов лечения. Вариант эффективного лечения включает окончательную лучевую терапию (усиление) или паллиативное лечение. Окончательная лучевая терапия (импульсная терапия) может обеспечить точную дозировку, а для облегчения дисфагии может быть назначено паллиативное лечение. Аппликаторы большого диаметра или катетер баллонного типа используются для улучшения пищевода, дозы облучения опухоли с сохранением близлежащих нормальных тканей.
Было показано, что брахитерапия с помощью ДЛТ или хирургическим вмешательством может улучшить выживаемость, частота и частоту рецидивов, чем ДЛТ или хирургическое вмешательство, только у пациентов с раком пищевода.
Брахитерапия HDR для немеланоматозного рака кожи, например базальноклеточной карциномы и плоскоклеточная карцинома является альтернативным хирургическим лечением. Это особенно актуально для носа рака, ушей, век или губ, когда операция может привести к обезображиванию или потребовать обширной реконструкции. Для обеспечения точной доставки оптимальной дозы облучения используются поставки через Интернет, которые обеспечивают точную доставку оптимальной дозы облучения.
Брахитерапия при раке кожи обеспечивает хорошие косметические результаты и клиническая эффективность; исследования с последующим наблюдением до 5 лет показали, что брахитерапия очень эффективна с точки зрения местного контроля и сравнима с ДЛТ. Время лечения обычно короткое, что обеспечивает удобство для пациентов. Было высказано предположение, что брахитерапия может стать стандартом лечения рака кожи в ближайшем будущем.
Брахитерапия может использоваться при лечении рестеноза коронарных артерий в стенте., при котором внутри кровеносных сосудов помещается катетер, через который вводятся и удаляются источники. Было обнаружено, что при лечении рестеноза In-стента (ISR) стенты с лекарственным покрытием (DES) превосходят интракоронарную брахитерапию (ICBT). Тем не менее, сохраняется интерес к сосудистой брахитерапии при стойком рестенозе поврежденных стентов и венозных трансплантатов. Терапия также была исследована для использования при лечении стеноза периферических сосудов и рассмотрена для лечения фибрилляции предсердий.
Вероятность и природа потенциально острого Подострые или долгосрочные побочные эффекты, связанные с брахитерапией, зависят от локализации опухоли, подвергаемой лечению, и типа используемой брахитерапии.
Острые побочные эффекты, связанные с брахитерапией, включают локализованные синяки, отек, кровотечение, выделения или дискомфорт в имплантированной области. Обычно они проходят в течение нескольких дней после завершения лечения. Пациенты также могут чувствовать усталость в течение короткого периода после лечения.
Брахитерапия при раке шейки матки или простаты может вызвать острые и преходящие симптомы мочеиспускания, такие как задержка мочи, недержание мочи или болезненное мочеиспускание (дизурия). Также могут возникнуть преходящее учащение кишечника, диарея, запор или незначительное ректальное кровотечение. Острые и подострые побочные эффекты обычно проходят в течение нескольких дней или нескольких недель. В случае постоянной (посевной) брахитерапии рака простаты существует небольшая вероятность того, что некоторые семена могут мигрировать из области лечения в мочевой пузырь или уретру и выйти с мочой.
Брахитерапия при раке кожи может привести к отслаиванию внешних слоев кожи (шелушению) вокруг области лечения в течение нескольких недель после терапии, которая обычно заживает в течение 5–8 недель. Если рак находится на губе, язвы могут возникнуть в результате брахитерапии, но обычно проходят через 4–6 недель.
Большинство острых побочных эффектов, связанных с брахитерапией, можно лечить с помощью лекарств или с помощью диеты. изменяется и обычно исчезает со временем (обычно в течение нескольких недель) после завершения лечения. Острые побочные эффекты HDR-брахитерапии в целом аналогичны EBRT.
У небольшого числа людей брахитерапия может вызывать долгосрочные побочные эффекты из-за повреждения или разрушения соседних ткани или органы. Долгосрочные побочные эффекты обычно легкие или умеренные. Например, проблемы с мочеиспусканием и пищеварением могут сохраняться в результате брахитерапии при раке шейки матки или простаты и могут потребовать постоянного лечения.
Брахитерапия при раке простаты может вызвать эректильную дисфункцию примерно у 15-30% пациентов. Однако риск эректильной дисфункции связан с возрастом (пожилые мужчины подвергаются большему риску, чем молодые мужчины), а также с уровнем эректильной функции до получения брахитерапии. У пациентов, которые действительно испытывают эректильную дисфункцию, в большинстве случаев можно успешно лечить с помощью таких препаратов, как Виагра. Важно отметить, что риск эректильной дисфункции после брахитерапии меньше, чем после радикальной простатэктомии.
Брахитерапия при раке груди или кожи может привести к образованию рубцовой ткани вокруг области лечения. В случае брахитерапии груди некроз жира может возникнуть в результате попадания жирных кислот в ткани груди. Это может вызвать опухание и болезненностьтканей груди. Некроз жировой ткани является доброкачественным заболеванием и обычно возникает через 4–12 месяцев после лечения и исследования около 2% пациентов.
Пациенты часто спрашивают, нужны ли им особые меры предосторожности. семья и друзья после брахитерапии. Если используется временная брахитерапия, после лечения в организме не остается радиоактивных источников. Следовательно, нет радиационного риска для друзей или семьи из-за близости с ними.
Если используется постоянная брахитерапия, низкие дозы радиоактивных источников (семена) остаются в теле после лечения - уровни радиации очень низкий и со временем уменьшается. Кроме того, облучение влияет только на ткани в пределах нескольких миллиметров от радиоактивных источников (то есть опухоли, позвоней лечению). В качестве меры предосторожности некоторым, получающим постоянную брахитерапию, можно посоветовать не держать маленьких детей или находиться слишком близко к беременным женщинам в течение короткого времени после лечения. Онкологи-радиологи или медсестры могут дать пациенту инструкции и посоветовать, как долго им следует соблюдать осторожность.
Различные типы брахитерапии могут быть использованы в соответствии с (1) размещение источников излучения в целевой области лечения, (2) скорость или «интенсивность» дозы облучения, доставленной в опухоль, и (3) продолжительность доставки дозы.
Двумя через типами брахитерапевтического лечения с точки зрения размещения радиоактивного источника являются интерстициальный и контактный.
В случае интерстициальной брахитерапии источники размещаются в ткани-мишени пораженного участка, например, в простате или груди.
Контактная брахитерапия включает размещение источника излучения в пространство рядом с тканью. Это пространство может быть полостью тела (внутриполостная брахитерапия), такой как шейка матки, матка или влагалище ; просвет тела (внутрипросветная брахитерапия), такой как трахея или пищевод ; или наружно (поверхностная брахитерапия), например, кожа. Источник излучения также может быть помещен в кровеносные сосуды (внутрисосудистая брахитерапия) для лечения рестеноза коронарных артерий в стенте.
Мощность дозы при брахитерапии относится к уровню или «плотности», с которой излучение доставляется в новой среде, и выражается в грей в час (Гр / ч).
Брахитерапия с низкой мощностью (LDR) включает имплантацию источников излучения, излучающих со скоростью до 2 Гр · ч. Брахитерапия LDR используется для лечения рака полости рта, ротоглотки, сарком и рака простаты
Брахитерапия со средней мощностью дозы (MDR) обычно соответствует средней скорости доза составляет от 2 Гр. · Ч до 12 Гр · ч.
Брахитерапия с высокой мощностью дозы (HDR) - это когда скорость доставки превышает 12 Гр · ч. Чаще всего HDR-брахитерапия применяется при опухолях шейки матки, пищевода, легких, груди и простаты <3.>. Большинство процедур HDR проводится амбулаторно, но это зависит от места лечения.
Брахитерапия с импульсной мощностью (PDR) включает короткие импульсы излучения, обычно один раз в час, для моделирования общей скорости и эффективности лечения LDR. Типичными участками опухоли, лечимыми с помощью PDR-брахитерапии, являются гинекологические опухоли и рак головы и шеи.
Размещение источников излучения в целевой области может быть временным или постоянным.
Временная брахитерапия включает размещение источников излучения на определенное время (обычно несколько минут или часов) перед их снятием. Конкретная продолжительность лечения будет зависеть от различных факторов, включая необходимую скорость доставки и тип, размер и локализацию рака. В брахитерапии LDR и PDR обычно остается на месте до 24 часов перед удалением, в то время как при брахитерапии HDR это время обычно составляет несколько минут.
Постоянная брахитерапия, также известная как имплантация семян, включает размещение радиоактивных семян или гранулы LDR (размером с зерно зерно) в опухоли или на участке лечения и оставляют там навсегда, чтобы постепенно разлагаться. Через несколько недель или месяцев уровень излучения снизится почти до нуля. После этого неактивные семена на участке без длительного эффекта. Постоянная брахитерапия чаще всего используется при лечении рака простаты.
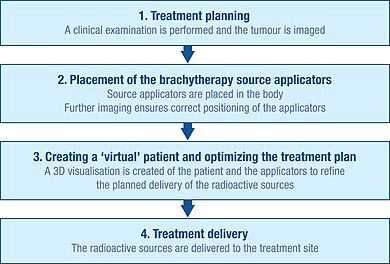 Типичные этапы процедуры брахитерапии.
Типичные этапы процедуры брахитерапии. Чтобы точно спланировать брахитерапии, тщательное клиническое обследование проводит для понимания характеристик опухоли. Кроме того, для визуализации и размера опухоли и ее связи с окружающими тканями можно использовать ряд методов визуализации. К ним защищенная рентгенография, ультразвуковая, компьютерная аксиальная томография (КТ или CAT) и магнитно-резонансная томография (МРТ). Данные из этих источников можно использовать для создания трехмерной визуализации опухоли и окружающих тканей.
Используя эту информацию, можно разработать план оптимального распределения излучения. Сюда входит аппликаторы, которые размещены для доставки к месту лечения. Аппликаторы нерадиоактивны и обычно выделяют собой иглы или пластиковые катетеры. Конкретный тип используемого аппликатора будет зависеть от типа рака, позвоночного лечения, и характеристики опухоли.
Это предварительное планирование обеспечивает наличие «холодных точек» (слишком слабое облучение) и «горячих точек». (слишком сильного облучения), так как это может привести к неэффективности лечения и побочным эффектом.
Прежде чем радиоактивные источники могут быть доставлены к месту опухоли, аппликаторы должны быть вставлены и правильно установлены в соответствии с исходным планом.
Методы визуализации, такие как рентген, рентгеноскопия и ультразвук, обычно используются, чтобы помочь направить размещение аппликаторов в правильное положение и подробно уточнить лечение. Также можно использовать компьютерную томографию и МРТ. После того, как аппликаторы вставлены, они удерживаются на месте на коже с помощью швов или липкой ленты, чтобы предотвратить их перемещение. После подтверждения правильности положения аппликаторов можно выполнить дальнейшую визуализацию для подробного планирования лечения.
 Создание виртуального пациента для планирования проведения брахитерапии.
Создание виртуального пациента для планирования проведения брахитерапии. Изображения пациента с аппликаторами на месте импортируются программное обеспечение для планирования лечения, и помещают в специальную экранированную комнату для лечения. Программное обеспечение для планирования лечения позволяет преобразовать несколько изображений участка лечения в трехмерном «виртуального пациента», в котором можно определить положение аппликаторов. Пространственные отношения между аппликаторами, участком лечения и окружающими здоровыми тканями в этом «виртуальном пациенте» являются копией отношений в реальном пациенте.
 Уточнение плана лечения во время процедуры брахитерапии.
Уточнение плана лечения во время процедуры брахитерапии. Для определения оптимального пространственного и временного распределения излучения внутри аппликаторов имплантированной ткани или области программного обеспечения планирования лечения позволяет виртуально излучение, размещаемые внутри виртуального пациента. Программное обеспечение показывает графическое представление распределения излучения. Это служит руководством для команды брахитерапии по уточнению распределения и предоставления услуг, оптимально адаптированного к анатомии каждого пациента, до того, как начнется фактическая доставка облучения. Этот подход иногда называют «дозированием».
Источники излучения, использованные для брахитерапии, всегда заключены в нерадиоактивную капсулу. Источники могут быть доставлены вручную, но чаще всего их доставляют с помощью метода, известного как «постзагрузка».
Ручное проведение брахитерапии ограничено применением ЛДР из-за риска радиационного облучения медицинского персонала.
Нап, постнагрузка предполагает точное позиционирование нерадиоактивных аппликаторов во время лечения площадки, которые загружаются источниками излучения. При ручной загрузке источник загружается в аппликатор оператором.
Системы удаленной нагрузки защиты медицинских работников от радиационного воздействия за счет источника излучения в защищенном сейфе. После того, как аппликаторы правильно размещены в пациенте, они подключаются к машине «вторичной загрузки» через серию соединительных направляющих трубок. План лечения отправляет систему доставки по направляющим трубкам в заданные положения внутри аппликатора. Этот процесс начинается только после того, как персонал удален из процедурного кабинета. Источники остаются на месте в течение определенного периода времени, опять же в соответствии с планом лечения, после чего они возвращаются по трубам в устройстве первого запуска.
По завершении доставки радиоактивных источников аппликаторы осторожно извлекаются из тела. Пациенты обычно быстро восстанавливаются после процедур брахитерапии, что позволяет часто проводить ее в амбулаторных условиях.
В период с 2003 по 2012 год в общественных больницах США частота в больницах с брахитерапией (внутренняя лучевая терапия) составляющая в среднем 24,4 процента. ежегодное снижение среди взрослых в возрасте 45–64 лет и среднегодовое снижение на 27,3 процента среди взрослых в возрасте 65–84 лет. Брахитерапия была операцией с наибольшим изменением частоты пребывания в больницах, оплачиваемых Medicare и частным страхованием.
Обычно используемые источники (радионуклиды) для брахитерапии.
| Радионуклиды | Тип | Период полураспада | Энергия |
|---|---|---|---|
| Цезий-131 (Cs) | Захват электронов, ε | 9,7 дней | 30,4 кэВ (среднее) |
| Цезий-137 (Cs) | β-частицы, γ-лучи | 30,17 года | 0,512, 0,662 МэВ γ-кванты |
| Кобальт-60 (Co) | β-частицы, γ-лучи | 5,26 года | 1,17, 1,33 МэВ γ-лучи |
| Иридий-192 (Ir) | γ-лучи | 73, 8 дней | 0,38 МэВ (среднее) |
| Йод- 125 (I) | Захват электронов, ε | 59,6 дней | 27,4, 31,4 и 35,5 кэВ |
| Палладий-103 (Pd) | Захват электронов, ε | 17,0 дней | 21 кэВ (среднее) |
| Рутений-106 (Ru) | β- частицы | 1,02 года | 3,54 МэВ |
| Радий-226 (Ra) | α-частицы | 1599 лет |
Брахитерапия восходит к 1901 году (вскоре после открытия радиоактивности Анри Беккерелем в 1896 году), когда Пьер Кюри предложил H Энри-Александр Данлос, что радиоактивный источник может быть вставлен в опухоль. Было обнаружено, что радиация заставила опухоль сморщиться. Независимо, Александр Грэм Белл также предложил использовать радиацию таким образом. В начале двадцатого века методы применения брахитерапии были впервые применены в Институте Кюри в Париже Данлосом и в больнице Святого Луки и Мемориальной больнице в Нью-Йорке Робертом Аббе.
Интерстициальная лучевая терапия была распространена в 1930-х годах. Золотые семена, наполненные радоном, использовались с 1942 года по крайней мере до 1958. Золотые раковины были выбраны Джино Фаилла около 1920 года для защиты бета-лучей при прохождении гамма-лучи. Кобальтовые иглы также недолго использовались после Второй мировой войны. Радон и кобальт были заменены радиоактивным танталом и золотом, прежде чем иридий стал заметным. Впервые использованный в 1958 году, иридий сегодня является наиболее часто используемым искусственным источником для брахитерапии.
После первоначального интереса к брахитерапии в Европе и США его использование сократилось в середине двадцатого века из-за проблемы радиации. облучение операторов от ручного применения радиоактивных источников. Однако разработка систем удаленной последующей нагрузки, которые позволяют доставлять излучение из экранированного сейфа, и использование новых радиоактивных источников в 1950-х и 1960-х годах снизили риск ненужного облучения оператора. и пациенты. Это, вместе с последними достижениями в области методов трехмерной визуализации, компьютеризированных систем планирования лечения и оборудования для доставки, сделало брахитерапию безопасным и эффективным методом лечения многих типов рака сегодня.
Слово «брахитерапия» происходит от Греческое слово βραχύς brachys, означающее «ближний» или «короткий».
Из-за небольшого размера источников брахитерапии и низкого контроля в первые десятилетия существует риск того, что некоторые из них ускользнули в окружающую среду и стали бесхозными источниками. В 2011 году на детской площадке в Праге была обнаружена радиевая игла, излучающая 500 мкЗв / ч на расстоянии одного метра.
| Найдите брахитерапию в Викисловаре, бесплатном словаре. |