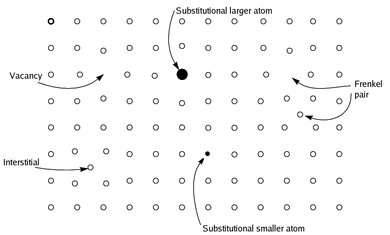
 Происхождение явления названия в кристаллографических дефектах. Показан двумерный срез примитивная кубическая кристаллическая система, показывающая регулярный квадратный массив атомов на одной стороне (белые кружки, o), и с ними места, где атомы отсутствуют в регулярном узле для создания вакансий, смещены на соседний приемлемый пространство для создания пары Френкеля , или заменены атомами меньшего или большего размера, которые обычно не видны (закрашенные кружки, •), в каждом случае в результате получается материал, который становится заметно нестехиометрическим.
Происхождение явления названия в кристаллографических дефектах. Показан двумерный срез примитивная кубическая кристаллическая система, показывающая регулярный квадратный массив атомов на одной стороне (белые кружки, o), и с ними места, где атомы отсутствуют в регулярном узле для создания вакансий, смещены на соседний приемлемый пространство для создания пары Френкеля , или заменены атомами меньшего или большего размера, которые обычно не видны (закрашенные кружки, •), в каждом случае в результате получается материал, который становится заметно нестехиометрическим. Нестехиометрические соединения представляют собой химические соединения, почти всегда твердые неорганические соединения, имеющие элементный состав, пропорции которых не могут быть представлены с помощью небольшого натуральные числа ; чаще всего в таких материалах отсутствует небольшой процент атомов или слишком много атомов упаковано в идеальную решетку.
Вопреки более ранним определениям, современное понимание нестехиометрических соединений рассматривает их как однородные, а не смеси стехиометрических химических соединений. Поскольку твердые тела в целом электрически нейтральны, дефект компенсируется изменением заряда других атомов в твердом теле, либо изменением их степени окисления, либо заменой их атомами различных элементов с другим зарядом. Многие оксиды и сульфиды металлов имеют нестехиометрические примеры; например, стехиометрический оксид железа (II), который встречается редко, имеет формулу FeO, тогда как более распространенный материал нестехиометрический с формулой Fe 0,95 O. Тип равновесных дефектов в нестехиометрических соединениях может изменяться с соответствующим изменением объемных свойств материала. Нестехиометрические соединения также проявляют особые электрические или химические свойства из-за дефектов; например, при отсутствии атомов электроны могут двигаться через твердое тело быстрее. Нестехиометрические соединения находят применение в керамических и сверхпроводящих материалах и в конструкции электрохимических (то есть аккумулятор ) систем.
.
Нестехиометрия характерна для оксидов металлов , особенно когда металл не находится в самой высокой степени окисления. Например, хотя вюстит (закись железа ) имеет идеальную (стехиометрическую ) формулу FeO, фактическая стехиометрия ближе к Fe 0,95 О. Нестехиометрия отражает легкость окисления Fe до Fe, эффективно заменяя небольшую часть Fe на две трети их количества Fe. Таким образом, на каждые три «недостающих» иона Fe кристалл содержит два иона Fe, чтобы сбалансировать заряд. Состав нестехиометрического соединения обычно изменяется непрерывно в узком диапазоне. Таким образом, формула для вюстита записывается как Fe 1-x O, где x - небольшое число (0,05 в предыдущем примере), представляющее отклонение от «идеальной» формулы. Нестехиометрия особенно важна для твердых трехмерных полимеров, допускающих ошибки. В некоторой степени энтропия заставляет все твердые тела быть нестехиометрическими. Но для практических целей этот термин описывает материалы, нестехиометрия которых поддается измерению, обычно не менее 1% от идеального состава.
 пирротин, пример нестехиометрического неорганического соединения с формулой Fe 1-x S (x = от 0 до 0,2).
пирротин, пример нестехиометрического неорганического соединения с формулой Fe 1-x S (x = от 0 до 0,2). Моносульфиды переходных металлов часто нестехиометричны. Наиболее известным, вероятно, является номинально сульфид железа (II) (минерал пирротин ) с составом Fe 1-x S (x = от 0 до 0,2). Редкий стехиометрический концевой элемент FeS известен как минерал троилит. Пирротин примечателен тем, что имеет множество политипов, т.е. кристаллических форм, различающихся симметрией (моноклинная или гексагональная ) и составом (Fe 7S8, Fe 9S10, Fe 11S12и другие). В этих материалах всегда присутствует дефицит железа из-за наличия дефектов решетки, а именно вакансий железа. Несмотря на эти дефекты, состав обычно выражается как отношение больших чисел, а симметрия кристаллов относительно высока. Это означает, что вакансии железа не разбросаны по кристаллу случайным образом, а образуют определенные регулярные конфигурации. Эти вакансии сильно влияют на магнитные свойства пирротина: магнетизм увеличивается с увеличением концентрации вакансий и отсутствует у стехиометрического FeS.
Гидрид палладия - нестехиометрический материал приблизительного состава PdH x (0,02 < x < 0.58). This solid conducts hydrogen by virtue of the mobility of the hydrogen atoms within the solid.
Иногда трудно определить, является ли материал нестехиометрическим или формула лучше всего представлена большими числами. Оксиды Вольфрама иллюстрируют эту ситуацию. Исходя из идеализированного материала триоксида вольфрама, можно получить ряд родственных материалов, которые слегка дефицитны по кислороду.Эти компоненты с дефицитом кислорода можно описать как WO 3− x, но на самом деле это стехиометрические виды с крупными элементарными ячейками с формулами W nO3n − 2, где n = 20, 24, 25, 40. Таким образом, последний вид можно описать с помощью стехиометрическая формула W 40O118, тогда как нестехиометрическое описание WO 2. 95 подразумевает более случайное распределение оксидных вакансий.
При высоких температурах (1000 ° C) сульфиды титана представляют собой серию не- стехиометрические соединения.
Координационный полимер берлинский синий, номинально Fe 7 (CN) 18 и их аналоги являются хорошо известны формы в нестехиометрических пропорциях. Нестехиометрические фазы проявляют полезные свойства в отношении их способности связывать ионы цезия и таллия.
Многие полезные соединения получают реакциями углеводородов с кислородом, превращение, которое катализируется оксидами металлов. Процесс осуществляется посредством переноса «решеточного» кислорода на углеводородный субстрат, на этапе, который временно создает вакансию (или дефект). На следующем этапе недостающий кислород восполняется за счет O 2. Такие катализаторы основаны на способности оксида металла образовывать нестехиометрические фазы. Аналогичная последовательность событий описывает другие виды реакций переноса атома, включая гидрирование и гидродесульфуризацию, катализируемые твердыми катализаторами. Эти соображения также подчеркивают тот факт, что стехиометрия определяется внутренней частью кристаллов: поверхности кристаллов часто не соответствуют стехиометрии объема. Сложные структуры на поверхностях описываются термином «реконструкция поверхности».
На миграцию атомов внутри твердого тела сильно влияют дефекты, связанные с нестехиометрией. Эти дефектные участки обеспечивают пути для миграции атомов и ионов через плотный ансамбль атомов, образующих кристаллы. Кислородные датчики и твердотельные батареи - два приложения, в которых используются вакансии оксидов. Одним из примеров является датчик на основе CeO 2 в автомобильных выхлопных системах. При низких парциальных давлениях O 2 датчик позволяет вводить повышенное количество воздуха для более полного сгорания.
Многие сверхпроводники нестехиометрически. Например, оксид иттрия, бария, меди, возможно, наиболее известный высокотемпературный сверхпроводник, представляет собой нестехиометрическое твердое тело с формулой Y xBa2Cu3O7-x. Критическая температура сверхпроводника зависит от точного значения x. Стехиометрический вид имеет x = 0, но это значение может достигать 1.
Это было в основном благодаря работам Николая Семеновича Курнакова и его учеников. что оппозиция Бертолле закону Пруста оказалась полезной для многих твердых соединений. Курнаков разделил нестехиометрические соединения на бертоллиды и дальтониды в зависимости от того, демонстрируют ли их свойства монотонное поведение по составу или нет. Термин бертоллид был принят ИЮПАК в 1960 году. Имена взяты от Клода Луи Бертолле и Джона Далтона соответственно, которые в 19 веке отстаивали конкурирующие теории состава веществ. Хотя Далтон по большей части «выигрывал», позже было признано, что закон определенных пропорций имел важные исключения.