 | |
 | |
| Названия | |
|---|---|
| Предпочтительное название IUPAC Этоксиэтан | |
| Другие названия диэтиловый эфир; Детер; Этиловый эфир; Этилоксид; 3-оксапентан; Этоксиэтан; Диэтилоксид; Растворитель эфирный; Серный эфир | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Ссылка Beilstein | 1696894 |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.000.425 |
| Номер EC |
|
| Справочник Gmelin | 25444 |
| KEGG | |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| номер ООН | 1155 |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C4H10O |
| Молярная масса | 74,123 г · моль |
| Внешний вид | Бесцветная жидкость |
| Запах | Сухой, Ром- вроде, сладковатый запах |
| Плотность | 0,7134 г / см, жидкость |
| Точка плавления | -116,3 ° C (-177,3 ° F; 156,8 K) |
| Точка кипения | 34,6 ° C ( 94,3 ° F; 307,8 К) |
| Итак смазывающая способность в воде | 6,05 г / 100 мл |
| log P | 0,98 |
| Давление пара | 440 мм рт.ст. при 20 ° C (58,66 кПа при 20 ° C) |
| Магнитная восприимчивость (χ) | -55,1 · 10 см / моль |
| Показатель преломления (nD) | 1,353 (20 ° C) |
| Вязкость | 0,224 сП (25 ° C) |
| Структура | |
| Дипольный момент | 1,15 D (газ) |
| Термохимия | |
| Теплоемкость (C) | 172,5 Дж / моль · K |
| Стандартный молярный. энтропия (S 298) | 253,5 Дж / моль · K |
| Стандартная энтальпия. образования (ΔfH298) | -271,2 ± 1,9 кДж / моль |
| Стандартная энтальпия. горения (ΔcH298) | -2732,1 ± 1,9 кДж / моль |
| Фармакология | |
| Код АТС | N01AA01 (ВОЗ ) |
| Опасности | |
| Основная опасности | Чрезвычайно огнеопасен, вреден для кожи, разлагается до взрывоопасных перекисей в воздухе и свете |
| Паспорт безопасности | См.: страница данных. Внешний паспорт безопасности данных |
| Пиктограммы GHS |   |
| GHS Сигнальное слово | Опасно |
| Краткая характеристика опасности GHS | H224, H302, H336 |
| Меры предосторожности GHS | P210, P 233, P240, P241, P242, P243, P261, P264, P270, P271, P280, P301 + 312, P303 + 361 + 353, P304 + 340, P312, P330, P370 + 378, P403 + 233, P403 + 235, P405, P501 |
| NFPA 704 (огненный алмаз) |  4 2 1 4 2 1 |
| Температура вспышки | -45 ° C (-49 ° F; 228 K) |
| Самовоспламенение. температура | 160 ° C (320 ° F; 433 K) |
| Пределы взрываемости | 1,9–48,0% |
| Смертельная доза или концентрация (LD, LC): | |
| LC50(средняя концентрация ) | 73000 ppm (крыса, 2 часа). 6500 ppm (мышь, 1,65 часа) |
| LCLo(самая низкая опубликованная ) | 106000 ppm (кролик). 76000 ppm (собака) |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (допустимо) | TWA 400 ppm (1200 мг / м) |
| REL (рекомендуется) | Не установлено REL |
| IDLH (Непосредственная опасность) | 1900 частей на миллион |
| Родственные соединения | |
| Родственные Простые эфиры | Диметиловый эфир. Метоксипропан |
| Родственные соединения | Диэтил сульфид. Бутанолы (изомер ) |
| Страница дополнительных данных | |
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. д. |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ |
| Спектральные данные | UV, IR, ЯМР, MS |
| Если не указано иное, данные приведены для материалы в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
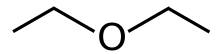
Диэтиловый эфир, или просто эфир, является органическим соединением в классе ether с формулой (C. 2H. 5). 2O, иногда сокращенно Et. 2O (см. символы псевдоэлементов ). Это бесцветная, летучая, сладко пахнущая («эфирный запах») легковоспламеняющаяся жидкость. Обычно используется как растворитель в лабораториях и как пусковая жидкость для некоторых двигателей. Ранее он использовался в качестве общего анестетика, пока не были разработаны негорючие препараты, такие как галотан. Он использовался как рекреационный наркотик, чтобы вызвать интоксикацию. Это структурный изомер бутанола.
Большинство диэтиловых эфиров производится как побочный продукт парофазной гидратации этилена с получением этанола. В этом процессе используются катализаторы фосфорная кислота на твердой подложке, и при необходимости его можно отрегулировать для получения большего количества эфира. Газофазная дегидратация этанола на некоторых катализаторах на основе оксида алюминия может дать выход диэтилового эфира до 95%.
Диэтиловый эфир может быть получен как в лабораториях, так и на в промышленных масштабах путем синтеза кислого эфира. Этанол смешивают с сильной кислотой, обычно серной кислотой, H 2SO4. Кислота диссоциирует в водной среде с образованием ионов гидроксония, H 3 O. Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
A нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды из протонированной (электрофильной ) молекулы этанола, образуя воду, a ион водорода и диэтиловый эфир.
Эту реакцию необходимо проводить при температурах ниже 150 ° C, чтобы обеспечить удаление продукт (этилен ) не является продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция образования диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, с использованием принципа Ле Шателье.
Другой реакцией, которую можно использовать для получения простых эфиров, является Синтез эфира Вильямсона, в котором алкоксид (полученный растворением щелочного металла в используемом спирте) выполняет нуклеофильное замещение при Алкилгалогенид.
Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы.
Диэтиловый эфир имеет высокую цетановое число 85–96 и используется в качестве пусковой жидкости в сочетании с нефтяными дистиллятами для бензиновых и дизельных двигателей из-за его высокой летучести и низкой температуры вспышки. Пусковая жидкость на основе эфира продается и используется в странах с холодным климатом, поскольку она может помочь при холодном запуске двигателя при минусовых температурах. По той же причине он также используется в качестве компонента топливной смеси для моделей карбюраторных двигателей с воспламенением от сжатия. Таким образом, диэтиловый эфир очень похож на один из его предшественников, этанол.
Диэтиловый эфир - это твердое основание Льюиса, которое реагирует с различными кислотами Льюиса. такие как I 2, фенол и Al (CH 3)3, и его основные параметры в модели ECW равны E B = 1,80 и C B = 1,63. Диэтиловый эфир является обычным лабораторным апротонным растворителем. Он имеет ограниченную растворимость в воде (6,05 г / 100 мл при 25 ° C). C) и растворяет 1,5 г / 100 г (1,0 г / 100 мл) воды при 25 ° C.Это, в сочетании с его высокой летучестью, делает его идеальным для использования в качестве неполярного растворителя в экстракции жидкость-жидкость. При использовании с водным раствором слой диэтилового эфира находится сверху, поскольку он имеет более низкую плотность, чем вода. Он также является обычным растворителем для реакции Гриньяра в в дополнение к другим реакциям с участием металлоорганических реагентов. В связи с его применением при производстве запрещенных веществ, он включен в Ta прекурсор ble II в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и психотропных веществ, а также такие вещества, как ацетон, толуол и серная кислота.
 Панель памятника в Бостоне, посвященная демонстрации Мортоном использования эфира для анестезии.
Панель памятника в Бостоне, посвященная демонстрации Мортоном использования эфира для анестезии. Уильям Т.Г. Мортон участвовал в публичной демонстрации эфирной анестезии 16 октября 1846 года в Ether Dome в Бостоне, Массачусетс. Однако теперь известно, что Кроуфорд Уильямсон Лонг продемонстрировал частным образом его использование в качестве общего анестетика в хирургии официальным лицам в Джорджии еще 30 марта 1842 г., и Лонг публично продемонстрировал действие эфира. до демонстрации в Бостоне шесть раз использовался в качестве хирургического анестетика. Британские врачи знали об анестезирующих свойствах эфира еще в 1840 году, когда его широко прописывали вместе с опиумом. Диэтиловый эфир в значительной степени вытеснил использование хлороформа в качестве общего анестетика из-за более благоприятного терапевтического индекса эфира, то есть большей разницы между эффективной дозой и потенциально токсичной дозой.
Диэтиловый эфир не угнетает миокард, а скорее стимулирует симпатическую нервную систему, что приводит к гипертонии и тахикардии. Он безопасно используется у пациентов с шоком, поскольку сохраняет рефлекс барорецепторов. Его минимальное воздействие на угнетение миокарда, респираторный драйв, низкая стоимость и высокий терапевтический индекс позволяют ему продолжать использовать в развивающихся странах. Диэтиловый эфир можно также смешивать с другими анестетиками, такими как хлороформ, чтобы получить C.E. смесь или хлороформа и спирта для получения A.C.E. смесь. В 21 веке эфир используется редко. Использование легковоспламеняющихся эфиров было заменено негорючими анестетиками на основе фторированных углеводородов. Галотан был первым разработанным таким анестетиком, а другие используемые в настоящее время ингаляционные анестетики, такие как изофлуран, десфлуран и севофлуран, являются галогенированными эфирами. Было обнаружено, что диэтиловый эфир имеет нежелательные побочные эффекты, такие как тошнота и рвота после анестезии. Современные анестетики уменьшают эти побочные эффекты.
До 2005 года он входил в Список основных лекарственных средств Всемирной организации здравоохранения для использования в качестве анестетика.
Эфир когда-то использовался в фармацевтических препаратах. Смесь спирта и эфира, одна часть диэтилового эфира и три части этанола, была известна как «Дух эфира», Анодин Гофмана или капли Хоффмана. В Соединенных Штатах эта смесь была исключена из Фармакопеи в какой-то момент до июня 1917 года, поскольку исследование, опубликованное Уильямом Проктером-младшим в American Journal of Pharmacy еще в 1852 г. показал, что существуют различия в рецептурах между коммерческими производителями, между международной фармакопеей и оригинальным рецептом Хоффмана. Он также используется для лечения икоты путем закапывания в носовую полость.
Обезболивающее и опьяняющее действие эфира сделали его рекреационным наркотиком. Диэтиловый эфир в дозировке анестетика - это средство для дыхания, которое давно используется в рекреационных целях. Одним из недостатков является высокая воспламеняемость, особенно в сочетании с кислородом. Одним из преимуществ является четко определенная граница между терапевтическими и токсическими дозами, что означает, что человек потеряет сознание до того, как будет достигнут опасный уровень растворенного эфира в крови. Обладая сильным густым запахом, эфир вызывает раздражение слизистой оболочки дыхательных путей и вызывает дискомфорт при дыхании, а при передозировке вызывает слюноотделение, рвоту, кашель или спазмы. При концентрациях в воздухе 3–5% анестезирующий эффект может медленно достигаться за 15–20 минут дыхания примерно 15–20 мл эфира, в зависимости от массы тела и физического состояния. Эфир вызывает очень долгую стадию возбуждения перед тем, как потерять сознание.
Рекреационное использование эфира также имело место на организованных вечеринках в 19 веке, называемых эфирными шалостями, где гостей поощряли вдыхать терапевтические количества диэтилового эфира или закиси азота, вызывающие состояние возбуждения. Лонг, а также его коллеги-стоматологи Гораций Уэллс, Уильям Эдвард Кларк и Уильям Т.Г. Мортон заметили, что во время этих собраний люди часто получали незначительные травмы, но, похоже, не проявляли никакой реакции на травму., ни воспоминания о том, что это произошло, демонстрируют обезболивающее действие эфира.
В 19 веке и начале 20 века употребление эфира было популярно среди польских крестьян. Это традиционный и все еще относительно популярный рекреационный наркотик среди лемков. Обычно его употребляют в небольшом количестве (кропка, или «точка»), поливая молоком, сахарной водой или апельсиновым соком в кадре . стекло. Известно, что как наркотик он вызывает психологическую зависимость, иногда называемую эфироманией.
A фермент цитохрома P450 предназначен для метаболизма диэтилового эфира.
Диэтиловый эфир ингибирует алкогольдегидрогеназу и, таким образом, замедляет метаболизм этанола. Он также подавляет метаболизм других лекарств, требующих окислительного метаболизма. Например, диазепам требует окисления в печени, тогда как его окисленный метаболит оксазепам - нет.
Диэтиловый эфир чрезвычайно огнеопасен и может образовывать взрывоопасные смеси пар / воздух.
Поскольку эфир тяжелее воздуха, он может собираться низко над землей, и пар может распространяться на значительные расстояния к источникам возгорания, что не обязательно должно быть открытым пламенем, но может быть горячая плита, паровая труба, нагреватель и т. д. Пар может воспламениться от статического электричества, которое может накапливаться, когда эфир переливается из одного сосуда в другой. Температура самовоспламенения диэтилового эфира составляет 160 ° C (320 ° F). Обычной практикой в химических лабораториях является использование пара (таким образом, ограничение температуры до 100 ° C (212 ° F)), когда эфир необходимо нагревать или перегонять. Распространение диэтилового эфира в воздухе составляет 9,18 × 10 м / с (298 К, 101,325 кПа).
Эфир чувствителен к свету и воздуху, склонен к образованию взрывоопасных пероксидов. Пероксиды эфира имеют более высокую температуру кипения, чем эфир, и при высыхании являются контактными взрывчатыми веществами. Коммерческий диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта бутилированного гидрокситолуола (BHT), который снижает образование пероксидов. Хранение над гидроксидом натрия осаждает промежуточные гидропероксиды простого эфира. Воду и пероксиды можно удалить либо дистилляцией из натрия и бензофенона, либо пропусканием через колонку активированного оксида алюминия.
Соединение возможно, был синтезирован либо Джабиром ибн Хайяном в 8 веке, либо Рамоном Лулллом в 1275 году. Он был синтезирован в 1540 году Валериусом Кордусом, который назвал его " сладкое масло купороса »(oleum dulce vitrioli) - название отражает тот факт, что оно получено путем дистилляции смеси этанола и серной кислоты (тогда известной как купоросное масло) - и отметил некоторые из его лечебных свойств. Примерно в то же время Парацельс открыл обезболивающие свойства этой молекулы у собак. Название "эфир" было дано веществу в 1729 году Августом Зигмундом Фробениусом.
. Оно считалось соединением серы, пока его идея не была опровергнута примерно в 1800 году.
| На Викискладе есть материалы, связанные с Диэтиловым эфиром. |