 | |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Название IUPAC вода, оксидан | |||
| Другие названия Гидроксид водорода (HH или HOH), оксид водорода, монооксид дигидрогена (DHMO) (систематическое название), оксид дигидрогена, соляная кислота, гидроксиодород, гидроксильная кислота, гидрол, μ-оксидодигидроген, κ-гидроксил водорода (0) | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| Ссылка Beilstein | 3587155 | ||
| ChEBI | |||
| ChEMBL |
| ||
| ChemSpider | |||
| Ссылка Gmelin | 117 | ||
| PubChem CID | |||
| номер RTECS |
| ||
| UNII | |||
InChI
| |||
УЛЫБКИ
| |||
| Свойства | |||
| Химическая формула | H. 2O | ||
| Молярная масса | 18,01528 (33) г / моль | ||
| Внешний вид | Белое кристаллическое твердое вещество, почти бесцветная жидкость с оттенком f синий, бесцветный газ | ||
| Запах | Нет | ||
| Плотность | Жидкость:. 0,9998396 г / мл при 0 ° C. 0,9970474 г / мл при 25 ° C. 0,961893 г / мл при 95 ° C. Твердое вещество:. 0,9167 г / мл при 0 ° C | ||
| Температура плавления | 0,00 ° C (32,00 ° F; 273,15 K) | ||
| Точка кипения | 99,98 ° C (211,96 ° F; 373,13 K) | ||
| Растворимость в воде | Н / Д | ||
| Растворимость | Плохо растворим в галогеналканах, алифатические и ароматические углеводороды, простые эфиры. Повышенная растворимость в карбоксилатах, спиртах, кетонах, аминах. Смешивается с метанолом, этанолом, пропанолом, изопропанолом, ацетоном, глицерином, 1,4-диоксан, тетрагидрофуран, сульфолан, ацетальдегид, диметилформамид, диметоксиэтан, диметилсульфоксид, ацетонитрил. Частично смешивается с диэтиловым эфиром, метилэтилкетоном, дихлорметаном, этилацетатом, бромом. | ||
| Давление пара | 3,1690 килопаскалей или 0,031276 атм при 25 ° C | ||
| Кислотность (pK a) | 13,995 | ||
| Основность (pK b) | 13,995 | ||
| Конъюгированная кислота | Гидроний | ||
| Конъюгат основания | Гидроксид | ||
| Теплопроводность | 0,6065 Вт / (м · К) | ||
| Показатель преломления (nD) | 1,3330 (20 ° C) | ||
| Вязкость | 0,890 мПа · с (0,890 cP ) | ||
| Структура | |||
| Кристаллическая структура | Гексагональная | ||
| Точечная группа | C2v | ||
| Молекулярная форма | Изгиб | ||
| Дипольный момент | 1.8546 D | ||
| Термохимия | |||
| Теплоемкость (C) | 75,385 ± 0,05 Дж / (моль · К) | ||
| Стандартная молярная. энтропия (S 298) | 69,95 ± 0,03 Дж / (моль · К) | ||
| Стандартная энтальпия. образование (ΔfH298) | -285,83 ± 0,04 кДж / моль | ||
| свободная энергия Гиббса (ΔfG˚) | -237,24 кДж / моль | ||
| Опасности | |||
| Основные опасности | Утопление. Лавина (как снег) . Отравление водой. (см. Также Пародия на монооксид дигидрогена ) | ||
| Паспорт безопасности | SDS | ||
| Указания об опасности GHS | H317 | ||
| NFPA 704 (огненный алмаз) |  0 0 0 0 0 0 | ||
| Температура вспышки | Невоспламеняющийся | ||
| Связанный соединения | |||
| Прочие катионы | Сероводород. Селенид водорода. Теллурид водорода. Полонид водорода. Пероксид водорода | ||
| Связанные растворители | Ацетон. Метанол | ||
| Страница дополнительных данных | |||
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. Д. | ||
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ | ||
| Спектральные данные | UV, IR, ЯМР, MS | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в инфобоксе | |||
Вода (H. 2O ) является полярным неорганическое соединение, которое при комнатной температуре представляет собой жидкость без вкуса и запаха , которая почти бесцветна, за исключением с присущим ей оттенком синего. Это, безусловно, наиболее изученное химическое соединение, описываемое как «универсальный растворитель » и «растворитель жизни». Это самое распространенное вещество на Земле и единственное распространенное вещество, существующее в виде твердого, жидкости и газа на поверхности Земли. Это также третья по численности молекула во Вселенной (после молекулярного водорода и окиси углерода ).
Молекулы воды образуют водородные связи друг с другом и являются сильно полярными. полярность позволяет ему диссоциировать ионы в солях и связываться с другими полярными веществами, такими как спирты и кислоты, тем самым растворяя их. Его водородные связи обуславливают его многие уникальные свойства, такие как наличие твердой формы, менее плотной, чем его жидкость форма, относительно высокая точка кипения 100 ° C для ее молярной массы, и высокая теплоемкость.
Вода амфотерная, что означает что он может проявлять свойства кислоты или основания, в зависимости от pH раствора, в котором он находится; он легко производит ионы H. и OH.. Из-за своего амфотерного характера он подвергается самоанализу. ионизация. Произведение активностей, или приблизительно, концентраций H. и OH. является константой, поэтому их соответствующие концентрации обратно пропорциональны друг другу.
Вода химическое вещество с химической формулой H. 2O; одна молекула воды имеет два атома водорода , ковалентно связанных с одним кислородом атом. Вода представляет собой жидкость без вкуса и запаха при температуре окружающей среды и давлении. Жидкая вода имеет слабые полосы поглощения на длинах волн около 750 нм, из-за которых кажется, что она имеет синий цвет. Это легко увидеть в ванне или умывальнике, наполненном водой, с белой подкладкой. Большие кристаллы льда, как в ледниках, также кажутся синими.
При стандартных условиях вода в основном является жидкостью, в отличие от других аналогичных гидридов из семейства кислорода, которые обычно газообразны. Это уникальное свойство воды обусловлено водородными связями. Молекулы воды постоянно движутся относительно друг друга, а водородные связи непрерывно разрываются и реформируются во времени, превышающем 200 фемтосекунд (2 × 10 секунд). Тем не менее, эти связи достаточно сильны, чтобы создавать многие из специфических свойств воды, некоторые из которых делают ее неотъемлемой частью жизни.
В атмосфере и на поверхности Земли жидкая фаза является наиболее распространенной и представляет собой форму, которая обычно обозначается словом " вода". твердая фаза воды известна как лед и обычно имеет структуру твердых, амальгамированных кристаллов, таких как кубики льда или рыхло скопленные гранулированные кристаллы, подобные снегу. Помимо обычного гексагонального кристаллического льда, известны другие кристаллические и аморфные фазы льда. Газовая фаза воды известна как водяной пар (или пар ). Видимый пар и облака образуются из мельчайших капелек воды, взвешенных в воздухе.
Вода также образует сверхкритический флюид. критическая температура составляет 647 K, а критическое давление составляет 22,064 МПа. В природе такое случается редко в крайне неблагоприятных условиях. Вероятный пример естественной сверхкритической воды - это самые горячие части глубоководных гидротермальных источников, в которых вода нагревается до критической температуры вулканическими шлейфами и критическое давление вызвано весом океана на крайних глубинах, где расположены жерла. Это давление достигается на глубине около 2200 метров: намного меньше средней глубины океана (3800 метров).
 Теплота испарения воды при таянии до критической температуры
Теплота испарения воды при таянии до критической температуры Вода имеет очень высокую удельную теплоемкость, составляющую 4,1814 Дж / (г · К) при 25 ° C - второе место среди всех гетероатомных частиц (после аммиака ), а также высокая теплота испарения (40,65 кДж / моль или 2257 кДж / кг при нормальной температуре кипения), оба из которых являются результатом обширных водородных связей между его молекулами. Эти два необычных свойства позволяют воде смягчать климат Земли, смягчая большие колебания температуры. Большая часть дополнительной энергии, накопленной в климатической системе с 1970 года, аккумулирована в океанах.
Удельная энтальпия плавления (более известная как скрытая теплота) воды составляет 333,55 кДж / кг при 0 ° C: для плавления льда требуется такое же количество энергии, как для нагрева льда от -160 ° C до точки его плавления или для нагрева того же количества воды примерно на 80 ° C. Из обычных веществ выше только аммиак. Это свойство обеспечивает устойчивость к таянию льда ледников и дрейфующих льдов. До и после появления механического охлаждения лед был и до сих пор широко используется для замедления порчи пищевых продуктов.
Удельная теплоемкость льда при -10 ° C составляет 2,03 Дж / (г · К), а теплоемкость пара при 100 ° C составляет 2,08 Дж / (г · К).
 Плотность льда и воды как функция температуры
Плотность льда и воды как функция температуры Плотность воды составляет около 1 грамма на кубический сантиметр (62 фунта / куб футов): это соотношение изначально использовался для определения грамма. Плотность изменяется с температурой, но не линейно: по мере увеличения температуры плотность повышается до пика при 3,98 ° C (39,16 ° F), а затем уменьшается; это необычно. Обычный гексагональный лед также менее плотен, чем жидкая вода - при замерзании плотность воды уменьшается примерно на 9%.
Эти эффекты связаны с уменьшением теплового движения при охлаждении, который позволяет молекулам воды образовывать больше водородных связей, которые не позволяют молекулам приближаться друг к другу. В то время как при температуре ниже 4 ° C разрыв водородных связей из-за нагрева позволяет молекулам воды сближаться, несмотря на увеличение теплового движения (которое имеет тенденцию расширять жидкость), при температуре выше 4 ° C вода расширяется при повышении температуры. Вода около точки кипения примерно на 4% менее плотна, чем вода при 4 ° C (39 ° F).
При повышении давления лед претерпевает ряд переходов в другие полиморфы с более высокой плотностью, чем жидкая вода, например лед II, лед III, аморфный лед высокой плотности (HDA) и аморфный лед очень высокой плотности лед (VHDA).
 Распределение температуры в озере летом и зимой
Распределение температуры в озере летом и зимой Необычная кривая плотности и более низкая плотность льда, чем у воды, жизненно важны для жизни - если бы вода была наиболее плотной в точке замерзания, тогда зимой очень холодная вода на поверхности озер и других водоемов утонет, озера могут замерзнуть снизу вверх, и все живое в них погибнет. Кроме того, учитывая, что вода является хорошим теплоизолятором (из-за ее теплоемкости), некоторые замерзшие озера летом могут не полностью оттаивать. Слой льда, который плавает сверху, изолирует воду внизу. Вода с температурой около 4 ° C (39 ° F) также опускается на дно, таким образом поддерживая температуру воды на дне постоянной (см. Диаграмму).
 WOA поверхностная плотность
WOA поверхностная плотность Плотность соленой воды зависит от содержания растворенной соли, а также от температуры. Лед все еще плавает в океанах, иначе они бы замерзли снизу вверх. Однако содержание солей в океанах понижает точку замерзания примерно на 1,9 ° C (см. здесь для объяснения) и понижает температуру максимума плотности воды до прежней точки замерзания при 0 ° C. Вот почему в океанской воде нисходящая конвекция более холодной воды не блокируется расширением воды, так как она становится холоднее около точки замерзания. Холодная вода океанов около точки замерзания продолжает тонуть. Таким образом, существа, которые живут на дне холодных океанов, таких как Северный Ледовитый океан, обычно живут в воде на 4 ° C холоднее, чем на дне замерзших пресных вод озер и рек.
Когда поверхность соленой воды начинает замерзать (при -1,9 ° C для нормальной солености морская вода, 3,5%) образующийся лед практически не содержит соли., примерно такой же плотности, как пресноводный лед. Этот лед плавает на поверхности, а «замороженная» соль увеличивает соленость и плотность морской воды непосредственно под ним в процессе, известном как отторжение рассола. Эта более плотная соленая вода опускается за счет конвекции, и замещающая морская вода подвергается тому же процессу. Таким образом образуется пресноводный лед с температурой -1,9 ° C на поверхности. Повышенная плотность морской воды под формирующимся льдом заставляет его опускаться ко дну. В крупном масштабе процесс отторжения рассола и опускания холодной соленой воды приводит к формированию океанских течений, которые уносят такую воду от полюсов, что приводит к глобальной системе течений, называемой термохалинной циркуляцией.
 Красная линия показывает насыщение.
Красная линия показывает насыщение. Вода смешивается со многими жидкостями, включая этанол во всех пропорциях. Вода и большинство масел не смешиваются, обычно образуя слои в зависимости от увеличения плотности сверху. Это можно предсказать, сравнив полярность . Вода, являющаяся относительно полярным соединением, будет иметь тенденцию смешиваться с жидкостями высокой полярности, такими как этанол и ацетон, тогда как соединения с низкой полярностью будут иметь тенденцию быть несмешиваемыми и плохо растворимыми, такими как углеводороды.
Как газ, водяной пар полностью смешивается с воздухом. С другой стороны, максимальное давление пара воды , которое является термодинамически стабильным с жидкостью (или твердым телом) при данной температуре, относительно низкое по сравнению с общим атмосферным давлением. Например, если парциальное давление пара составляет 2% от атмосферного давления, а воздух охлаждается с 25 ° C, начиная примерно с 22 ° C вода начнет конденсироваться, определяя точку росы и создавая туман или росу. Обратный процесс объясняет, что туман сгорает утром. Если влажность повышается при комнатной температуре, например, при использовании горячего душа или ванны, а температура остается примерно такой же, пар вскоре достигает давления для фазового перехода, а затем конденсируется в виде мельчайших капель воды, обычно называемых как пар.
Насыщенный газ или газ с относительной влажностью 100% - это когда давление водяного пара в воздухе находится в равновесии с давлением пара из-за (жидкой) воды; вода (или лед, если она достаточно холодная) не теряет массу за счет испарения при воздействии насыщенного воздуха. Поскольку количество водяного пара в воздухе невелико, относительная влажность, отношение парциального давления водяного пара к парциальному давлению насыщенного пара является гораздо более полезным. Давление пара выше 100% относительной влажности называется перенасыщением и может возникнуть, если воздух быстро охлаждается, например, внезапно поднимаясь при восходящем потоке.
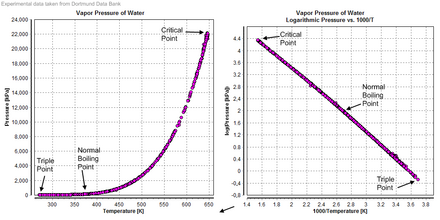 Диаграммы давления пара для воды
Диаграммы давления пара для воды Сжимаемость воды является функцией давления и температуры. При 0 ° C на пределе нулевого давления сжимаемость составляет 5,1 × 10 Па. При пределе нулевого давления сжимаемость достигает минимума 4,4 × 10 Па около 45 ° C, а затем снова увеличивается с увеличением температуры. По мере увеличения давления сжимаемость уменьшается, составляя 3,9 × 10 Па при 0 ° C и 100 мегапаскалей (1000 бар).
Модуль объемной упругости воды составляет около 2,2 ГПа. Низкая сжимаемость негазовых газов, в частности воды, приводит к тому, что их часто считают несжимаемыми. Низкая сжимаемость воды означает, что даже в глубоких океанах на глубине 4 км, где давление составляет 40 МПа, объем уменьшается всего на 1,8%.
 Тройная точка твердого вещества / жидкости / пара для жидкой воды, льда I h и водяного пара в левой нижней части диаграммы состояния воды.
Тройная точка твердого вещества / жидкости / пара для жидкой воды, льда I h и водяного пара в левой нижней части диаграммы состояния воды. температура и давление, при котором обычная твердая, жидкая и газообразная вода сосуществуют в равновесии, представляет собой тройную точку воды. С 1954 года эта точка использовалась для определения базовой единицы температуры, кельвин, но , начиная с 2019 года, кельвин теперь определяется с помощью постоянной Больцмана, а не тройная точка воды.
Из-за существования множества полиморфов (форм) льда, вода имеет другие тройные точки, которые имеют либо три полиморфа льда, либо два полиморфы льда и жидкости в равновесии. Густав Генрих Иоганн Аполлон Тамманн в Геттингене предоставил данные по нескольким другим тройным точкам в начале 20 века. Камб и другие задокументировали дальнейшие тройные точки в 1960-х.
| Фазы в устойчивом равновесии | Давление | Температура |
|---|---|---|
| жидкая вода, лед I h и водяной пар | 611,657 Па | 273,16 K (0,01 ° C) |
| жидкая вода, лед I h и лед III | 209,9 МПа | 251 K (-22 ° C) |
| жидкая вода, лед III и лед V | 350,1 МПа | -17,0 ° C |
| жидкая вода, лед V и лед VI | 632,4 МПа | 0,16 ° C |
| лед I h, лед II и лед III | 213 МПа | -35 ° C |
| лед II, лед III и лед V | 344 МПа | -24 ° C |
| лед II, лед V и лед VI | 626 МПа | -70 ° C |
Точка плавления льда составляет 0 ° C (32 ° F; 273 К) при стандартном давлении; однако чистая жидкая вода может быть переохлаждена значительно ниже этой температуры без замерзания, если жидкость не подвергается механическим воздействиям. Он может оставаться в жидком состоянии до точки его гомогенного зародышеобразования около 231 К (-42 ° C; -44 ° F). Температура плавления обычного гексагонального льда немного падает при умеренно высоких давлениях, на 0,0073 ° C (0,0131 ° F) / атм или примерно на 0,5 ° C (0,90 ° F) / 70 атм, поскольку энергия стабилизации водородных связей превышается за счет межмолекулярного отталкивания., но по мере того, как лед превращается в свои полиморфы (см. кристаллические состояния льда ) выше 209,9 МПа (2072 атм), температура плавления заметно увеличивается с давлением, т. е. достигая 355 K (82 ° C) при 2,216 ГПа (21 870 атм) (тройная точка льда VII ).
Чистая вода, не содержащая экзогенных ионов, является отличным изолятором, но даже не деионизирована «вода полностью не содержит ионов. Вода подвергается автоионизации в жидком состоянии, когда две молекулы воды образуют один гидроксид-анион (OH.) и один катион гидроксония (H. 3O.).
Поскольку вода является таким хорошим растворителем, в ней почти всегда есть растворенное растворенное вещество, часто соль. Если в воде есть хотя бы крошечное количество такой примеси, ионы могут переносить заряды туда и обратно, что позволяет воде гораздо легче проводить электричество.
Известно, что теоретическое максимальное электрическое сопротивление воды составляет приблизительно 18,2 МОм · см (182 кОм · м) при 25 ° C. Эта цифра хорошо согласуется с тем, что обычно наблюдается в системах обратного осмоса, ультрафильтрованной и деионизированной сверхчистой воды, используемых, например, на предприятиях по производству полупроводников. Уровень загрязнения солей или кислот, превышающий даже 100 частей на триллион (ppt) в сверхчистой воде, в остальном, начинает заметно снижать ее удельное сопротивление на величину до нескольких кОм · м.
В чистой воде чувствительное оборудование может обнаруживать очень небольшая электрическая проводимость 0,05501 ± 0,0001 μS /cm при 25,00 ° C. Воду также можно электролизовать в газообразные кислород и водород, но в отсутствие растворенных ионов это очень медленный процесс, так как проводится очень небольшой ток. Во льду первичными носителями заряда являются протоны (см. протонный проводник ). Раньше считалось, что лед имеет небольшую, но измеримую проводимость 1 × 10 См / см, но теперь считается, что эта проводимость почти полностью обусловлена поверхностными дефектами, и без них лед является изолятором с неизмеримо малой проводимостью.
 Диаграмма, показывающая частичные заряды на атомах в молекуле воды
Диаграмма, показывающая частичные заряды на атомах в молекуле воды Важной особенностью воды является ее полярная природа. Структура имеет изогнутую молекулярную геометрию для двух атомов водорода из кислородной вершины. Атом кислорода также имеет две неподеленной пары электронов. Один эффект, обычно приписываемый неподеленным парам, заключается в том, что угол изгиба газовой фазы H – O – H составляет 104,48 °, что меньше типичного тетраэдрического угла , равного 109,47 °. Неподеленные пары расположены ближе к атому кислорода, чем электроны сигма, связанные с атомами водорода, поэтому для них требуется больше места. Повышенное отталкивание неподеленных пар приводит к сближению связей O – H друг с другом.
Еще одним следствием его структуры является то, что вода является полярной молекулой. Из-за разницы в электроотрицательности, дипольный момент связи направлен от каждого H к O, делая кислород частично отрицательным, а каждый водород частично положительным. Большой молекулярный диполь указывает из области между двумя атомами водорода на атом кислорода. Разница в зарядах заставляет молекулы воды агрегироваться (относительно положительные области притягиваются к относительно отрицательным областям). Это притяжение, водородная связь, объясняет многие свойства воды, такие как ее растворяющие свойства.
Хотя водородная связь является относительно слабым притяжением по сравнению с ковалентными связями внутри самой молекулы воды, он отвечает за ряд физических свойств воды. Эти свойства включают относительно высокие температуры плавления и точки кипения: требуется больше энергии для разрыва водородных связей между молекулами воды. Напротив, сероводород (H 898>S) имеет гораздо более слабую водородную связь из-за более низкой электроотрицательности серы. H. 2S представляет собой газ при комнатной температуре, несмотря на то, что сероводород имеет почти вдвое большую молярную массу воды. Дополнительная связь между молекулами воды также придает жидкой воде большую удельную теплоемкость. Эта высокая теплоемкость делает воду хорошим теплоносителем (хладагентом) и теплозащитным экраном.
 Капли росы прилипают к паутине
Капли росы прилипают к паутине Молекулы воды остаются близко друг к другу (когезия ) за счет коллективного действия водородных связей между молекулами воды. Эти водородные связи постоянно разрываются, и новые связи образуются с разными молекулами воды; но в любой момент времени в образце жидкой воды большая часть молекул удерживается вместе такими связями.
Вода также обладает высокими адгезионными свойствами из-за своей полярной природы. На очень чистом / гладком стекле вода может образовывать тонкую пленку, потому что молекулярные силы между стеклом и молекулами воды (силы сцепления) сильнее, чем силы сцепления. В биологических клетках и органеллах вода находится в контакте с мембранами и поверхностями белков, которые гидрофильны ; то есть поверхности, которые имеют сильное притяжение к воде. Ирвинг Ленгмюр наблюдал сильную силу отталкивания между гидрофильными поверхностями. Для обезвоживания гидрофильных поверхностей - для удаления прочно удерживаемых слоев гидратационной воды - требуется значительная работа против этих сил, называемых силами гидратации. Эти силы очень велики, но быстро уменьшаются на протяжении нанометра или меньше. Они важны в биологии, особенно когда клетки обезвоживаются под воздействием сухой атмосферы или внеклеточного замораживания.
 Поток дождевой воды из навеса. Среди сил, управляющих образованием капель: Поверхностное натяжение, Когезия (химия), сила Ван-дер-Ваальса, Неустойчивость Плато – Рэлея.
Поток дождевой воды из навеса. Среди сил, управляющих образованием капель: Поверхностное натяжение, Когезия (химия), сила Ван-дер-Ваальса, Неустойчивость Плато – Рэлея. Эта канцелярская скрепка находится под уровнем воды, который плавно и плавно поднимается. Поверхностное натяжение предотвращает погружение зажима и выход воды за края стекла.
Эта канцелярская скрепка находится под уровнем воды, который плавно и плавно поднимается. Поверхностное натяжение предотвращает погружение зажима и выход воды за края стекла.  Температурная зависимость поверхностного натяжения чистой воды
Температурная зависимость поверхностного натяжения чистой воды Вода имеет необычно высокое поверхностное натяжение 71,99 мН / м при 25 ° C, что обусловлено прочностью водородной связи между молекулами воды. Это позволяет насекомым ходить по воде.
Поскольку вода имеет сильные силы сцепления и сцепления, она проявляет капиллярное действие. Сильная когезия за счет водородных связей и адгезии позволяет деревьям переносить воду на высоту более 100 м.
 Наличие коллоидного карбоната кальция с высокой концентрация растворенной извести превращает воду Havasu Falls в бирюзовую.
Наличие коллоидного карбоната кальция с высокой концентрация растворенной извести превращает воду Havasu Falls в бирюзовую. Вода является отличным растворителем благодаря своей высокой диэлектрической проницаемости. Вещества, которые хорошо смешиваются и растворяются в воде, известны как гидрофильные («водолюбивые») вещества, а вещества, которые плохо смешиваются с водой, известны как гидрофобные («водные анкета ") веществ. Способность вещества растворяться в воде определяется тем, может ли вещество соответствовать сильным силам притяжения, которые молекулы воды создают между другими молекулами воды, или лучше. Если вещество обладает свойствами, которые не позволяют ему преодолевать эти сильные межмолекулярные силы, молекулы осаждаются из воды. Вопреки распространенному заблуждению, вода и гидрофобные вещества не «отталкиваются», и гидратация гидрофобной поверхности является энергетически, но не энтропийной, благоприятной.
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды (гидратация ). Относительно небольшой размер молекул воды (~ 3 ангстрем) позволяет множеству молекул воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным концам диполя.
Как правило, ионные и полярные вещества, такие как кислоты, спирты и соли, относительно растворимы в воде, а неполярные вещества такие как жиры и масла нет. Неполярные молекулы остаются вместе в воде, потому что для молекул воды энергетически более выгодно связываться водородом друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль ; хлорид натрия, NaCl, разделяется на катионы Na. и анионы Cl. , каждый из которых окружен молекулами воды. Затем ионы легко переносятся из своей кристаллической решетки в раствор. Примером неионного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (группы ОН) и позволяют уносить ее в раствор.
О динамике квантового туннелирования в воде сообщалось еще в 1992 году. В то время было известно, что существуют движения, которые разрушают и регенерируют слабое водородная связь за счет внутреннего вращения водного заместителя мономеров. 18 марта 2016 года было сообщено, что водородная связь может быть разорвана путем квантового туннелирования в воде гексамере. В отличие от ранее описанных туннельных движений в воде, это включало согласованный разрыв двух водородных связей. Позже в том же году было сообщено об открытии квантового туннелирования молекул воды.
Вода относительно прозрачна для видимого света, вблизи ультрафиолетовый свет и дальний красный свет, но он поглощает большую часть ультрафиолетового света, инфракрасного света и микроволн. Большинство фоторецепторов и фотосинтетических пигментов используют часть светового спектра, которая хорошо передается через воду. Микроволновые печи используют непрозрачность воды для микроволнового излучения, чтобы нагревать воду внутри продуктов. Голубой цвет воды вызван слабым поглощением в красной части видимого спектра.
 Модель водородных связей (1) между молекулами воды
Модель водородных связей (1) между молекулами воды Одна молекула воды может участвовать максимум в четырех водородных связях, потому что она может принимать две связи, используя неподеленные пары кислорода, и отдавать два атома водорода. Другие молекулы, такие как фтористый водород, аммиак и метанол, также могут образовывать водородные связи. Однако они не проявляют аномальных термодинамических, кинетических или структурных свойств, подобных тем, которые наблюдаются в воде, потому что ни одна из них не может образовывать четыре водородные связи: либо они не могут отдавать или принимать атомы водорода, либо имеются стерические эффекты в объемных остатках. В воде межмолекулярные тетраэдрические структуры образуются из-за четырех водородных связей, тем самым формируя открытую структуру и трехмерную сетку связей, что приводит к аномальному снижению плотности при охлаждении ниже 4 ° C. Этот повторяющийся, постоянно реорганизуемый элемент определяет трехмерную сеть, проходящую по всей жидкости. Эта точка зрения основана на исследованиях рассеяния нейтронов и компьютерном моделировании и имеет смысл в свете однозначно тетраэдрического расположения молекул воды в ледяных структурах.
Однако есть альтернативная теория структуры воды. В 2004 г. в противоречивой статье из Стокгольмского университета было высказано предположение, что молекулы воды в жидкой форме обычно связываются не с четырьмя, а только с двумя другими; таким образом образуя цепи и кольца. Был введен термин «теория струн воды» (который не следует путать с теорией струн физики). Эти наблюдения были основаны на рентгеновской абсорбционной спектроскопии, которая исследовала локальное окружение отдельных атомов кислорода.
Отталкивающее воздействие двух неподеленных пар на атом кислорода заставляет воду иметь изогнутая, а не линейная, молекулярная структура, позволяющая ей быть полярной. Угол водород-кислород-водород составляет 104,45 °, что меньше 109,47 ° для идеальной гибридизации sp. Объяснение теории валентных связей состоит в том, что неподеленные пары атомов кислорода физически больше и поэтому занимают больше места, чем связи атома кислорода с атомами водорода. Объяснение теории молекулярных орбиталей (правило Бента ) заключается в том, что снижение энергии несвязывающих гибридных орбиталей атома кислорода (путем присвоения им более s-символа и менее p-символа) и, соответственно, повышение энергии гибридных орбиталей атома кислорода, связанных с атомами водорода (путем присвоения им большего количества p-символа и меньшего s-символа), имеет чистый эффект снижения энергии занятых молекулярных орбиталей, поскольку энергия несвязывающих гибридных орбиталей атома кислорода полностью способствует энергия неподеленных пар атома кислорода, в то время как энергия двух других гибридных орбиталей атома кислорода вносит лишь частичный вклад в энергию связывающих орбиталей (оставшаяся часть вклада исходит от 1-х орбиталей атомов водорода).
В жидкой воде наблюдается некоторая самодиссоциация, дающая ионы гидроксония и ионы гидроксида.
Константа равновесия для этой реакции, известная как ионный продукт воды, K w, имеет значение около 10 при 25 ° C. При нейтральном pH концентрация иона гидроксида (OH.) равна концентрации (сольватированного) иона водорода (H.), со значением, близким к 10 моль л при 25 ° C. См. страницу данных для значений при других температурах.
Воздействие воды на породу в течение длительного периода времени обычно приводит к выветриванию и водной эрозии, физическим процессам, которые преобразовывают твердые породы и минералов в почву и отложения, но при некоторых условиях также происходят химические реакции с водой, приводящие к метасоматизму или гидратации минералов, типу химического изменения породы, которое дает глинистые минералы. Это также происходит при затвердевании портландцемента.
Водяной лед может образовывать клатратные соединения, известные как клатратные гидраты, с множеством небольших молекул, которые могут быть встроены в его просторную кристаллическую решетку. Наиболее заметными из них являются клатрат метана, 4 CH. 4· 23H. 2O, естественным образом обнаруживаемый в больших количествах на дне океана.
Дождь обычно имеет умеренно кислый характер с pH от 5,2 до 5,8, если в нем нет кислоты, более сильной, чем диоксид углерода. Если в воздухе присутствует большое количество оксидов азота и серы, они тоже растворятся в облаках и каплях дождя, образуя кислотный дождь.
Существует несколько изотопов как водорода, так и кислорода, что дает начало нескольким известным изотопологам воды. Венский стандарт средней океанской воды - текущий международный стандарт для изотопов воды. Встречающаяся в природе вода почти полностью состоит из безнейтронного изотопа водорода протия. Только 155 частей на миллион включают дейтерий (. H или D), изотоп водорода с одним нейтроном, и менее 20 частей на квинтиллион включают тритий (. H или T), в котором есть два нейтрона. Кислород также имеет три стабильных изотопа:. O присутствует в 99,76%,. O в 0,04% и. O в 0,2% молекул воды.
Оксид дейтерия, D. 2O также известен как тяжелая вода из-за своей более высокой плотности. Используется в ядерных реакторах как нейтрон m. oderator. Тритий радиоактивен, распадается с периодом полураспада 4500 дней; THO существует в природе только в ничтожных количествах и производится главным образом в результате индуцированных космическими лучами ядерных реакций в атмосфере. Вода с одним протием и одним атомом дейтерия HDO в природе встречается в обычной воде в низких концентрациях (~ 0,03%) и D. 2O в гораздо меньших количествах (0,000003%), и любые такие молекулы являются временными, поскольку атомы рекомбинируют.
Наиболее заметные физические различия между H. 2O и D. 2O, кроме простой разницы в удельной массе, связаны со свойствами, на которые влияют водородные связи, такие как замерзание и кипение, и другие кинетические эффекты. Это связано с тем, что ядро дейтерия вдвое тяжелее протия, и это вызывает заметные различия в энергиях связи. Разница в температурах кипения позволяет разделить изотопологи. Коэффициент самодиффузии H. 2O при 25 ° C на 23% выше, чем значение D. 2O. Поскольку молекулы воды обмениваются атомами водорода друг с другом, оксид водорода дейтерия (DOH) гораздо чаще встречается в тяжелой воде низкой чистоты, чем чистый моноксид дидейтерия D. 2O.
Потребление чистого изолированного D. 2O может повлиять на биохимические процессы - прием больших количеств ухудшает функцию почек и центральной нервной системы. Небольшие количества можно употреблять без каких-либо побочных эффектов; люди, как правило, не замечают различий во вкусе, но иногда сообщают о жжении или сладком вкусе. Чтобы токсичность стала очевидной, необходимо употребить очень большое количество тяжелой воды. Однако крысы могут избегать тяжелой воды по запаху, и она токсична для многих животных.
Легкая вода означает воду, обедненную дейтерием (DDW), воду, в которой содержание дейтерия снижено ниже допустимого уровня. стандартный уровень 155 ppm.
Вода - самое распространенное вещество на Земле, а также третья по численности молекула во Вселенной после H. 2и CO. 0,23 частей на миллион земной массы составляют вода и 97,39 % мирового объема воды 1,38 × 10 км находится в океанах.
Вода амфотерная : он обладает способностью действовать как кислота или основание в химических реакциях. Согласно определению Брёнстеда-Лоури, кислота является донором протона (H. ), а основание является акцептором протона. При реакции с более сильной кислотой вода действует как основание; при взаимодействии с более сильным основанием действует как кислота. Например, вода получает ион H. из HCl, когда образуется соляная кислота :
В реакции с аммиаком, NH. 3вода отдает ион H. и, таким образом, действует как кислота:
Поскольку атом кислорода в воде имеет две неподеленной пары, вода часто действует как основание Льюиса или донор электронных пар в реакциях с кислоты Льюиса, хотя он также может реагировать с основаниями Льюиса, образуя водородные связи между донорами электронных пар и атомами водорода воды. Теория HSAB описывает воду как слабую твердую кислоту и слабое твердое основание, что означает, что она реагирует преимущественно с другими твердыми частицами:
Когда соль слабой кислоты) или если слабое основание растворено в воде, вода может частично гидролизовать соль с образованием соответствующего основания или кислоты, что дает водные растворы мыла и пищевой соды их основной pH:
Характер основания Льюиса воды делает его обычным лигандом в переходном металле комплексы, примеры которых включают аквокомплексы металлов, такие как Fe (от H. 2O). 6до перреновой кислоты, которые содержат две молекулы воды, координированные с рением в центре. В твердых гидратах вода может быть либо лигандом, либо просто заключена в каркас, либо и тем и другим вместе. Таким образом, FeSO. 4· 7H. 2O состоит из центров [Fe 2(H2O)6] и одной «решетчатой воды». Вода обычно является монодентатным лигандом, т. Е. Образует только одну связь с центральным атомом.
 Некоторые контакты, связывающие водород, в FeSO 47H2O. Этот водный комплекс металла кристаллизуется с одной молекулой "решеточной" воды, которая взаимодействует с сульфатом и центрами [Fe (H 2O)6].
Некоторые контакты, связывающие водород, в FeSO 47H2O. Этот водный комплекс металла кристаллизуется с одной молекулой "решеточной" воды, которая взаимодействует с сульфатом и центрами [Fe (H 2O)6]. As твердое основание, вода легко реагирует с органическими карбокатионами ; например, в реакции гидратации гидроксильная группа (OH.) и кислотный протон присоединяются к двум атомам углерода связаны вместе двойной связью углерод-углерод, в результате чего образуется спирт. Когда добавление воды к органической молекуле расщепляет молекулу надвое, происходит гидролиз. Известными примерами гидролиза являются омыление жиров и переваривание белков и полисахаридов. Вода также может быть уходящей группой в SN2 замещения и реакции элиминирования E2 ; последняя тогда известна как реакция дегидратации.
Вода содержит водород в степени окисления +1 и кислород в оксидати в состоянии −2. Он окисляет химические вещества, такие как гидриды, щелочные металлы и некоторые щелочноземельные металлы. Одним из примеров реакции щелочного металла с водой является:
Некоторые другие химически активные металлы, такие как алюминий и бериллий также окисляются водой, но их оксиды прилипают к металлу и образуют пассивный защитный слой . Обратите внимание, что ржавчина железа - это реакция между железом и кислородом, растворенным в воде, а не между железом и водой.
Вода может быть окислена с выделением газообразного кислорода, но очень немногие окислители вступают в реакцию с водой, даже если их восстановительный потенциал больше, чем потенциал O. 2/H. 2O. Почти все такие реакции требуют катализатора . Пример окисления воды:
Воду можно разделить на составляющие элементы., водород и кислород, пропуская через него электрический ток. Этот процесс называется электролизом. Катодная полуреакция:
Анодная полуреакция:
Газы образовывали пузыри на поверхности, где их можно было собрать или зажечь пламенем над водой, если это было намерением. Требуемый потенциал для электролиза чистой воды составляет 1,23 В при 25 ° C. Рабочий потенциал при практическом электролизе составляет 1,48 В или выше.
Генри Кавендиш показал, что вода состоит из кислорода и водорода в 1781 году. Первое разложение воды на водород и кислород с помощью электролиза было выполнено в 1800 году. английским химиком Уильямом Николсоном и Энтони Карлайлом. В 1805 году Джозеф Луи Гей-Люссак и Александр фон Гумбольдт показали, что вода состоит из двух частей водорода и одной части кислорода.
Гилберт Ньютон Льюис выделил первую часть. образец чистой тяжелой воды в 1933 году.
Свойства воды исторически использовались для определения различных температурных шкал. Примечательно, что шкалы Кельвина, Цельсия, Ренкина и Фаренгейта определялись или в настоящее время определяются температурами замерзания и кипения вода. Менее распространенные шкалы Delisle, Newton, Reaumur и Rømer были определены аналогично. Тройная точка воды сегодня является более широко используемой стандартной точкой.
Принятое ИЮПАК название воды - оксидан, или просто вода, или его эквивалент на разных языках, хотя есть и другие систематические названия, которые могут использоваться для описания молекула. Оксидан предназначен только для использования в качестве названия одноядерного исходного гидрида, используемого для наименования производных воды по номенклатуре заместителей. У этих производных обычно есть другие рекомендуемые названия. Например, название гидроксил рекомендуется вместо оксиданила для группы –OH. Название оксан явно упоминается ИЮПАК как непригодное для этой цели, поскольку это уже название циклического эфира, также известного как тетрагидропиран.
. Простейшее систематическое название воды - оксид водорода. Это аналогично родственным соединениям, таким как пероксид водорода, сероводород и оксид дейтерия (тяжелая вода). Используя химическую номенклатуру для ионных бинарных соединений типа I, вода получит название монооксид водорода, но это не входит в число названий, опубликованных Международным союзом чистой и прикладной химии (IUPAC). Другое название - монооксид дигидрогена, которое является редко используемым названием воды и в основном используется в пародии на монооксид дигидрогена.
. Другие систематические названия воды включают гидроксиковую кислоту, гидроксиловую кислоту и гидроксид водорода, используя названия кислот и оснований.. Ни одно из этих экзотических имен не используется широко. Поляризованная форма молекулы воды, H. OH., также называется гидрон гидроксидом по номенклатуре IUPAC.
Водное вещество - это термин, используемый для обозначения оксида водорода (H 2 O), когда никто не хочет указывать, идет ли речь о жидкости вода, паре, некоторой форме льда или компоненте в смеси или минеральный.
| На Викискладе есть медиафайлы, связанные с молекулой воды. |
| На Викискладе есть медиафайлы, связанные с водой. |
| В Викиверситете есть учебные ресурсы по инженерной термодинамике / таблицам пара |