| Джонс окисление | |
|---|---|
| Назван в честь | Юарта Джонса |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | jones-Oxidation |
| RSC ID онтологии | RXNO: 0000356 |
Окисление Джонса - это органическая реакция для окисления первичных и вторичных спиртов в карбоновых. кислоты и кетоны соответственно. Он назван в честь его первооткрывателя сэра Юарта Джонса. Реакция была одним из первых методов окисления спиртов. Его использование сократилось, поскольку были разработаны более мягкие и более селективные реагенты, например Реагент Коллинза.
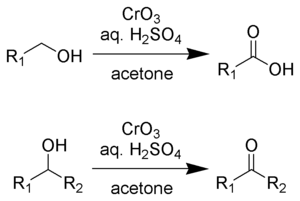
Реагент Джонса представляет собой раствор, приготовленный растворением триоксида хрома в водной серной кислоте. Для осуществления окисления Джонса эту кислотную смесь затем добавляют к раствору субстрата в ацетоне. В качестве альтернативы вместо триоксида хрома можно использовать дихромат калия. Окисление происходит очень быстро и довольно экзотермично. Урожайность обычно высокая. Реагент удобный и дешевый. Однако соединения Cr (VI) являются канцерогенными, что затрудняет использование этой методологии.
Реагент Джонса преобразует первичные и вторичные спирты в альдегиды и кетоны соответственно. В зависимости от условий реакции альдегиды затем могут быть преобразованы в карбоновые кислоты. Для окисления до альдегидов и кетонов два эквивалента хромовой кислоты окисляют три эквивалента спирта:
Для окисления первичных спиртов до карбоновых кислот 4 эквивалента хромовой кислоты окисляют 3 эквивалента спирта.Альдегид является промежуточным продуктом.
Неорганические продукты имеют зеленый цвет, характерный для аквокомплексов хрома (III).
Подобно многим другим окислениям спиртов оксидами металлов, реакция протекает через образование смешанного сложного эфира хромовой кислоты : Эти сложные эфиры имеют формулу CrO 3 (OCH 2R)
Подобно обычным сложным эфирам, образование этого сложного эфира хромовой кислоты ускоряется кислотой. Эти сложные эфиры могут быть выделены, когда спирт является третичным, поскольку в них отсутствует α водород, который будет потеряно с образованием карбонила. Например, используя трет-бутиловый спирт, можно выделить трет-бутилхромат ((CH 3)3CO) 2 CrO 2), который сам по себе является хорошим окислителем.
Для структур с альфа-водородом по отношению к кислороду сложные эфиры хрома разлагаются, высвобождая карбонильный продукт и плохо определенный продукт Cr (IV):
Дейтерированные спирты HOCD 2 R окисляются примерно в шесть раз медленнее, чем недейтерированные производные. Этот большой кинетический изотопный эффект показывает, что связь C – H (или C – D) разрывается на стадии, определяющей скорость.
 Механизм окисления Джонса
Механизм окисления Джонса Стехиометрия реакции предполагает наличие Cr (IV) разновидность «CrO 2 OH», которая пропорционирует с хромовой кислотой с образованием оксида Cr (V), который также действует как окислитель для спирта.
Предполагается, что окисление альдегидов протекает через образование полуацеталь -подобных промежуточных продуктов, которые возникают в результате присоединения связи O 3 CrO-H через C = О связь.
Реагент редко окисляет ненасыщенные связи.
Он остается полезным в органическом синтезе. Различные спектроскопические методы, в том числе инфракрасная спектроскопия, могут использоваться для контроля за ходом реакции окисления Джонса. Одно время окисление Джонса применялось в алкотестерах.
Основными реагентами являются реагент Коллинза, PDC и PCC. Эти реагенты представляют собой усовершенствования по сравнению с реагентами на основе неорганического хрома (VI), такими как реагент Джонса.