| NP_1200_1200_126. NP_000198.1. |
|---|
NP_001172026.1. NP_001172027.1. NP_001278826.1. NP_000198. NP_000198. NP_000198. NP_000198 |
| Просмотр / Edit Human | View / Edit Mouse |
 Инсулин - это пептидный гормон, содержащий две цепи, сшитые дисульфидными мостиками.
Инсулин - это пептидный гормон, содержащий две цепи, сшитые дисульфидными мостиками. Инсулин (, от латинского insula, «остров») представляет собой пептидный гормон, продуцируемый бета-клетками островков поджелудочной железы ; он считается основным анаболическим гормоном организма. Он регулирует метаболизм углеводов, жиров и белка, способствуя абсорбции глюкозы из крови в клетки печени, жира и скелетных мышц. В этих тканях абсорбированная глюкоза превращается либо в гликоген посредством гликогенеза, либо в жиры (триглицериды ) посредством липогенеза или, в случае печени, в оба. Производство глюкозы и секреция печенью сильно ингибируются высокими концентрациями инсулина в крови. Циркулирующий инсулин также влияет на синтез белков в самых разных тканях. Следовательно, это анаболический гормон, способствующий превращению небольших молекул в крови в большие молекулы внутри клеток. Низкий уровень инсулина в крови имеет противоположный эффект, способствуя широко распространенному катаболизму, особенно запасу жира в организме.
бета-клетки, чувствительны к уровню сахара в крови, поэтому что они секретируют инсулин в кровь в ответ на высокий уровень глюкозы; и подавляют секрецию инсулина при низком уровне глюкозы. Инсулин усиливает усвоение глюкозы и метаболизм в клетках, тем самым снижая уровень сахара в крови. Соседние с ними альфа-клетки, принимая сигналы от бета-клеток, секретируют глюкагон в кровь противоположным образом: повышенная секреция при низком уровне глюкозы в крови и пониженная секреция при концентрациях глюкозы. высокие. Глюкагон увеличивает уровень глюкозы в крови, стимулируя гликогенолиз и глюконеогенез в печени. Секреция инсулина и глюкагона в кровь в ответ на концентрацию глюкозы в крови является основным механизмом гомеостаза глюкозы.
Снижение или потеря активности инсулина приводит к сахарному диабету, состоянию высокого уровня сахара в крови (гипергликемии). Есть два типа болезни. При сахарном диабете 1 типа бета-клетки разрушаются аутоиммунной реакцией, так что инсулин больше не может синтезироваться или секретироваться в кровь. При сахарном диабете 2 типа разрушение бета-клеток менее выражено, чем при диабете 1 типа, и не связано с аутоиммунным процессом. Вместо этого в островках поджелудочной железы происходит накопление амилоида, что, вероятно, нарушает их анатомию и физиологию. Патогенез диабета 2 типа не совсем понятен, но известно, что в этом участвуют уменьшение популяции островковых бета-клеток, снижение секреторной функции выживающих островковых бета-клеток и инсулинорезистентность периферических тканей. Диабет 2 типа характеризуется повышенной секрецией глюкагона, на которую не влияет и не реагирует концентрация глюкозы в крови. Но инсулин по-прежнему секретируется в кровь в ответ на уровень глюкозы в крови. В результате в крови накапливается глюкоза.
Белок инсулина человека состоит из 51 аминокислоты и имеет молекулярную массу 5808 Да. Это гетеро димер A-цепи и B-цепи, которые связаны вместе дисульфидными связями. Структура инсулина незначительно варьируется между видами животных. Инсулин животного происхождения несколько отличается по эффективности (в эффектах углеводного обмена ) от человеческого инсулина из-за этих изменений. Свиной инсулин особенно близок к версии человеческого и широко использовался для лечения диабета 1 типа до того, как человеческий инсулин можно было производить в больших количествах с помощью технологий рекомбинантной ДНК.
Инсулин был первым открытым пептидным гормоном. Фредерик Бантинг и Чарльз Герберт Бест, работающие в лаборатории JJR Маклеод из Университета Торонто был первым, кто выделил инсулин из поджелудочной железы собаки в 1921 году. Фредерик Сэнджер секвенировал аминокислотную структуру в 1951 году, что сделало инсулин первым белком. быть полностью упорядоченным. Кристаллическая структура инсулина в твердом состоянии была определена Дороти Ходжкин в 1969 году. Инсулин также является первым белком, который был химически синтезирован и произведен с помощью технологии рекомбинантной ДНК. Он включен в Примерный список основных лекарственных средств ВОЗ, наиболее важные лекарства, необходимые в базовой системе здравоохранения.
Инсулин, возможно, возник более миллиарда лет назад. Молекулярное происхождение инсулина восходит, по крайней мере, к самым простым одноклеточным эукариотам. Помимо животных, инсулиноподобные белки также известны в царствах грибов и протистов.
Инсулин вырабатывается бета-клетками островков поджелудочной железы в большинстве позвоночных и телом Брокмана у некоторых костистых рыб. конусных улиток Conus geographus и Conus tulipa, ядовитые морские улитки, которые охотятся на мелкую рыбу, используют модифицированные формы инсулина в своих коктейлях из яда. Токсин инсулина, более близкий по структуре к естественному инсулину рыб, чем улиток, замедляет добычу рыб, снижая их уровень глюкозы в крови.
препроинсулин предшественник инсулина кодируется геном INS , который расположен на хромосоме 11p15.5. У некоторых млекопитающих, таких как крысы и мыши, есть два гена инсулина, один из которых является гомологом большинства гены млекопитающих (Ins2), а другой из которых является ретропозированной копией, которая включает последовательность промотора, но не имеет интрона (Ins1). Оба гена инсулина грызунов являются функциональными.
были идентифицированы различные мутантные аллели с изменениями в кодирующей области. ген считывания, INS-IGF2, перекрывается с этим геном в 5 'области и с геном IGF2 в 3' области.
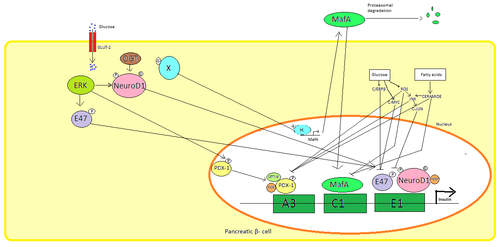 Схема регуляции инсулина при высоком уровне глюкозы в крови
Схема регуляции инсулина при высоком уровне глюкозы в крови В панкреатических β-клетках, глюкоза является основным физиологическим стимулом для регуляции синтеза инсулина. Инсулин в основном регулируется с помощью факторов транскрипции PDX1, NeuroD1 и MafA.
В состоянии низкого уровня глюкозы PDX1 (белок 1 гомеобокса поджелудочной железы и двенадцатиперстной кишки) локализован на периферии ядра в результате взаимодействия с HDAC1 и 2, что приводит к подавлению секреции инсулина. Повышение уровня глюкозы в крови вызывает фосфорилирование PDX1, что приводит к его ядерной транслокации и связыванию элемента A3 внутри промотора инсулина. При транслокации он взаимодействует с коактиваторами HAT p300 и SETD7. PDX1 влияет на модификации гистона посредством ацетилирования и деацетилирования, а также метилирования. Также сообщается, что он подавляет глюкагон.
NeuroD1, также известный как β2, регулирует экзоцитоз инсулина в β-клетках поджелудочной железы, напрямую индуцируя экспрессию генов, участвующих при экзоцитозе. Он локализуется в цитозоле, но в ответ на высокий уровень глюкозы он становится гликозилированным посредством OGT и / или фосфорилированным посредством ERK, что вызывает транслокацию в ядро. В ядре β2 гетеродимеризуется с E47, связывается с элементом E1 промотора инсулина и рекрутирует соактиватор p300, который ацетилирует β2. Он способен взаимодействовать с другими факторами транскрипции, а также при активации гена инсулина.
MafA расщепляется протеасомами при низких уровнях глюкозы в крови. Повышенные уровни глюкозы делают неизвестный белок гликозилированным. Этот белок неизвестным образом работает как фактор транскрипции для MafA, и MafA транспортируется из клетки. MafA затем перемещается обратно в ядро, где он связывает С1-элемент промотора инсулина.
Эти факторы транскрипции работают синергетически и в сложной структуре. Повышенное содержание глюкозы в крови может через некоторое время разрушить связывающую способность этих белков и, следовательно, уменьшить количество секретируемого инсулина, вызывая диабет. Снижение связывающей активности может быть опосредовано глюкозой индуцированным окислительным стрессом, и считается, что антиоксиданты предотвращают снижение секреции инсулина в глюкотоксических β-клетках поджелудочной железы. Сигнальные молекулы стресса и активные формы кислорода ингибируют ген инсулина, вмешиваясь в кофакторы, связывающие факторы транскрипции, и сами факторы транскрипции.
Несколько регуляторных последовательностей в промоторная область гена человеческого инсулинасвязывается с факторами транскрипции. Как правило, A-блоки связываются с факторами Pdx1, E-box связываются с NeuroD, C-блоки связываются с MafA и элементы ответа cAMP с по CREB. Существуют также сайленсеры, ингибирующие транскрипцию.
| Регуляторная последовательность | связывание факторы транскрипции |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| отрицательный регуляторный элемент ( NRE) | глюкокортикоидный рецептор, Oct1 |
| Z (перекрывая NRE и C2) | |
| C2 | Pax4, MafA (?) |
| E2 | USF1 / USF2 |
| A3 | Pdx1 |
| CREB RE | CREB, CREM |
| A2 | – |
| связывание энхансера CAAT (CEB) (частично перекрывая A2 и C1) | – |
| C1 | – |
| E1 | E2A, NeuroD1, HEB |
| A1 | Pdx1 |
| G1 | – |
 Структура инсулина. Левая сторона представляет собой модель, заполняющую пространство мономером инсулина, предположительно биологически активный. Углерод зеленый, водород белый, кислород красный и азот синий. Справа показана ленточная диаграмма гексамера инсулина, предположительно хранимая форма. Мономерное звено выделено синим цветом цепи A и голубым цветом цепи B. Желтый цвет означает дисульфидные связи, а пурпурные сферы - это ионы цинка.
Структура инсулина. Левая сторона представляет собой модель, заполняющую пространство мономером инсулина, предположительно биологически активный. Углерод зеленый, водород белый, кислород красный и азот синий. Справа показана ленточная диаграмма гексамера инсулина, предположительно хранимая форма. Мономерное звено выделено синим цветом цепи A и голубым цветом цепи B. Желтый цвет означает дисульфидные связи, а пурпурные сферы - это ионы цинка. Вопреки первоначальному мнению, что гормоны, как правило, представляют собой небольшие химические молекулы, как первый пептидный гормон, известный по его структуре, инсулин оказался довольно большим. Отдельный белок (мономер) человеческого инсулина состоит из 51 аминокислоты и имеет молекулярную массу, равную 5808 Да. Молекулярная формула человеческого инсулина - C 257 H 383 N65O77S6. Это комбинация двух пептидных цепей (димер ), названных A-цепью и B-цепью, которые связаны вместе двумя дисульфидными связями. A-цепь состоит из 21 аминокислоты, а B-цепь состоит из 30 остатков. Связывающие (межцепочечные) дисульфидные связи образуются у остатков цистеина между положениями A7-B7 и A20-B19. Существует дополнительная (внутрицепочечная) дисульфидная связь внутри А-цепи между остатками цистеина в положениях A4 и A11. A-цепь имеет две -спиральные области A1-A8 и A12-A19, которые антипараллельны; в то время как цепь B имеет центральную α-спираль (покрывающую остатки B9-B19), фланкированную дисульфидной связью с обеих сторон, и два β-слоя (покрывающие B7-B10 и B20-B23).
Аминокислота последовательность инсулина строго консервативна и лишь незначительно варьируется между видами. Бычий инсулин отличается от человеческого только тремя аминокислотными остатками, а свиной инсулин - одним. Даже инсулин некоторых видов рыб достаточно похож на человеческий, чтобы быть клинически эффективным для человека. Инсулин у некоторых беспозвоночных очень похож по последовательности на человеческий инсулин и имеет сходные физиологические эффекты. Сильная гомология, наблюдаемая в последовательности инсулина у различных видов, предполагает, что он сохранялся на протяжении большей части истории эволюции животных. С-пептид проинсулина, однако, значительно различается между видами; это тоже гормон, но второстепенный.
Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), тогда как активной формой является мономер. Размер гексамера составляет около 36000 Да. Шесть молекул соединены вместе как три димерных единицы, образуя симметричную молекулу. Важной особенностью является присутствие атомов цинка (Zn) на оси симметрии, которые окружены тремя молекулами воды и тремя остатками гистамина в положении B10.
Гексамер является неактивной формой с длительной стабильностью, который служит способом защитить высокореактивный инсулин, но при этом легко доступен. Превращение гексамера в мономер является одним из центральных аспектов препаратов инсулина для инъекций. Гексамер намного более стабилен, чем мономер, что желательно по практическим соображениям; однако мономер - это лекарство с гораздо более быстрой реакцией, поскольку скорость диффузии обратно пропорциональна размеру частиц. Быстро реагирующий препарат означает, что инъекции инсулина не должны предшествовать приемам пищи на несколько часов, что, в свою очередь, дает людям с диабетом большую гибкость в их ежедневном графике. Инсулин может агрегировать и образовывать фибриллярные встречно-гребенчатые бета-листы. Это может вызвать инъекционный амилоидоз и предотвращает хранение инсулина в течение длительного периода.
Инсулин - это вырабатывается поджелудочной железой и телом Брокмана (у некоторых рыб) и высвобождается при обнаружении любого из нескольких стимулов. Эти стимулы включают повышение концентраций аминокислот и глюкозы в плазме в результате переваривания пищи. Углеводы могут быть полимерами простых сахаров или самими простыми сахарами. Если углеводы включают глюкозу, то эта глюкоза будет всасываться в кровоток, и уровень глюкозы в крови начнет повышаться. В клетках-мишенях инсулин инициирует передачу сигнала, которая имеет эффект увеличения поглощения и хранения глюкозы. Наконец, инсулин разлагается, прекращая ответ.
 Инсулин претерпевает обширную посттрансляционную модификацию по пути производства. Производство и секреция в значительной степени независимы; подготовленный инсулин хранится в ожидании секреции. И С-пептид, и зрелый инсулин являются биологически активными. Компоненты клеток и белки на этом изображении не в масштабе.
Инсулин претерпевает обширную посттрансляционную модификацию по пути производства. Производство и секреция в значительной степени независимы; подготовленный инсулин хранится в ожидании секреции. И С-пептид, и зрелый инсулин являются биологически активными. Компоненты клеток и белки на этом изображении не в масштабе. У млекопитающих инсулин синтезируется в поджелудочной железе в бета-клетках. От одного миллиона до трех миллионов островков поджелудочной железы образуют эндокринную часть поджелудочной железы, которая в первую очередь является экзокринной железой. Эндокринная часть составляет всего 2% от общей массы поджелудочной железы. Внутри островков поджелудочной железы бета-клетки составляют 65–80% всех клеток.
Инсулин состоит из двух полипептидных цепей, А- и В-цепей, связанных между собой дисульфидными связями. Однако сначала он синтезируется в бета-клетках как отдельный полипептид, называемый препроинсулин. Препроинсулин содержит сигнальный пептид с 24 остатками, который направляет растущую полипептидную цепь к грубому эндоплазматическому ретикулуму (RER). Сигнальный пептид расщепляется, когда полипептид перемещается в просвет RER, образуя проинсулин. В RER проинсулин сворачивается в правильную конформацию и образуются 3 дисульфидные связи. Примерно через 5–10 мин после сборки в эндоплазматическом ретикулуме проинсулин транспортируется в сеть транс-Гольджи (TGN), где формируются незрелые гранулы. Транспорт к TGN может занять около 30 минут.
Проинсулин подвергается созреванию в активный инсулин под действием клеточных эндопептидаз, известных как конвертазы прогормона (PC1 и PC2 ), а также экзопротеаза карбоксипептидаза E. Эндопептидазы расщепляются в 2 положениях, высвобождая фрагмент, называемый C-пептидом, и оставляя 2 пептидные цепи, B- и A-цепи, связанные 2 дисульфидными связями. Каждый сайт расщепления расположен после пары основных остатков (лизин-64 и аргинин-65 и аргинин-31 и -32). После отщепления С-пептида эти 2 пары основных остатков удаляются карбоксипептидазой. C-пептид является центральной частью проинсулина, и первичная последовательность проинсулина идет в порядке «BCA» (цепи B и A были идентифицированы на основе массы, а C-пептид был обнаружен позже).
Полученный зрелый инсулин упаковывается внутри зрелых гранул в ожидании метаболических сигналов (таких как лейцин, аргинин, глюкоза и манноза) и стимуляции блуждающего нерва для экзоцитоза из клетки в кровоток.
Эндогенная продукция инсулина регулируется в несколько этапов на пути синтеза:
было показано, что инсулин и родственные ему белки вырабатываются внутри головного мозга, а снижение уровня этих белков связано с болезнью Альцгеймера..
Высвобождение инсулина стимулируется также стимуляцией рецептора бета-2 и ингибируется альфа-1 r стимуляция эцепторов. Кроме того, кортизол, глюкагон и гормон роста противодействуют действию инсулина во время стресса. Инсулин также ингибирует высвобождение жирных кислот гормоночувствительной липазой в жировой ткани.
Бета-клетки в островках Лангерганса высвобождают инсулин в две фазы. Высвобождение первой фазы быстро запускается в ответ на повышение уровня глюкозы в крови и длится около 10 минут. Вторая фаза - это продолжительное, медленное высвобождение новообразованных пузырьков, запускаемое независимо от сахара и достигающее пика через 2–3 часа. Снижение высвобождения инсулина в первой фазе может быть самым ранним обнаруживаемым дефектом бета-клеток, предсказывающим начало диабета 2 типа. Высвобождение первой фазы и чувствительность к инсулину являются независимыми прогностическими факторами диабета.
Описание первой фазы высвобождения следующее:
. Это основной механизм высвобождения инсулина. Другие вещества, которые, как известно, стимулируют высвобождение инсулина, включают аминокислоты аргинин и лейцин, парасимпатическое высвобождение ацетилхолина (действующего через путь фосфолипазы C), сульфонилмочевину, холецистокинин ( CCK, также через фосфолипазу C) и полученные из желудочно-кишечного тракта инкретины, такие как глюкагоноподобный пептид-1 (GLP-1) и глюкозозависимый инсулинотропный пептид (ЖИП).
Высвобождение инсулина сильно ингибируется норэпинефрином (норадреналин), что приводит к повышению уровня глюкозы в крови во время стресса. Похоже, что высвобождение катехоламинов симпатической нервной системой оказывает противоречивое влияние на высвобождение инсулина бета-клетками, потому что высвобождение инсулина подавляется α 2 -адренергическими рецепторами. и стимулируется β 2 -адренергическими рецепторами. Чистым эффектом норадреналина симпатических нервов и адреналина надпочечников на высвобождение инсулина является ингибирование из-за преобладания альфа-адренорецепторов.
Когда уровень глюкозы сводится к обычному физиологическому значению, высвобождение инсулина из β-клеток замедляется или останавливается. Если уровень глюкозы в крови падает ниже этого уровня, особенно до опасно низкого уровня, высвобождение гипергликемических гормонов (наиболее заметно глюкагона из островка альфа-клеток Лангерганса) вызывает выброс глюкозы в кровь из запасов гликогена в печени, дополняется глюконеогенезом, если запасы гликогена истощаются. Повышая уровень глюкозы в крови, гипергликемические гормоны предотвращают или корректируют опасную для жизни гипогликемию.
Признаки нарушения высвобождения инсулина в первой фазе можно увидеть в тесте на толерантность к глюкозе, продемонстрировав существенное повышение уровня глюкозы в крови через 30 минут после приема глюкозной нагрузки (75 или 100 г глюкозы), с последующим медленным падением в течение следующих 100 минут, чтобы оставаться выше 120 мг / 100 мл через два часа после начала теста. У нормального человека уровень глюкозы в крови корректируется (и может быть даже немногосверхкорректирован) к концу теста. Пик инсулина - это «первая реакция» на повышение уровня глюкозы в крови, эта реакция индивидуальна и зависит от дозы, хотя ранее всегда предполагалось, что она зависит только от типа пищи.
 Высвобождение инсулина из поджелудочной железы колеблется с периодом 3–6 минут.
Высвобождение инсулина из поджелудочной железы колеблется с периодом 3–6 минут. Даже во время пищеварения, как правило, через один или два часа после высвобождения инсулина из поджелудочной железы не является непрерывным, но колеблется с периодом 3–6 минут, изменяясь от создания инсулина в крови более примерно 800 p моль / л до менее 100 пмоль / л (у крыс). Считается, что это предотвращает подавление рецепторов инсулина в клетках-мишенях и помогает печени извлекать инсулин из крови. Это колеблющаяся энергия достигает высвобождения инсулино-стимулирующих препаратов, поскольку в идеале должна быть достигнута высвобождения инсулина в крови, а не постоянная высокая способность. Это может быть достигнуто посредством ритмичной доставки инсулина в воротную вену, путем активации светом доставки или путем трансплантации островковых клеток в печень.
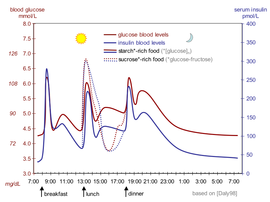 Идеализированная диаграмма показывает колебания сахара в крови (красный) и сахароснижающего гормона инсулина (синий) у людей в течение дня, содержащего трехразовое питание. Кроме того, подчеркивается влияние пищи, богатой сахаром, по сравнению с пищей, богатой крахмалом.
Идеализированная диаграмма показывает колебания сахара в крови (красный) и сахароснижающего гормона инсулина (синий) у людей в течение дня, содержащего трехразовое питание. Кроме того, подчеркивается влияние пищи, богатой сахаром, по сравнению с пищей, богатой крахмалом. Уровень инсулина в крови может быть измерен в международных единицах, например, мкМЕ / мл или молярная концентрация, например пмоль / л, где 1 мкМЕ / мл равняется 6,945 пмоль / л. Типичный уровень в крови между приемами пищи составляет 8–11 мкМЕ / мл (57–79 пмоль / л).
Действие инсулина инициируется его связыванием с рецептором, присутствующим в клеточная мембрана. Молекула рецептора содержит субъединицы α и β. Две молекулы соединяются с образованием так называемого гомодимера. Инсулин связывается с α-субъединицами гомодимера, который обращен к внеклеточной стороне клеток. Субъединицы обладают ферментативной активностью тирозинкиназы, которая запускается связыванием инсулина. Эта активность провоцирует аутофосфорилирование субъединиц β и, следовательно, фосфорилирование белков внутри клеток, как субстраты рецептора инсулина (IRS). Фосфорилирование IRS активирует каскад передачи, который вызывает активацию других киназ, а также факторов транскрипции, которые опосредуют внутриклеточные эффекты инсулина.
Каскад, который приводит к встраиванию переносчиков глюкозы GLUT4 в клетку. клеточные мембраны, мышечных и жировых клеток, а также синтез гликогена в печени и мышечной ткани, а также преобразование глюкозы ткани и ткани, лактирующих молочных желез, происходит через активацию IRS-1, фосфозитол 3 киназы (PI3K ). Этот фермент превращает фосфолипид в клеточной мембране под названием фосфатидилинозитол-4,5-бисфосфат (PIP2) в фосфатидилинозитол-3,4,5-трифосфат (PIP3), который, в свою очередь, активирует протеинкиназу B (ПКБ). Активированный PKB облегчает влияние клеточного GLUT4, содержащего эндосомы, с увеличенной мембраной, что приводит к увеличению переносчиков GLUT4 в плазматической мембране. PKB также фосфорилирует киназу гликогенсинтазы (GSK), тем самым инактивируя этот фермент. Это означает, что его субстрат, гликогенсинтаза (GS), не может быть фосфорилирован и остается дефосфорилированным и, следовательно, активным. Активный фермент, гликогенсинтаза (GS), катализирует лимитирующую стадию синтеза гликогена из глюкозы. Аналогичное дефосфорилирование влияет на ферменты, производящие скорость гликолиза, что приводит к синтезу через жиров малонил-КоА в тканях, которые генерируют триглицериды, а также ферменты, которые контролируют скорость глюконеогенеза в печени. Общий эффект этих конечных дефосфорилирования ферментов заключается в том, что в тканях, которые осуществляют эти реакции, стимулируют синтез гликогена и жира из глюкозы, производство глюкозы печенью посредством гликогенолиза и глюконеогенеза запрещены. Распад триглицеридов жировой тканью на свободные жирные кислоты и глицерин также ингибируется.
После того, как внутриклеточный сигнал, возник в результате связывания инсулина с его рецептором, был произведен, тогда необходимо прекращение передачи сигналов. Как указано ниже в разделе о деградации, эндоцитоз и деградация, связанного с инсулином рецептора, является основным механизмом прекращения передачи сигналов. Кроме того, сигнальный путь также заканчивается дефосфорилированием остатков тирозина в различных сигнальных путях тирозинфосфатазами. Известно также, что серин / треонинкиназы снижают активность инсулина.
Структура комплекса инсулин - рецептор инсулина была определена с использованием методов рентгеновской кристаллографии.
 Влияние инсулина на поглощение глюкозы и метаболизм. Инсулин связывается со своим рецептором (1), который запускает многие каскады активации белков (2). К ним относятся транслокация переносчика Glut-4 к плазматической мембране и приток глюкозы (3), синтез гликогена (4), гликолиз (5) и триглицерид синтез ( 6).
Влияние инсулина на поглощение глюкозы и метаболизм. Инсулин связывается со своим рецептором (1), который запускает многие каскады активации белков (2). К ним относятся транслокация переносчика Glut-4 к плазматической мембране и приток глюкозы (3), синтез гликогена (4), гликолиз (5) и триглицерид синтез ( 6).  Путь передачи сигнала инсулина начинается, когда инсулин связывается с белками инсулина. Как только путь трансдукции завершен, везикулы хранения GLUT-4 становятся одним целым с клеточной мембраной. В результате белковые каналы GLUT-4 встраиваются в мембрану, позволяя транспортировать глюкозу в клетку.
Путь передачи сигнала инсулина начинается, когда инсулин связывается с белками инсулина. Как только путь трансдукции завершен, везикулы хранения GLUT-4 становятся одним целым с клеточной мембраной. В результате белковые каналы GLUT-4 встраиваются в мембрану, позволяя транспортировать глюкозу в клетку. Действие инсулина на глобальный уровень метаболизма человека включает:
Действие инсулина (косвенное и прямое) на клетки включает:
Инсулин также влияет на другие функции организма, например податливость сосудов и познание. Когда инсулин попадает в мозг человека, он улучшает обучение и память, в частности, улучшает вербальную память. Усиление сигналов инсулина в мозг с помощью интраназального введения инсулина также усиливает острую терморегуляторную и глюкорегуляторную реакцию на прием пищи, что позволяет предположить, что инсулин центральной нервной системы широкого спектра гомеостатических или регуляторных процессов в теле человека. Инсулин также оказывает стимулирующее действие на гонадотропин-рилизинг-гормон из гипоталамуса, таким образом способствуя фертильности.
Как только молекула инсулина стыкуется с рецептора и вызвал его действие, он может быть высвобожден обратно во внеклеточную среду или может быть разрушен клеткой. Двумя участками клиренса инсулина являются печень и почки. Печень выводит большую часть инсулина при первом прохождении, тогда как почки выводят большую часть инсулина из большого круга кровообращения. Деградация обычно включает эндоцитоз комплекс инсулин-рецептор, за которым следует действие фермента, разлагающего инсулин. Предполагается, что молекула инсулина, эндогенно продуцируемая бета-клетками, разлагается в течение одного часа после ее выброса в выброс (период полувыведения инсулина ~ 4–6 минут).
Инсулин является основным регулятором эндоканнабиноидов (ЭК) метаболизма, и было показано, что лечение инсулином пониж внутриклеточные ЭК, 2-арахидонилглицерин (2-AG) и анандамид (AEA), которые соответствуют чувствительным к инсулину изменениям экспрессии ферментов метаболизма ЭК. В инсулинорезистентных адипоцитах паттерны индуцированной инсулином экспрессии фермента нарушены таким образом, чтобы соответствовать повышенному синтезу EC и снижению деградации EC. Полученные данные свидетельствуют о том, что инсулинорезистентные адипоциты не способны регулировать метаболизм ЭК и снижать внутриклеточные уровни ЭК в ответ на стимуляцию инсулином, в результате чего тучные инсулинорезистентные люди демонстрируют повышенные способности ЭК. Это нарушение регуляции чрезмерного накопления висцерального жира и снижение высвобождения адипонектина из абдоминальной жировой ткани, а также вызывает несколько кардиометаболических факторов риска, связанных с ожирением и типом 2. диабет.
Гипогликемия, также известная как «низкий уровень сахара в крови», когда уровень сахара в крови снижается до уровня ниже нормы. Это может привести к множеству симптомов, включая неуклюжесть, затруднения при разговоре, спутанность сознания, потерю сознания, судороги или смерть. Также может присутствовать чувство голода, потоотделения, дрожь и слабость. Симптомы обычно появляются быстро.
Наиболее частой причиной гипогликемии являются лекарства, используемые для лечения сахарного диабета, такие как инсулин и сульфонилмочевина. Риск выше у диабетиков, которые ели меньше, обычно, занимались физическими упражнениями больше, чем обычно, или употребляли алкоголь. Другие причины гипогликемии включают почечную недостаточность, некоторые опухоли, такие как инсулинома, заболевание печени, гипотиреоз, голодание, врожденная ошибка метаболизма, тяжелые инфекции, реактивная гипогликемия и ряд наркотиков, включая алкоголь. Низкий уровень сахара в крови может наблюдаться у здоровых детей, которые не ели в течение нескольких часов.
Есть несколько состояний, при нарушении которых инсулина является патологическим:
 флакон с инсулином. Производитель дал ему торговое название Актрапид.
флакон с инсулином. Производитель дал ему торговое название Актрапид. Биосинтетический человеческий инсулин (инсулинная человеческая рДНК, МНН) для клинического применения производства по технологии рекомбинантной ДНК. Биосинтетический человеческий инсулин имеет повышенную чистоту по сравнению с экстрактивным инсулином животного происхождения, повышенную чистоту, снижающую образование антител. Исследователям удалось внедрить ген человеческого инсулина в растения в качестве еще одного метода производства инсулина («биофарминг») из сафлора. Ожидается, что этот метод снизит производственные затраты.
Доступно несколько аналогов человеческого инсулина. Эти аналоги инсулина связаны со структурой человеческого инсулина и были разработаны для специального гликемического контроля с точки зрения быстрого действия (прандиальные инсулины) и длительного действия (базальные инсулины). Первый биосинтетический аналог инсулина разработан для клинического использования во время (прандиальный инсулин), Humalog (инсулин лизпро), он быстрее всасывается после подкожной инъекции, чем обычный инсулин, с эффектом еды через 15 минут после инъекции. Другими аналогами быстрого действия являются НовоРапид и Апидра с аналогичными профилями. Все они быстро всасываются благодаря аминокислотным последовательностям, которые уменьшают образование димеров и гексамеров (мономерные инсулины всасываются быстрее). Для инсулинов быстрого действия не требуется интервал от инъекции до еды, ранее рекомендованный для человеческого инсулина и инсулина животного происхождения. Другой тип - инсулин длительного действия; Первым из них был Лантус (инсулин гларгин). Они имеют устойчивый эффект в течение длительного периода от 18 до 24 часов. Аналогичным образом, другой аналог инсулина пролонгированного действия (Левемир ) основан на подходе ацилирования жирных кислот. К этому аналогу присоединена молекула миристиновой кислоты, которая связывает молекулу инсулина с обильным сывороточным альбумином, что, в свою очередь, увеличивает эффект и снижает риск гипогликемии. Оба аналога пролонгированного действия необходимо принимать только один раз в день и используются у больных сахарным диабетом 1 типа в качестве базального инсулина. Также доступна комбинация инсулина быстрого действия и инсулина пролонгированного действия, что делает более вероятным достижение пациентами профиля инсулина, имитирующего профиль собственного высвобождения инсулина организмом.
Инсулин обычно принимается подкожно инъекции одноразовыми шприцами с иглами, с помощью инсулиновой помпы или многократным инсулиновыми шприцами с одноразовыми иглы. Инсулин для ингаляции теперь также доступен на рынке США.
Синтетический инсулин может вызывать побочные эффекты, поэтому некоторые люди с диабетом полагаются на инсулин животного происхождения.
В отличие от многих лекарств, инсулин нельзя принимать внутрь, потому что, как и почти все другие белки, введенные в желудочно-кишечный тракт, восстанавливаются до фрагментов, после чего вся активность теряется. Были проведены некоторые исследования способов защиты инсулина от пищеварительного тракта, чтобы его можно было вводить перорально или сублингвально.
В 1869 г. изучая структуру поджелудочной железы под микроскопом, Пауль Лангерганс, студент-медик из Берлина, идентифицировал несколько ранее незамеченных скоплений ткани разбросаны по всей массе поджелудочной железы. Функция «маленьких кучей клеток», позже известных как островков Лангерганса, первоначально оставалась неизвестной, но Эдуард Лагес позже предположил, что они могут производить выделения которые играют регулирующую роль в пищеварении. Сын Пола Лангерганса, Арчибальд, также помог понять эту регулирующую роль.
В 1889 году врач Оскар Минковский в сотрудничестве с Джозефом фон Мерингом удалил поджелудочную железу у здоровой собаки, чтобы проверить ее предполагаемую роль в пищеварении. При анализе мочи они обнаружили сахар, впервые установив связь между поджелудочной железой и диабетом. В 1901 году американский врач и ученый Юджин Линдси Опи сделал еще один важный шаг, когда он выделил роль поджелудочной железы островкам Лангерганса: «Сахарный диабет в результате поражения поджелудочной железы. вызвано разрушением островов Лангерганса и происходит только тогда, когда эти тела частично или полностью разрушены ».
В течение следующих двух десятилетий исследователи предприняли несколько попыток изолировать выделения островков. В 1906 Джордж Людвиг Зуэльцер добился частичного успеха в лечении собак экстрактом поджелудочной железы, но не смог продолжить свою работу. Между 1911 и 1912 годами Э.Л. Скотт из Чикагского университета попробовал водные экстракты поджелудочной железы и отметил «небольшое уменьшение глюкозурии», но не смог убедить своего директора в ценности своей работы; он был закрыт. Исраэль Кляйнер продемонстрировал аналогичные эффекты в Университете Рокфеллера в 1915 году, но Первая мировая война прервала его работу, и он не вернулся к ней.
В 1916 году Николае Паулеску разработал водный панкреатический экстракт, который при введении диабетической собаке оказывал нормализующее действие на уровень сахара в крови. Ему пришлось прервать свои эксперименты из-за Первой мировой войны, и в 1921 году он написал четыре статьи о своей работе, выполненной в Бухаресте, и своих испытаниях на собаке с диабетом. Позже в том же году он опубликовал «Исследование роли поджелудочной железы в пищевом усвоении».
Название «инсулин» было придумано Эдвардом Альбертом Шарпи-Шафер в 1916 г. для гипотетической молекулы, продуцируемой островками Лангерганса поджелудочной железы (латинское insula для островка или островка), которая контролирует метаболизм глюкозы. Без ведома Шарпи-Шефера Жан де Мейер ввел очень похожее слово «инсулин» в 1909 году для той же молекулы.
В октябре 1920 года канадец Фредерик Бантинг пришел к выводу, что пищеварительные выделения, которые первоначально изучал Минковский, расщепляют секрецию островков, что делает невозможным успешное извлечение. Хирург по образованию, Бантинг знал, что закупорка протока поджелудочной железы приведет к атрофии большей части поджелудочной железы, а островки Лангерганса останутся нетронутыми. Он рассудил, что относительно чистый экстракт может быть получен из островков после того, как большая часть остальной части поджелудочной железы исчезнет. Он сделал себе заметку: «Перевяжите протоки поджелудочной железы собаки. Держите собак в живых до тех пор, пока ацинусы не разовьются, оставив островки. Постарайтесь изолировать их внутреннюю секрецию и уменьшить глюкозурию».
 Чарльз Бест и Кларк Нобл ок. 1920
Чарльз Бест и Кларк Нобл ок. 1920 Весной 1921 года Бантинг отправился в Торонто, чтобы объяснить свою идею J.J.R. Маклауд, профессор физиологии в Университете Торонто. Маклауд изначально был настроен скептически, поскольку Бантинг не имел опыта в исследованиях и не был знаком с последней литературой, но он согласился предоставить Бантингу место в лаборатории для проверки его идей. Маклауд также договорился о том, чтобы два студента были лаборантами Бантинга тем летом, но Бантингу требовался только один лаборант. Чарльз Бест и Кларк Ноубл подбросили монетку; Бест выиграл жеребьевку и занял первую смену. Это оказалось неудачным для Ноубл, поскольку Бантинг оставил Бест на все лето и в конце концов поделился с Бестом половиной своих денег, полученных при Нобелевской премии, и кредита за открытие. 30 июля 1921 года Бантинг и Бест успешно выделили экстракт («островок») из островков собаки с перевязанным каналом и вводили его собаке с диабетом, обнаружив, что экстракт снизил уровень сахара в крови на 40% за 1 час. 806>
Бантинг и Бест представили свои результаты Маклауду по возвращении в Торонто осенью 1921 года, но Маклауд указал на недостатки в схеме эксперимента и предложил повторить эксперименты с большим количеством собак и более совершенным оборудованием. Он перевел Бантинга и Беста в лабораторию получше и начал выплачивать Бантингу зарплату из своих исследовательских грантов. Через несколько недель второй раунд экспериментов также увенчался успехом, и Маклауд помог опубликовать их результаты в частном порядке в Торонто в ноябре того же года. В затруднительном положении из-за трудоемкой работы по перевязке протоков собак и ожидания нескольких недель для извлечения инсулина Бантинг натолкнулся на идею извлечения инсулина из поджелудочной железы теленка, у которой еще не развились пищеварительные железы. К декабрю им также удалось извлечь инсулин из поджелудочной железы взрослой коровы. Маклауд прекратил все другие исследования в своей лаборатории, чтобы сосредоточиться на очистке инсулина. Он пригласил биохимика Джеймса Коллипа помочь с этой задачей, и команда почувствовала себя готовой к клиническому испытанию в течение месяца.
 Диаграмма для Элизабет Хьюз, используемая для отслеживания крови, мочи, диеты в граммах и диетические рецепты в граммах
Диаграмма для Элизабет Хьюз, используемая для отслеживания крови, мочи, диеты в граммах и диетические рецепты в граммах 11 января 1922 года Леонард Томпсон, 14-летний диабетик, лежавший при смерти в Больнице общего профиля Торонто, получил первую инъекцию инсулин. Однако экстракт был настолько нечистым, что у Томпсона возникла тяжелая аллергическая реакция, и дальнейшие инъекции были отменены. В течение следующих 12 дней Коллип день и ночь работал над улучшением экстракта поджелудочной железы быка. Вторая доза была введена 23 января, что полностью устранило глюкозурию, которая была типичной для диабета, без каких-либо очевидных побочных эффектов. Первым американским пациентом была Элизабет Хьюз, дочь государственного секретаря США Чарльза Эванса Хьюза. Первым пациентом, пролеченным в США, был будущий художник по дереву Джеймс Д. Хэвенс ; Доктор Джон Ральстон Уильямс импортировал инсулин из Торонто в Рочестер, штат Нью-Йорк, чтобы лечить Хэвенс.
Бантинг и Бест никогда не работали с Коллипом, считая его чем-то вроде нарушителя, и вскоре после этого Коллип покинул проект. Весной 1922 года Бесту удалось улучшить свои методы до такой степени, что можно было извлекать большие количества инсулина по требованию, но препарат оставался нечистым. Фармацевтическая фирма Эли Лилли и Компания предложила вскоре после первых публикаций в 1921 году, и они приняли предложение Лилли в апреле. В ноябре главный химик Лилли Джордж Б. Уолден обнаружил изоэлектрическое осаждение и смог произвести большие количества высокоочищенного инсулина. Вскоре после этого инсулин был выставлен на продажу широкой публике.
К концу января 1922 года напряженность между четырьмя «соавторами» инсулина и Коллипом на короткое время угрожала раздельно запатентовать свой процесс очистки. Джон Г. Фитцджеральд, директор некоммерческого общественного здравоохранения Connaught Laboratories, поэтому выступил в качестве миротворца. В результате соглашения от 25 января 1922 г. были установлены два ключевых условия: 1) сотрудники подпишут договор, который соглашается не получать патент с коммерческой фармацевтической компании в течение начального периода работы с Connaught; и 2) что никакие изменения в исследованиях не будут разрешены, если они не опубликованы Фитцджеральдом и четырьмя сотрудниками. Это помогло сдержать разногласия и привязало исследование к публичному мандату Коннахта.
Первоначально Маклауд и Бантинг особенно неохотно патентовали процесс получения инсулина по медицинской этики. Однако оставались опасения, что частное третье лицо захватит и монополизирует исследование (как намекнули Eli Lilly and Company ), и что безопасное распространение будет трудно без возможности контроля качества. С этой целью Эдвард Келвин Кендалл дал ценный совет. Он выделил тироксин в клинике Майо в 1914 году и запатентовал процесс по соглашению между собой, братьями Мэйо и Университетом Миннесоты, передавая патент на государственный университет. 12 апреля Бантинг, Бест, Коллип, Маклауд и Фитцджеральд совместно написали президенту Университета Торонто, чтобы предложить аналогичную договоренность с целью передачи патента Совету управляющих университетов.. В письме подчеркивалось, что:
Патент не будет ни для каких целей, кроме как для предотвращения изъятия патента другими лицами. Когда подробности метода подготовки опубликованы, любой сможет подготовить отрывок, но не сможет обеспечить прибыльную монополию.
Задание Совета управляющих Университета Торонто было завершено 15 января 1923 г. токен платежа в размере 1,00 $. Эта договоренность была названа в The World's Work в 1923 году «Шаг вперед в медицинской этике». В 2010-х годах он также привлекал внимание средств массовой информации к проблеме здравоохранения и доступности лекарств.
. После беспокойства по поводу отдельных попыток Эли Лилли запатентовать части производственного процесса, помощник директора Connaught и Глава отдела инсулина Роберт Дефрис установил политику объединения патентов, которая требует от производителей беспрепятственно делиться любыми улучшениями производственного процесса без ущерба для доступности.
Очищенный инсулин животного происхождения изначально был единственным типом инсулина, доступным для экспериментов и диабетиков. Джон Джейкоб Абель был первым, кто произвел кристаллизованную форму в 1926 году. Доказательства белковой природы были впервые даны Майклом Сомоги, Эдвардом А. Дойзи и Филип А. Шаффер в 1924 году. Это было полностью доказано, когда Ханс Йенсен и Эрл А. Эванс-младший выделили аминокислоты фенилаланин и пролин в 1935 году.
Аминокислотная структура инсулина была впервые охарактеризована в 1951 году: 95>Фредерик Сэнгер, и первый синтетический инсулин был произведен одновременно в лабораториях Панайотиса Кацоянниса в Универсальном Питтсбурга и Гельмута Зана в RWTH Aachen University в середине 1960-х. Синтетический кристаллический бычий инсулин был получен китайскими исследователями в 1965 году. Полная трехмерная структура инсулина была определена с помощью рентгеновской кристаллографии в лаборатории Дороти Ходжкин в 1969 году.
Первый генно-инженерный синтетический «человеческий» инсулин был получен с использованием E. coli в 1978 году Артуром Риггсом и Кейичи Итакурой в Исследовательском институте Бекмана в Городе надежды в сотрудничестве с Герберт Бойер в Genentech. Genentech, основанная Swanson, Boyer и Eli Lilly and Company, продолжила в 1982 году продажу первого коммерческого доступного биосинтетического человеческого инсулина под торговой маркой Humulin. Подавляющее большинство инсулина, используемого во всем мире, представляет собой биосинтетический рекомбинантный «человеческий» инсулин или его аналоги. Недавно группа новаторских канадских исследователей применила другой подход, используя легко выращиваемое растение сафлор, для производства более дешевого инсулина.
Рекомбинантный инсулин производится либо в дрожжах (обычно Saccharomyces cerevisiae ) или E. coli. Вжжах дрожжей инсулин может быть сконструирован как одноцепочечный белок с участком эндопротеазы KexII (дрожжевой гомолог PCI / PCII), который отделяет цепь А инсулина от усеченной на С-конце В-цепи инсулина. Затем химически синтезированный C-концевой хвост прививается к инсулину путем обратного протеолиза с использованием недорогой протеазы трипсина; обычно лизин на С-конце хвоста защищен химической защитной группой для предотвращения протеолиза. Общие аналоги инсулина с С-концевыми модификациями (например, лизпро, аспарт, глулизин) Простота модульного синтеза и относительная безопасность модификаций в этой области. Синтез Genentech и полностью химический синтез, такой как синтез, выполненный Брюсом Меррифилдом, не являются предпочтительными, поскольку рекомбинации двух инсулиновых цепей низко, в первую очередь из-за конкуренции с преципитацией B-цепи инсулина.
 Фредерик Бантинг (справа), к которому присоединился Чарльз Бест 1924
Фредерик Бантинг (справа), к которому присоединился Чарльз Бест 1924 Комитет Нобелевской премии в 1923 году признал практическое извлечение инсулина команде из Торонто и присуждена Нобелевская премия двум мужчинам: Фредерику Бантингу и JJR Маклауд. Они были удостоены Нобелевской премии по физиологии и медицине в 1923 году за открытие инсулина. Бантинг, разгневанный тем, что Бест не упоминается, поделился с ним своим призом, и Маклауд немедленно поделился своим призом с Джеймсом Коллипом. Патент на инсулин был продан Университет Торонто за один доллар.
Две другие Нобелевские премии были присуждены за работы по инсулину. Британский молекулярный биолог Фредерик Сэнджер, который определил первичную устойчивость инсулина в 1955 году, удостоен Нобелевской премии по химии в 1958 году . Розалин Сассман Ялоу получил Нобелевскую премию по медицине 1977 года за приложение радиоиммуноанализа на инсулин.
Несколько Нобелевских премий также косвенно связаны с инсулином. Джордж Майнот, лауреат Нобелевской премии 1934 года за разработку первого эффективного лечения злокачественной анемии, страдал сахарным диабетом. Доктор Уильям Кастл заметил, что открытие в 1921 году инсулина, прибывшего вовремя, чтобы Майнот оставалось в живых, стало причиной открытия лекарства от пагубной анемии. Дороти Ходжкин была удостоена Нобелевской премии по химии в 1964 году за разработку кристаллографии, метода, который она использовала для расшифровки полной молекулярной структуры инсулина в 1969 году.
 Николае Паулеску
Николае Паулеску Работа, опубликованная Бантингом, Бестом, Коллипом и Маклеодом, представляет собой препарат очищенного экстракта инсулина, пригодный для использования на людях. Хотя Паулеску открыл принципы лечения, его солевой экстракт нельзя было использовать на людях; он не был упомянут в Нобелевской премии 1923 года. Профессор Ян Мюррей особенно активно работал над исправлением «исторической ошибки» в отношении Николае Паулеску. Мюррей был профессором физиологии в Медицинском колледже Андерсона в Глазго,, Скотле и, глава отделения метаболических заболеваний в ведущей больнице Глазго, вице-президент Британской ассоциации диабета и член-основатель Международная федерация диабета. Мюррей писал:
Недостаточное признание получил Паулеску, выдающийся румынский ученый, который в то время, когда команда из Торонто начинала свои исследования, уже преуспела в извлечении антидиабетического гормона поджелудочной железы и доказала его эффективность в снижении гипергликемии у собак с диабетом.
В частной беседе профессор Арне Тизелиус, бывший глава Нобелевского института, выразил свое личное мнение, что Паулеску был в равной степени достоинства награды в 1923 году.
| На Wikimedia Commons есть материалы, связанные с инсулином. |