Глюкагон - это пептидный гормон, продуцируемый альфа-клетками поджелудочной железы. Он работает для повышения концентрации глюкозы и жирных кислот в кровотоке и считается основным катаболическим гормоном организма. Он также используется в качестве лекарства для лечения ряда заболеваний. Его действие противоположно эффекту инсулина, который снижает уровень внеклеточной глюкозы. Он продуцируется из проглюкагона, кодируемого геном GCG.
Поджелудочная железа выделяет глюкагон, когда количество глюкозы в кровотоке слишком низкое. Глюкагон заставляет печень участвовать в гликогенолизе : преобразовании накопленного гликогена в глюкозу, которая попадает в кровоток. С другой стороны, высокий уровень глюкозы в крови стимулирует выброс инсулина. Инсулин позволяет глюкозе поглощаться и использоваться инсулинозависимыми тканями. Таким образом, глюкагон и инсулин являются частью системы обратной связи, которая поддерживает стабильный уровень глюкозы в крови. Глюкагон увеличивает расход энергии и его уровень повышается в условиях стресса. Глюкагон принадлежит к семейству гормонов секретинов.
Глюкагон обычно повышает концентрацию глюкозы в крови путем стимулирования глюконеогенеза и гликогенолиза. Глюкагон также снижает синтез жирных кислот в жировой ткани и печени, а также способствует липолизу в этих тканях, что заставляет их выделять жирные кислоты в кровоток, где они могут катаболизироваться для выработки энергии в тканях, таких как скелетные мышцы, при необходимости.
Глюкоза хранится в печени в форме полисахарида гликогена, который представляет собой глюкан (полимер, состоящий из молекул глюкозы). Клетки печени (гепатоциты ) имеют рецепторы глюкагона. Когда глюкагон связывается с рецепторами глюкагона, клетки печени превращают гликоген в отдельные молекулы глюкозы и высвобождают их в кровоток в процессе, известном как гликогенолиз. Когда эти запасы истощаются, глюкагон затем стимулирует печень и почки синтезировать дополнительную глюкозу посредством глюконеогенеза. Глюкагон выключает гликолиз в печени, в результате чего промежуточные гликолитические продукты переводятся в глюконеогенез.
Глюкагон также регулирует скорость производства глюкозы посредством липолиза. Глюкагон индуцирует липолиз у людей в условиях подавления инсулина (таких как сахарный диабет 1 типа ).
Производство глюкагона, по-видимому, зависит от центральной нервной системы через пути, которые еще не определены. Беспозвоночные животные, удаление стебля влияет на выработку глюкагона. Удаление стебля у молодых раков вызывает гипергликемию, вызванную глюкагоном.
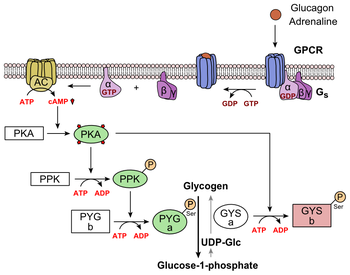 Метаболическая регуляция гликогена с помощью глюкагона.
Метаболическая регуляция гликогена с помощью глюкагона. Глюкагон связывается с рецептором глюкагона, рецептором, связанным с G-белком, расположенным в плазматической мембране клетки. Изменение конформации рецептора активирует G-белки, гетеротримерный белок с субъединицами α, β и γ. Когда белок G взаимодействует с рецептором, он претерпевает конформационное изменение, которое приводит к замене молекулы GDP, которая был связан с α-субъединицей с молекулой GTP. Это замещение приводит к в высвобождении α-субъединицы из β- и γ-субъединиц. Альфа-субъединица специфически активирует следующий фермент в каскаде, аденилатциклаза.
Аденилатциклаза производит циклический аденозинмонофосфат (циклический AMP или цАМФ), который активирует протеинкиназу A (цАМФ-зависимая протеинкиназа). Этот фермент, в свою очередь, активирует киназу фосфорилазы, которая затем фосфорилирует гликогенфосфорилазу b (PYG b), превращая ее в активную форму, называемую фосфорилазой a (PYG a). Фосфорилаза а - это фермент, ответственный за высвобождение глюкозо-1-фосфата из полимеров гликогена. Примером этого пути может быть соединение глюкагона с трансмембранным белком. Трансмембранные белки взаимодействуют с Gɑβ𝛾. Gɑ отделяется от Gβ𝛾 и взаимодействует с трансмембранным протеином аденилилциклазой. Аденилилциклаза катализирует превращение АТФ в цАМФ. цАМФ связывается с протеинкиназой А, и комплекс фосфорилирует киназу фосфорилазы. Фосфорилированная киназа фосфорилазы фосфорилирует фосфорилазу. Фосфорилированная фосфорилаза отщепляет единицы глюкозы от гликогена в виде глюкозо-1-фосфата. Кроме того, скоординированный контроль гликолиза и глюконеогенеза в печени регулируется состоянием фосфорилирования ферментов, которые катализируют образование мощного активатора гликолиза, называемого 2,6-бисфосфатом фруктозы. Фермент протеинкиназа A (PKA), который стимулировался каскадом, инициированным глюкагоном, также будет фосфорилировать один остаток серина бифункциональной полипептидной цепи, содержащей ферменты фруктозо-2,6-бисфосфатазу и фосфофруктокиназу-2. Это ковалентное фосфорилирование, инициированное глюкагоном, активирует первое и ингибирует второе. Это регулирует реакцию, катализирующую 2,6-бисфосфат фруктозы (мощный активатор фосфофруктокиназы-1, фермента, который является первичным регуляторным этапом гликолиза), замедляя скорость его образования, тем самым подавляя поток пути гликолиза и обеспечивая глюконеогенез. преобладать. Этот процесс обратим в отсутствие глюкагона (и, следовательно, в присутствии инсулина).
Стимуляция ПКА глюкагоном также инактивирует гликолитический фермент пируваткиназу в гепатоцитах.
 Микроскопическое изображение, окрашенное на глюкагон
Микроскопическое изображение, окрашенное на глюкагон Гормон синтезируется и секретируется альфа-клетками (α-клетками) островков Лангерганса, которые расположены в эндокринной части поджелудочной железы. Продукция, которая в противном случае происходит без ограничений, подавляется / регулируется амилином, пептидным гормоном, совместно секретируемым с инсулином β-клетками поджелудочной железы. По мере того, как уровни глюкозы в плазме снижаются, последующее снижение секреции амилина смягчает его подавление α-клеток, обеспечивая секрецию глюкагона.
У грызунов альфа-клетки расположены на внешнем крае островка. Структура островков человека гораздо менее сегрегирована, и альфа-клетки распределены по островку в непосредственной близости от бета-клеток. Глюкагон также продуцируется альфа-клетками желудка.
Недавние исследования показали, что производство глюкагона также может происходить за пределами поджелудочной железы, причем кишечник является наиболее вероятным местом экстрапанкреатического синтеза глюкагона.
Секреция глюкагона стимулируется:
Секреция глюкагона ингибируется: 437>Амилин
Глюкагон представляет собой 29- аминокислота полипептид. I ts первичная структура у людей: NH2 -His - Ser - Gln - Gly - Thr - Phe - Thr - Ser - Asp - Tyr - Ser - Lys - Tyr - Leu - Asp - Ser - Arg - Arg - Ala - Gln - Asp - Phe - Val - Gln - Trp - Leu - Met - Asn - Thr - COOH.
Полипептид имеет молекулярную массу 3485 дальтон. Глюкагон - это пептидный (не стероидный ) гормон.
Глюкагон образуется в результате расщепления проглюкагона пропротеинконвертазой 2 в α-клетках островков поджелудочной железы. В кишечных L-клетках, проглюкагон расщепляется до альтернативных продуктов - глицентина, GLP-1 (инкретин ), IP-2, и GLP-2 (способствует росту кишечника).
Аномально повышенные уровни глюкагона могут быть вызваны опухолями поджелудочной железы , такими как глюкагонома, симптомы которой включают некролитическую мигрирующую эритему, пониженное содержание аминокислот и гипергликемию. Это может происходить отдельно или в контексте множественной эндокринной неоплазии 1 типа
Повышенный уровень глюкагона является основным фактором гипергликемического кетоацидоза при недиагностированном или плохо леченном диабете 1 типа. Когда бета-клетки перестают функционировать, инсулин и ГАМК поджелудочной железы больше не присутствуют, чтобы подавить беспрепятственный выброс глюкагона. В результате глюкагон высвобождается из альфа-клеток в максимальном количестве, вызывая быстрое разложение гликогена до глюкозы и быстрый кетогенез. Было обнаружено, что подгруппе взрослых с диабетом 1 типа потребовалось в среднем в 4 раза больше времени, чтобы приблизиться к кетоацидозу, когда им давали соматостатин (ингибирует выработку глюкагона) без инсулина. Подавление глюкагона было популярной идеей лечения диабета, однако некоторые предупреждали, что это приведет к ломкому диабету у пациентов с достаточно стабильным уровнем глюкозы в крови.
Отсутствие альфа-клеток ( и, следовательно, глюкагон) считается одним из основных факторов, влияющих на крайнюю нестабильность глюкозы в крови при тотальной резекции поджелудочной железы.
В 1920-х годах Кимбалл и Мурлин изучали экстракты поджелудочной железы и обнаружили дополнительное вещество с гипергликемическими свойствами. Они описали глюкагон в 1923 году. Аминокислотная последовательность глюкагона была описана в конце 1950-х годов. Более полное понимание его роли в физиологии и болезнях не было установлено до 1970-х годов, когда был разработан специальный радиоиммуноанализ.
Кимбалл и Мурлин придумали термин глюкагон в 1923 году, когда они первоначально назвали вещество агонистом глюкозы.