 Обычный эпоксид.
Обычный эпоксид. Эпоксид - это циклический эфир с тройкой -атомное кольцо. Это кольцо приближается к равностороннему треугольнику, что делает его напряженным и, следовательно, более реактивным, чем другие эфиры. Они производятся в больших количествах для многих приложений. В общем, низкомолекулярные эпоксиды бесцветны, неполярны и часто летучие.
Соединение, содержащее эпоксидную функциональную группу, может быть названо эпоксидом, эпоксидом, оксираном и этоксилином. Простые эпоксиды часто называют оксидами. Таким образом, эпоксид этилена (C 2H4) представляет собой оксид этилена (C2H4O). Многие соединения имеют тривиальные названия; например, оксид этилена называют «оксираном». Некоторые названия подчеркивают присутствие эпоксидной функциональной группы, как в соединении 1,2-эпоксигептан, который также можно назвать оксидом 1,2-гептена.
A полимер, образованный из предшественников эпоксида, называется эпоксидом, но такие материалы не содержат эпоксидных групп (или содержат только несколько остаточных эпоксидных групп, которые остаются непрореагировавшими при образовании смолы).
В промышленности преобладающими эпоксидами являются оксид этилена и оксид пропилена, которые производятся соответственно в объемах приблизительно 15 и 3 миллионов тонн. / год.
Эпоксидирование этилена включает реакцию кислорода в соответствии со следующей стехиометрией :
Прямой реакция кислорода с алкенами полезна только для этого эпоксида. Обычно используются модифицированные гетерогенные серебряные катализаторы. Другие алкены не могут эффективно реагировать, даже пропилен, хотя катализаторы из Au на носителе TS-1 могут селективно осуществлять эпоксидирование пропилена.
Кроме того из этиленоксида большинство эпоксидов получают обработкой алкенов реагентами, содержащими пероксид, которые отдают один атом кислорода. На эти реакции влияют соображения безопасности, поскольку органические пероксиды склонны к самопроизвольному разложению или даже возгоранию.
Комплексы металлов являются полезными катализаторами эпоксидирования с участием пероксида водорода и алкилгидропероксидов. Пероксикарбоновые кислоты, которые являются более электрофильными, превращают алкены в эпоксиды без вмешательства металлических катализаторов. В специализированных областях применения используются другие пероксидсодержащие реагенты, такие как диметилдиоксиран. В зависимости от механизма реакции и геометрии исходного материала алкена могут образовываться цис- и / или транс-эпоксид диастереомеры. Кроме того, если в исходном материале присутствуют другие стереоцентры, они могут влиять на стереохимию эпоксидирования. Эпоксидирование, катализируемое металлами, впервые было исследовано с использованием трет-бутилгидропероксида (TBHP). Ассоциация TBHP с металлом (M) генерирует активный пероксокомплекс металла, содержащий группу MOOR, который затем переносит O-центр на алкен.
 Упрощенный механизм катализируемого металлами эпоксидирования алкенов пероксидными реагентами (ROOH).
Упрощенный механизм катализируемого металлами эпоксидирования алкенов пероксидными реагентами (ROOH).Органические пероксиды используются для производства пропиленоксида из пропилена. Также требуются катализаторы. В качестве источников кислорода можно использовать как трет-бутилгидропероксид, так и этилбензол гидропероксид.
Более типично для лабораторных операций, реакция Прилежаева. Этот подход включает окисление алкена пероксикислотой, такой как m-CPBA. Иллюстративным является эпоксидирование стирола с помощью пербензойной кислоты до оксида стирола :

. Реакция протекает по так называемому «механизму бабочки». Пероксид рассматривается как электрофил, а алкен - как нуклеофил. Реакция считается согласованной (цифры в механизме ниже приведены для упрощения). Механизм «бабочка» позволяет идеально позиционировать орбиталь O-O сигма-звезды для атаки электронов C-C Pi. Поскольку две связи разрываются и образуются с кислородом эпоксида, это формально является примером коарктатного переходного состояния..
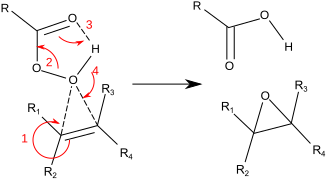
Гидропероксиды также используются в каталитических энантиоселективных эпоксидиях, таких как Шарплесса. эпоксидирование и эпоксидирование Якобсена. Вместе с эпоксидированием Ши эти реакции полезны для энантиоселективного синтеза хиральных эпоксидов. Оксазиридиновые реагенты также могут быть использованы для получения эпоксидов из алкенов.
оксиды аренов являются промежуточными продуктами окисления аренов цитохромом P450. Для прохиральных аренов (нафталин, толуол, бензоаты, бензопирен ) эпоксиды часто получают с высокой энантиоселективностью.
Хиральные эпоксиды часто могут быть получены энантиоселективно из прохиральных алкенов. Многие комплексы металлов дают активные катализаторы, но наиболее важными являются титан, ванадий и молибден.
Реакция эпоксидирования по Шарплесу является одной из главных энантиоселективных химические реакции. Используется для получения 2,3-эпоксиспиртов из первичных и вторичных аллиловых спиртов.
 Эпихлоргидрин, получают хлоргидриновым методом. Он является предшественником при производстве эпоксидных смол.
Эпихлоргидрин, получают хлоргидриновым методом. Он является предшественником при производстве эпоксидных смол.Этот метод включает дегидрогалогенирование. Это вариант синтеза эфира Вильямсона. В этом случае ион алкоксида внутримолекулярно замещает хлорид. Соединения-предшественники называются галогенгидринами и могут быть получены путем галогидратации алкена. Начиная с пропиленхлоргидрина, большая часть мировых поставок пропиленоксида возникает через этот путь.

Реакция образования внутримолекулярного эпоксида является одним из ключевых шагов в Дарценс. реакция.
В реакции Джонсона – Кори – Чайковского эпоксиды образуются из карбонильных групп и сульфониевых илидов. В этой реакции уходящей группой вместо хлорида является сульфоний.
Электронодефицитные олефины, такие как еноны и производные акрила, можно эпоксидировать с использованием нуклеофильных кислородных соединений, таких как пероксиды. Реакция - двухступенчатый механизм. Сначала кислород выполняет присоединение нуклеофильного конъюгата, чтобы получить стабилизированный карбанион. Затем этот карбанион атакует тот же атом кислорода, вытесняя из него уходящую группу, замыкая эпоксидное кольцо.
Эпоксиды редко встречаются в природе. Обычно они возникают в результате оксигенации алкенов под действием цитохрома P450. (но см. также короткоживущие эпоксиэйкозатриеновые кислоты, которые действуют как сигнальные молекулы. и аналогичные эпоксидокозапентаеновые кислоты и эпоксиэйкозатетраеновые кислоты.)
Реакции раскрытия кольца доминируют над реакционной способностью эпоксидов.
 Два пути гидролиза эпоксида.
Два пути гидролиза эпоксида.Спирты, вода, амины, тиолы и многие другие реагенты добавляют к эпоксидам. Эта реакция является основой двух коммерческих применений: образования эпоксидных клеев и производства гликолей. В кислых условиях на нуклеофильное добавление влияют стерические эффекты, как обычно наблюдается для реакций S N 2, а также стабильность возникающего карбокатиона (как обычно наблюдается для S N 1 реакций). Гидролиз эпоксида в присутствии кислотного катализатора генерирует гликоль.
Полимеризация эпоксидов дает простые полиэфиры. Например, этиленоксид полимеризуется с образованием полиэтиленгликоля, также известного как полиэтиленоксид. Реакция спирта или фенола с оксидом этилена, этоксилирование, широко используется для получения поверхностно-активных веществ:
С ангидридами эпоксиды дают полиэфиры.
Эпоксиды можно деоксигенировать с помощью оксофильных реагентов. Эта реакция может протекать с потерей или сохранением конфигурации. Комбинация гексахлорида вольфрама и н-бутиллитий дает алкен.

Бисфенол Диглицидиловый эфир является компонентом обычного домашнего «эпоксидного соединения».

Химическая структура эпоксида глицидола, обычного промежуточного химического соединения.

Эпотилоны представляют собой природные эпоксиды.

3,4-эпоксициклогексилметил-3 ', 4'-эпоксициклогексанкарбоксилат, предшественник покрытий.

Эпоксидированный линолеин, основной компонент эпоксидированного соевого масла (ESBO), коммерчески важный пластификатор.

оксид бензола находится в равновесии с изомером оксепина.
Оксид этилена широко используется для получения детергентов и поверхностно-активных веществ путем этоксилирования. Его гидролиз дает этиленгликоль. Он также используется для стерилизации медицинских инструментов и материалов.
Реакция эпоксидов с аминами является основой для образования эпоксидных клеев и конструкционных материалов. Типичный аминный отвердитель - это триэтилентетрамин (TETA).
.
Эпоксиды являются алкилирующими агентами, что делает многие из них высокотоксичными.