Эпоксидирование Ши - это химическая реакция, описываемая как асимметричная эпоксидирование алкенов с помощью оксона (пероксимоносульфат калия) и катализатора на основе фруктозы (1). Считается, что эта реакция протекает через промежуточное соединение диоксиран, образованное из кетона катализатора с помощью оксона (пероксимоносульфата калия). Добавление сульфатной группы к оксону облегчает образование диоксирана, действуя как хорошая уходящая группа во время замыкания цикла. Он отличается использованием неметаллического катализатора и представляет собой ранний пример органокатализа. Реакция была впервые обнаружена (史一安, пиньинь : Шо Йи-ан) из Университета штата Колорадо в 1996 году.
 Эпоксидирование Ши в современных условиях реакции
Эпоксидирование Ши в современных условиях реакции 
 оксоаммониевая соль
оксоаммониевая соль Было сделано много попыток синтеза эффективного неметаллического катализатора, прежде чем он был открыт. Проблема с предыдущими катализаторами заключалась в быстром разложении / окислении промежуточного диоксирана и отсутствии электрофильности реакционноспособного кетона. Были предложены ароматические кетоны, и были использованы многие последующие варианты солей оксоаммония, но они оказались неэффективными в промотировании эпоксидирования из-за окислительной нестабильности амидных групп и высокой гибкости семичленных колец. Энантиоселективность этих ранних катализаторов была также снижена из-за больших расстояний между асимметричными субъединицами и реакционными центрами, что давало менее 10 процентов энантиомерного избытка.
Катализатор, открытый группой Янь Ши в 1996 году, был получен из D-фруктозы, и имеет стереогенный центр, близкий к реакционному центру (кетону) - жесткая шестичленная кольцевая структура катализатора и соседняя четвертичная кольцевая группа минимизируют эпимеризацию этого стереоцентра. Окисление активным диоксирановым катализатором происходит от си-поверхности из-за стерических затруднений противоположной повторной поверхности. Этот катализатор эффективно функционирует как асимметричный катализатор нефункционализированных транс-олефинов.
 Катализатор, полученный из D-фруктозы
Катализатор, полученный из D-фруктозы При нормальных условиях pH, избыток 3 стехиометрических количеств кетонового катализатора необходимы из-за высокой скорости разложения. При основных условиях pH выше 10 (pH 10,5) для эпоксидирования необходимы субстехиометрические количества (0,2-0,3), снижающие разложение реагентов за счет предотвращения побочной реакции Байера-Виллигера. Более высокие температуры приводят к дальнейшему разложению; поэтому используется низкая температура, равная нулю градусов Цельсия.
 Двухфазный челнок, используемый при эпоксидировании.
Двухфазный челнок, используемый при эпоксидировании. Разложение реагентов является бимолекулярным (скорость реакции второго порядка ), поэтому используются низкие количества оксона и катализатора.
Реакция опосредуется катализатором, производным от D-фруктозы, который дает (R, R) энантиомер полученного эпоксида. Растворимость олефинового органического субстрата и окислителя (оксона) различается, и поэтому требуется двухфазная среда. Генерация активных частиц катализатора происходит в водном слое и перемещается в органический слой вместе с реагентами сульфатом тетрабутиламмония. Кетонный катализатор непрерывно регенерируется в каталитическом цикле и, таким образом, может катализировать эпоксидирование в небольших количествах.
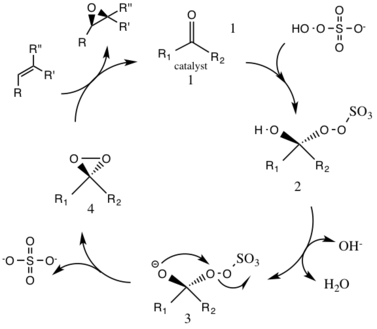 Каталитический цикл, демонстрирующий регенерацию катализатора D-фруктозы
Каталитический цикл, демонстрирующий регенерацию катализатора D-фруктозы Первым этапом в реакции каталитического цикла является реакция нуклеофильного присоединения оксона с кетонной группой на катализаторе ( средний 1). При этом образуется химически активный промежуточный продукт номер 2, промежуточный продукт Криджи, который потенциально может приводить к нежелательным побочным реакциям, таким как реакция Байера-Виллигера (см. Ниже). Образование промежуточных частиц номер 3 происходит в основных условиях с удалением водорода из гидроксигруппы с образованием нуклеофильного аниона кислорода. Сульфатная группа способствует последующему образованию диоксирана, промежуточного вида номер 4, действуя как хорошая уходящая группа во время 3-экзо-триг 3 циклизации. Активированные диоксирановые каталитические частицы затем переносят атом кислорода на алкен, что приводит к регенерации исходного катализатора.
Потенциальная побочная реакция, которая может произойти, - это Baeyer -Реакция Виллигера промежуточного соединения 2, где имеет место перегруппировка перокси группы, которая приводит к образованию соответствующего сложного эфира. Степень этой побочной реакции снижается с повышением pH и увеличивает нуклеофильность оксона, создавая основные условия, благоприятные для общего эпоксидирования и реакционной способности каталитических частиц.
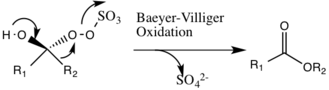 Образование побочных продуктов из Criegee Intermediate. Побочная реакция приводит к потере сульфат-аниона и образованию сложноэфирной разновидности.
Образование побочных продуктов из Criegee Intermediate. Побочная реакция приводит к потере сульфат-аниона и образованию сложноэфирной разновидности. Кислород из диоксирановой группы, образующейся на органическом катализаторе, переносится на алкен, в результате чего Считается, что это согласованный механизм, хотя присутствие кислородного аниона, промежуточного по механизму Sn2, может наблюдаться.
 Перенос диоксирана
Перенос диоксирана Катализатор образуется реакцией с ацетоном в основных условиях, при этом гидроксильные группы фруктозного кольца действуют как нуклеофилы, их нуклеофильность увеличивается за счет основных условия, создаваемые карбонатом калия. Электроноакцепторные заместители (альфа-эфирные группы) способствуют образованию кетона из окисляющего агента хлорхромата пиридиния за счет увеличения электрофильности карбонильного углерода посредством стабилизирующей делокализации образующихся π CC-связей в σ * CO-связи соседних простых эфиров.
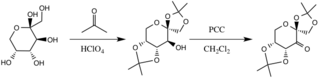 Приготовление катализатора (предшественник реакционноспособных частиц)
Приготовление катализатора (предшественник реакционноспособных частиц) Предлагаются два переходных состояния, геометрические формы которых предполагаются и не подтверждаются экспериментальными данными доказательства, но приписываются стереоэлектронным эффектам. Спиро-переходное состояние предпочтительнее планарного из-за несвязывающих орбиталей высшего кислорода, отдающего на π * антисвязывающие C-C-орбитали реагирующего алкена, обеспечивая стабилизирующую делокализацию электронов.
Пожертвование этих электронов на образующиеся σ-связи C-O эпоксидных связей также способствует образованию спиро-продукта (геометрия продукта также выровнена). Плоская конфигурация нежелательна из-за отсутствия обратной связи пи и стерических затруднений алкильных групп с большими алкильными функциональными группами каталитического кольца.
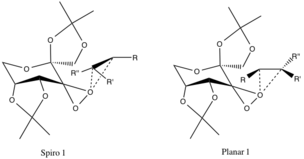 Предпочтительные спиро- и планарные переходные состояния три-замещенных олефинов
Предпочтительные спиро- и планарные переходные состояния три-замещенных олефинов Ранее упомянутые конфигурации предпочтительнее переходных состояний противоположных энантиомеров из-за неблагоприятных стерических взаимодействий между R-алкильными группами (см. Ниже) и простыми алкильными функциональными группами каталитического кольца.
 Неблагоприятные спиро- и плоские конфигурации переходного состояния
Неблагоприятные спиро- и плоские конфигурации переходного состояния Энантиомерный успех этого эпоксидирования относительно высок по сравнению с металлическими катализаторами и обычно приводит к высокому энантиомерному избытку, превышающему 80 процентов.
Эта процедура образует эпоксиды с высоким энантиомерным избытком из транс-дизамещенных алкенов и тризамещенных алкенов. Цис-дизамещенные алкены и стиролы асимметрично эпоксидируются с использованием аналогичного катализатора. Образование (R, R) эпоксидов из соответствующих алкенов увеличивает стереоселективность с увеличением стерического объема заместителей R-групп (особенно в транс-олефинах).
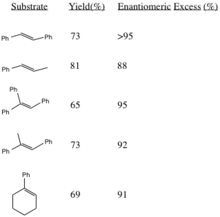 Примеры выхода олефинов
Примеры выхода олефинов