В химии, A нуклеофил представляет собой химические вещества, которые образуют связи с электрофильными, жертвуя собой электронную пару. Все молекулы и ионы со свободной парой электронов или хотя бы с одной пи-связью могут действовать как нуклеофилы. Поскольку нуклеофилы отдают электроны, они являются основаниями Льюиса.
Nucleophilic описывает сродство нуклеофила к связи с положительно заряженными атомными ядрами. Нуклеофильность, иногда называемая нуклеофильной силой, относится к нуклеофильному характеру вещества и часто используется для сравнения сродства атомов. Нейтральные нуклеофильные реакции с растворителями, такими как спирты и вода, называются сольволизом. Нуклеофилы могут принимать участие в нуклеофильном замещении, в результате чего нуклеофил притягивается к полному или частичному положительному заряду и нуклеофильному присоединению. Нуклеофильность тесно связана с основностью.
Термины нуклеофил и электрофил были введены Кристофером Келком Ингольдом в 1933 году, заменив термины анионоид и катионоид, предложенные ранее А. Дж. Лэпвортом в 1925 году. Слово нуклеофил происходит от ядра и греческого слова φιλος, философ, что означает друг.
В общем, в группе по периодической таблице, чем более щелочной ион (чем выше pK a конъюгированной кислоты), тем он более реакционноспособен как нуклеофил. В ряду нуклеофилов с одним и тем же атакующим элементом (например, кислородом) порядок нуклеофильности будет соответствовать основности. Сера в целом является лучшим нуклеофилом, чем кислород.
Было разработано множество схем, пытающихся количественно оценить относительную нуклеофильную силу. Следующие эмпирические данные были получены путем измерения скоростей реакций для многих реакций с участием многих нуклеофилов и электрофилов. Нуклеофилы, проявляющие так называемый альфа-эффект, обычно не используются при таком лечении.
Первая такая попытка была обнаружена в уравнении Суэйна – Скотта, полученном в 1953 году:
Это соотношение свободной энергии связывает константу скорости реакции псевдопервого порядка (в воде при 25 ° C), k, реакции, нормированной на скорость реакции, k 0, стандартной реакции с водой в качестве нуклеофила, с нуклеофильным константа n для данного нуклеофила и константа субстрата s, которая зависит от чувствительности субстрата к нуклеофильной атаке (определяется как 1 для бромистого метила ).
Эта обработка приводит к следующим значениям для типичных нуклеофильных анионов: ацетат 2,7, хлорид 3,0, азид 4,0, гидроксид 4,2, анилин 4,5, йодид 5,0 и тиосульфат 6,4. Типичные константы субстрата составляют 0,66 для этилтозилата, 0,77 для β-пропиолактона, 1,00 для 2,3-эпоксипропанола, 0,87 для бензилхлорида и 1,43 для бензоилхлорида.
Уравнение предсказывает, что, в нуклеофильном замещении на бензилхлориде, то азид анион реагирует в 3000 раз быстрее, чем вода.
Уравнение Ричи, полученное в 1972 году, представляет собой еще одно соотношение свободной энергии:
где N + - параметр, зависящий от нуклеофила, а k 0 - константа скорости реакции для воды. В этом уравнении отсутствует параметр, зависящий от субстрата, такой как s в уравнении Суэйна – Скотта. Уравнение утверждает, что два нуклеофила реагируют с одинаковой относительной реакционной способностью независимо от природы электрофила, что является нарушением принципа реакционная способность-селективность. По этой причине это уравнение также называется отношением постоянной селективности.
В исходной публикации данные были получены реакциями выбранных нуклеофилов с выбранными электрофильными карбокатионами, такими как катионы тропилия или диазония :

или (не отображается) ионы на основе малахитового зеленого. С тех пор было описано много других типов реакций.
Типичные значения N + по Ритчи (в метаноле ) составляют: 0,5 для метанола, 5,9 для аниона цианида, 7,5 для аниона метоксида, 8,5 для аниона азида и 10,7 для аниона тиофенола. Значения относительной реакционной способности катионов составляют -0,4 для катиона малахитового зеленого, +2,6 для катиона бензолдиазония и +4,5 для катиона тропилия.
В уравнении Майра – Патца (1994):
Константа скорости реакции второго порядка k при 20 ° C для реакции связана с параметром нуклеофильности N, параметром электрофильности E и параметром наклона s, зависящим от нуклеофилов. Константа s определяется как 1 с 2-метил-1-пентеном в качестве нуклеофила.
Многие из констант были получены в результате реакции так называемых ионов бензгидрилия как электрофилов :
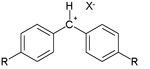
и разнообразный набор π-нуклеофилов:
 .
.Типичные значения E составляют +6,2 для R = хлор, +5,90 для R = водород, 0 для R = метокси и -7,02 для R = диметиламин.
Типичные значения N с х в скобках являются -4,47 (1,32) для электрофильного ароматического замещения в толуоле (1), -0,41 (1,12) для электрофильного присоединения к 1-фенил-2-пропен (2), и 0,96 (1) для того до 2-метил-1-пентена (3), -0,13 (1,21) для реакции с трифенилаллилсиланом (4), 3,61 (1,11) для реакции с 2-метилфураном (5), +7,48 (0,89) для реакции с изобутенилтрибутилстаннаном (6) и +13,36 (0,81) для реакции с енамином 7.
В круг органических реакций также входят реакции SN2 :
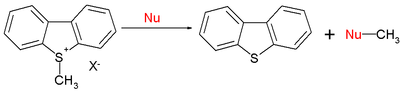
При E = -9,15 для иона S-метилдибензотиофения типичные нуклеофильные значения N (s) составляют 15,63 (0,64) для пиперидина, 10,49 (0,68) для метоксида и 5,20 (0,89) для воды. Короче говоря, нуклеофильность по отношению к центрам sp 2 или sp 3 следует той же схеме.
В попытке унифицировать описанные выше уравнения уравнение Майра переписывается как:
где s E - параметр наклона, зависящий от электрофилов, и s N - параметр наклона, зависящий от нуклеофилов. Это уравнение можно переписать несколькими способами:
Примерами нуклеофилов являются анионы, такие как Cl -, или соединение с неподеленной парой электронов, такое как NH 3 (аммиак), PR 3.
В приведенном ниже примере кислород гидроксид-иона отдает электронную пару для образования новой химической связи с углеродом на конце молекулы бромпропана. Связь между углеродом и бромом затем подвергается гетеролитическому делению, при этом атом брома забирает донированный электрон и становится бромид- ионом (Br -), потому что реакция S N 2 происходит посредством обратной атаки. Это означает, что ион гидроксида атакует атом углерода с другой стороны, как раз напротив иона брома. Из-за этой обратной атаки реакции S N 2 приводят к инверсии конфигурации электрофила. Если электрофил хиральный, он обычно сохраняет свою хиральность, хотя абсолютная конфигурация продукта S N 2 перевернута по сравнению с исходным электрофилом.

Амбидентный нуклеофил является тот, который может атаковать из двух или более мест, в результате чего два или более продуктов. Например, тиоцианат - ион (SCN -) может атаковать либо из S или N. По этой причине реакция S N 2 алкилгалогенида с SCN - часто приводит к смеси алкилтиоцианата (R-SCN) и алкилизотиоцианата (R-NCS). Аналогичные соображения применимы к синтезу нитрила Кольбе.
Хотя галогены не являются нуклеофильными в их двухатомной форме (например, I 2 не является нуклеофилом), их анионы являются хорошими нуклеофилами. В полярных протонных растворителях F - самый слабый нуклеофил, а I - самый сильный; этот порядок обратный в полярных апротонных растворителях.
Углерод нуклеофилами часто являются металлоорганические реагенты, такие как те, что в реакции Гриньяра, реакции Блэзом, реакции Реформатского, и реакция Барбье или реакции с участием литийорганических реагентов и ацетиленидов. Эти реагенты часто используются для нуклеофильных добавлений.
Энолы также являются нуклеофилами углерода. Образование енола катализируется кислотой или основанием. Энолы являются амбидентными нуклеофилами, но, как правило, нуклеофильными по альфа- атому углерода. Енолы обычно используются в реакциях конденсации, включая реакции конденсации Клайзена и реакции альдольной конденсации.
Примерами нуклеофилов кислорода являются вода (H 2 O), гидроксид- анион, спирты, алкоксид- анионы, пероксид водорода и карбоксилат-анионы. Нуклеофильная атака не происходит во время межмолекулярной водородной связи.
Из нуклеофилов серы, сероводорода и его солей, тиолов (RSH), тиолат-анионов (RS -), анионов тиолкарбоновых кислот (RC (O) -S -) и анионов дитиокарбонатов (RO-C (S) -S -) и дитиокарбаматы (R 2 N-C (S) -S -) используются наиболее часто.
В целом сера очень нуклеофильна из-за своего большого размера, что делает ее легко поляризуемой, а ее неподеленные пары электронов легко доступны.
Нуклеофилы азота включают аммиак, азид, амины, нитриты, гидроксиламин, гидразин, карбазид, фенилгидразин, семикарбазид и амид.
Хотя металлические центры (например, Li +, Zn 2+, Sc 3+ и т. Д.) Чаще всего являются катионными и электрофильными (кислота Льюиса) по природе, некоторые металлические центры (особенно те, которые находятся в низкой степени окисления и / или имеют отрицательный charge) являются одними из самых сильных зарегистрированных нуклеофилов и иногда называются «сверхнуклеофилами». Например, при использовании метилиодида в качестве эталонного электрофила Ph 3 Sn - примерно на 10000 нуклеофильнее, чем I -, в то время как форма Co (I) витамина B 12 (витамин B 12s) примерно в 10 7 раз более нуклеофильна. Другие супернуклеофильные центры металлов включают анионы карбонилметаллата с низкой степенью окисления (например, CpFe (CO) 2 -).