 | |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название ИЮПАК Гидроксид | |||
| Идентификаторы | |||
| Количество CAS | |||
| 3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| PubChem CID | |||
| UNII | |||
ИнЧИ
| |||
Улыбки
| |||
| Характеристики | |||
| Химическая формула | ОЙ- | ||
| Молярная масса | 17,007 г моль -1 | ||
| Конъюгированная кислота | Воды | ||
| Основание конъюгата | Оксид анион | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Гидроксид представляет собой двухатомный анион с химической формулой OH -. Она состоит из кислорода и водорода атома удерживаются вместе с помощью одной ковалентной связью, и несет отрицательный электрический заряд. Это важный, но обычно второстепенный компонент воды. Он действует как основание, лиганд, нуклеофил и катализатор. Ион гидроксида образует соли, некоторые из которых диссоциируют в водном растворе, высвобождая сольватированные ионы гидроксида. Гидроксид натрия - это товарный химический продукт с оборотом в несколько миллионов тонн в год. Гидроксид, присоединенный к сильно электроположительному центру, может сам ионизироваться, высвобождая катион водорода (H +), превращая исходное соединение в кислоту.
Соответствующее электрически нейтральное соединение НО • представляет собой гидроксильный радикал. Соответствующей ковалентно связанной группой атомов –ОН является гидроксильная группа. Ион гидроксида и гидроксильная группа являются нуклеофилами и могут действовать как катализаторы в органической химии.
Многие неорганические вещества, в названии которых присутствует слово « гидроксид», являются не ионными соединениями гидроксид-иона, а ковалентными соединениями, содержащими гидроксильные группы.
Ион гидроксида является естественной частью воды из-за реакции самоионизации, в которой его дополнение, гидроксоний, проходит через водород:
Константа равновесия этой реакции, определяемая как
имеет значение, близкое к 10 -14 при 25 ° C, поэтому концентрация гидроксид-ионов в чистой воде близка к 10 -7 моль ∙ дм -3, чтобы удовлетворить ограничению равного заряда. РН раствора равно десятичной кологарифм от катионов водорода концентрации; pH чистой воды близок к 7 при температуре окружающей среды. Концентрация гидроксид-ионов может быть выражена через pOH, который близок к (14 - pH), поэтому pOH чистой воды также близок к 7. Добавление основания к воде снижает концентрацию катионов водорода и, следовательно, увеличивает концентрация гидроксид-иона (увеличение pH, уменьшение pOH), даже если само основание не содержит гидроксида. Например, растворы аммиака имеют pH больше 7 из-за реакции NH 3 + H + ⇌ NH+ 4, что снижает концентрацию катионов водорода, что увеличивает концентрацию гидроксид-иона. pOH можно поддерживать на почти постоянном уровне с помощью различных буферных растворов.
 Схематическое изображение иона бигидроксида
Схематическое изображение иона бигидроксида В водном растворе ион гидроксида является основанием в смысле Бренстеда – Лоури, поскольку он может принимать протон из кислоты Бренстеда – Лоури с образованием молекулы воды. Он также может действовать как основание Льюиса, отдавая пару электронов кислоте Льюиса. В водном растворе ионы водорода и гидроксид-ионы сильно сольватированы с водородными связями между атомами кислорода и водорода. Действительно, бигидроксид-ион H 3О- 2был охарактеризован в твердом состоянии. Это соединение центросимметрично и имеет очень короткую водородную связь (114,5 мкм ), которая аналогична длине в бифторид- ионе HF.- 2(114 вечера). В водном растворе ион гидроксида образует прочные водородные связи с молекулами воды. Следствием этого является то, что концентрированные растворы гидроксида натрия имеют высокую вязкость из-за образования протяженной сети водородных связей, как в растворах фтороводорода.
В растворе на воздухе гидроксид-ион быстро реагирует с атмосферным диоксидом углерода, действуя как кислота, с образованием первоначально бикарбонат- иона.
Константа равновесия для этой реакции может быть указана либо как реакция с растворенным диоксидом углерода, либо как реакция с газообразным диоксидом углерода ( значения и подробности см. В Угольной кислоте ). При нейтральном или кислом pH реакция протекает медленно, но катализируется ферментом карбоангидразой, который эффективно создает ионы гидроксида в активном центре.
Растворы, содержащие стекло, разрушающее гидроксид-ион. В этом случае силикаты в стекле действуют как кислоты. Основные гидроксиды, твердые или в растворе, хранятся в герметичных пластиковых контейнерах.
Гидроксида функция ион может как типичный электрон-донорного лиганда, образуя такие комплексы, как tetrahydroxoaluminate / tetrahydroxido алюмината [Al (OH) 4 ] -. Он также часто встречается в комплексах со смешанными лигандами типа [ML x (OH) y ] z +, где L - лиганд. Ион гидроксида часто служит мостиковым лигандом, отдавая одну пару электронов каждому из соединяемых атомов. Как проиллюстрировано [Pb 2 (OH)] 3+, гидроксиды металлов часто записываются в упрощенном формате. Он может даже действовать как донор 3-электронных пар, как в тетрамере [PtMe 3 (OH)] 4.
При связывании с сильно электроноакцепторным металлическим центром гидроксидные лиганды имеют тенденцию ионизироваться с образованием оксидных лигандов. Например, бихромат-ион [HCrO 4 ] - диссоциирует согласно
с ap K a около 5,9.
ИК - спектры соединений, содержащих ОН - функциональную группу, имеют сильные полосы поглощения в область с центром около 3500 см -1. Высокая частота молекулярных колебаний является следствием малой массы атома водорода по сравнению с массой атома кислорода, и это делает относительно простым обнаружение гидроксильных групп с помощью инфракрасной спектроскопии. Полоса из-за группы ОН имеет тенденцию быть резкой. Однако ширина полосы увеличивается, когда группа ОН участвует в образовании водородных связей. Молекула воды имеет изгибную моду HOH примерно при 1600 см -1, поэтому отсутствие этой полосы можно использовать, чтобы отличить группу OH от молекулы воды.
Когда группа ОН связана с ионом металла в координационном комплексе, может наблюдаться режим изгиба M-OH. Например, в [Sn (OH) 6 ] 2– это происходит при 1065 см -1. Изгибной режим для мостикового гидроксида имеет тенденцию иметь более низкую частоту, как в [( бипиридин ) Cu (OH) 2 Cu ( бипиридин )] 2+ (955 см -1). Валентные колебания M-OH происходят ниже примерно 600 см -1. Например, тетраэдрический ион [Zn (OH) 4 ] 2- имеет полосы при 470 см -1 ( комбинационно- активный, поляризованный) и 420 см -1 (инфракрасный). Этот же ион имеет деформационное колебание (HO) –Zn– (OH) при 300 см –1.
Растворы гидроксида натрия, также известные как щелок и каустическая сода, используются в производстве целлюлозы и бумаги, текстильных изделий, питьевой воды, мыла и моющих средств, а также в качестве очистителя канализации. Мировое производство в 2004 году составило около 60 миллионов тонн. Основной метод производства - хлористоводородный щелочной процесс.
Растворы, содержащие ион гидроксида, образуются при растворении соли слабой кислоты в воде. Карбонат натрия используется в качестве щелочи, например, в результате реакции гидролиза.
Хотя основная прочность растворов карбоната натрия ниже, чем у концентрированного раствора гидроксида натрия, он имеет то преимущество, что он твердый. Он также производится в огромных количествах (42 миллиона тонн в 2005 году) по технологии Solvay. Пример использования карбоната натрия в качестве щелочи - это когда промывочная сода (другое название карбоната натрия) действует на нерастворимые сложные эфиры, такие как триглицериды, обычно известные как жиры, гидролизуя их и делая растворимыми.
Боксит, основной гидроксид алюминия, является основной рудой, из которой производится этот металл. Точно так же гетит (α-FeO (OH)) и лепидокрокит (γ-FeO (OH)), основные гидроксиды железа, входят в число основных руд, используемых для производства металлического железа.
Помимо NaOH и KOH, которые находят применение в очень широком масштабе, также можно использовать гидроксиды других щелочных металлов. Гидроксид лития является сильным основанием с p K b -0,36. Гидроксид лития используется в системах очистки дыхательного газа для космических аппаратов, подводных лодок и ребризеров для удаления углекислого газа из выдыхаемого газа.
Гидроксид лития предпочтительнее гидроксида натрия из-за его меньшей массы. Гидроксид натрия, гидроксид калия, и гидроксиды других щелочных металлов также являются сильными основаниями.
 Продукт тримерного гидролиза дикатиона бериллия
Продукт тримерного гидролиза дикатиона бериллия  Гидролиз бериллия в зависимости от pH Молекулы воды, присоединенные к Be, не показаны.
Гидролиз бериллия в зависимости от pH Молекулы воды, присоединенные к Be, не показаны. Бериллий гидроксид В (ОН) 2 является амфотерным. Сам гидроксид нерастворим в воде с произведением растворимости log K * sp, равным -11,7. Добавление кислоты дает растворимые продукты гидролиза, включая тримерный ион [Be 3 (OH) 3 (H 2 O) 6 ] 3+, который имеет группы OH, соединяющие пары ионов бериллия, образующие 6-членное кольцо. При очень низком pH образуется акваион [Be (H 2 O) 4 ] 2+. Добавление гидроксида к Be (ОН) 2 дает растворимый tetrahydroxoberyllate / tetrahydroxido beryllate анион, [Be (OH) 4 ] 2-.
Растворимость в воде других гидроксидов этой группы увеличивается с увеличением атомного номера. Гидроксид магния Mg (OH) 2 является сильным основанием (вплоть до предела его растворимости, которая является очень низкой в чистой воде), как и гидроксиды тяжелых щелочноземельных металлов: гидроксид кальция, стронция гидроксид, и гидроксид бария. Раствор или суспензия гидроксида кальция, известная как известковая вода, может использоваться для проверки на слабокислый диоксид углерода. Реакция Ca (OH) 2 + CO 2 ⇌ Ca 2+ + HCO- 3+ OH - показывает основность гидроксида кальция. Натровая известь, которая представляет собой смесь сильных оснований NaOH и KOH с Ca (OH) 2, используется в качестве поглотителя CO 2.
 Гидролиз алюминия в зависимости от pH. Молекулы воды, присоединенные к Al, не показаны.
Гидролиз алюминия в зависимости от pH. Молекулы воды, присоединенные к Al, не показаны. Простейший гидроксид бора B (OH) 3, известный как борная кислота, представляет собой кислоту. В отличие от гидроксидов гидроксидов щелочных и щелочноземельных металлов, он не диссоциирует в водном растворе. Вместо этого он реагирует с молекулами воды, действующими как кислота Льюиса, высвобождая протоны.
Известны различные оксианионы бора, которые в протонированной форме содержат гидроксидные группы.
 Ион тетрагидроксоалюмината (III)
Ион тетрагидроксоалюмината (III) Гидроксид алюминия Al (OH) 3 является амфотерным и растворяется в щелочном растворе.
В процессе Байера для производства чистого оксида алюминия из бокситовых минералов это равновесие регулируется путем тщательного контроля температуры и концентрации щелочи. На первом этапе алюминий растворяется в горячем щелочном растворе в виде Al (OH).- 4, но другие гидроксиды, обычно присутствующие в минерале, такие как гидроксиды железа, не растворяются, потому что они не амфотерные. После удаления нерастворимых веществ, так называемого красного шлама, чистый гидроксид алюминия осаждается путем снижения температуры и добавления воды к экстракту, что за счет разбавления щелочи снижает pH раствора. Основной гидроксид алюминия AlO (OH), который может присутствовать в боксите, также является амфотерным.
В слабокислых растворах гидроксо / гидроксидные комплексы, образованные алюминием, несколько отличаются от комплексов бора, что отражает больший размер Al (III) по сравнению с B (III). Концентрация частиц [Al 13 (OH) 32 ] 7+ очень зависит от общей концентрации алюминия. Различные другие гидроксокомплексы встречаются в кристаллических соединениях. Возможно, наиболее важным из них является основной гидроксид AlO (OH), полимерный материал, известный под названиями минеральных форм бемита или диаспора, в зависимости от кристаллической структуры. Гидроксида галлия, индия гидроксид, и таллия (III), гидроксид также являются амфотерными. Гидроксид таллия (I) - сильное основание.
Углерод не образует простых гидроксидов. Гипотетическое соединение C (OH) 4 ( ортокарбоновая кислота или метантетрол) нестабильно в водном растворе:
Диоксид углерода также известен как угольный ангидрид, что означает, что он образуется при дегидратации угольной кислоты H 2 CO 3 (OC (OH) 2).
Кремниевая кислота - это название, данное множеству соединений с общей формулой [SiO x (OH) 4-2 x ] n. Ортокремниевая кислота была обнаружена в очень разбавленном водном растворе. Это слабая кислота с p K a1 = 9,84, p K a2 = 13,2 при 25 ° C. Обычно его записывают как H 4 SiO 4, но общепринята формула Si (OH) 4. Были охарактеризованы другие кремниевые кислоты, такие как метакремниевая кислота (H 2 SiO 3), дисиликоновая кислота (H 2 Si 2 O 5) и пирокремниевая кислота (H 6 Si 2 O 7). Эти кислоты также имеют гидроксидные группы, присоединенные к кремнию; формулы предполагают, что эти кислоты представляют собой протонированные формы полиоксианионов.
Охарактеризовано несколько гидроксокомплексов германия. Гидроксид олова (II) Sn (OH) 2 получали в безводной среде. При обработке оксида олова (II) щелочью пирамидальный гидроксокомплекс Sn (OH)- 3сформирован. Когда растворы, содержащие этот ион, подкисляются, ион [Sn 3 (OH) 4 ] 2+ образуется вместе с некоторыми основными гидроксокомплексами. В структуре [Sn 3 (OH) 4 ] 2+ есть треугольник из атомов олова, соединенных мостиковыми гидроксидными группами. Гидроксид олова (IV) неизвестен, но может рассматриваться как гипотетическая кислота, из которой станнаты с формулой [Sn (OH) 6 ] 2- получают реакцией с основным гидроксид-ионом (Льюиса).
Гидролиз Pb 2+ в водном растворе сопровождается образованием различных гидроксосодержащих комплексов, некоторые из которых нерастворимы. Основной гидроксокомплекс [Pb 6 O (OH) 6 ] 4+ представляет собой кластер из шести центров свинца со связями металл-металл, окружающих центральный ион оксида. Шесть гидроксидных групп лежат на гранях двух внешних тетраэдров Pb 4. В сильнощелочных растворах образуются растворимые ионы плюмбата, в том числе [Pb (OH) 6 ] 2–.
 |  |  |  |  |  |
| Фосфористая кислота | Фосфорная кислота | Серная кислота | Теллуровая кислота | Орто - периодная кислота | Ксениновая кислота |
В более высоких степенях окисления пниктогенов, халькогенов, галогенов и благородных газов есть оксокислоты, в которых центральный атом присоединен к ионам оксида и ионам гидроксида. Примеры включают фосфорную кислоту H 3 PO 4 и серную кислоту H 2 SO 4. В этих соединениях одна или несколько гидроксидных групп могут диссоциировать с высвобождением катионов водорода, как в стандартной кислоте Бренстеда – Лоури. Известно много оксокислот серы, и все они содержат группы ОН, которые могут диссоциировать.
Теллуровая кислота часто записывается формулой H 2 TeO 4 2H 2 O, но структурно ее лучше описать как Te (OH) 6.
Орт -периодическая кислота может потерять все свои протоны, в конечном счете, образующий ион периодата [IO 4 ] -. Его также можно протонировать в сильнокислых условиях с образованием октаэдрического иона [I (OH) 6 ] +, завершающего изоэлектронный ряд, [E (OH) 6 ] z, E = Sn, Sb, Te, I; г = -2, -1, 0, +1. Другие кислоты, йод (VII), которые содержат гидроксид группы, известны, в частности, в солях, такие как мезо периодат ион, что происходит в K 4 [I 2 O 8 (OH) 2 ] 8H 2 O.
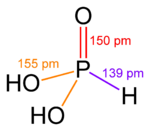
Как это обычно бывает за пределами щелочных металлов, гидроксиды элементов в более низких степенях окисления сложны. Например, фосфористая кислота H 3 PO 3 преимущественно имеет структуру OP (H) (OH) 2 в равновесии с небольшим количеством P (OH) 3.
Оксокислоты хлора, брома и йода имеют формулу O п −1/2A (OH), где n - степень окисления : +1, +3, +5 или +7, и A = Cl, Br или I. Единственная оксокислота фтора - это F (OH), гипофтористая кислота. Когда эти кислоты нейтрализуются, атом водорода удаляется из гидроксидной группы.
Гидроксиды переходных металлов и пост-переходных металлов обычно имеют металл в степени окисления +2 (M = Mn, Fe, Co, Ni, Cu, Zn) или +3 (M = Fe, Ru, Rh, Ir).. Ни один из них не растворим в воде, и многие из них плохо определены. Одной из сложных особенностей гидроксидов является их тенденция к дальнейшей конденсации с образованием оксидов, процессу, называемому олатированием. Гидроксиды металлов в степени окисления +1 также плохо определены или нестабильны. Например, гидроксид серебра Ag (OH) самопроизвольно разлагается до оксида (Ag 2 O). Гидроксиды меди (I) и золота (I) также нестабильны, хотя известны стабильные аддукты CuOH и AuOH. Полимерные соединения M (OH) 2 и M (OH) 3 обычно получают путем увеличения pH водных растворов соответствующих катионов металлов до тех пор, пока гидроксид не выпадет в осадок из раствора. Наоборот, гидроксиды растворяются в кислом растворе. Цинк гидроксид Zn (OH) 2 является амфотерным, образуя tetrahydroxido цинкатного иона Zn (OH)2- 4 в сильнощелочном растворе.
Существуют многочисленные смешанные лигандные комплексы этих металлов с гидроксид-ионом. Фактически, они, как правило, лучше определены, чем более простые производные. Многие из них могут быть получены депротонированием соответствующего комплекса металлов.
Ванадиевая кислота Н 3 ВО 4 показывает сходство с фосфорной кислотой H 3 PO 4, хотя она имеет гораздо более сложный ванадат химии oxoanion. Хромовая кислота H 2 CrO 4 имеет сходство с серной кислотой H 2 SO 4 ; например, оба образуют кислые соли A + [HMO 4 ] -. Некоторые металлы, например V, Cr, Nb, Ta, Mo, W, имеют тенденцию находиться в высоких степенях окисления. Вместо того, чтобы образовывать гидроксиды в водном растворе, они превращаются в оксокластеры в процессе олирования, образуя полиоксометаллаты.
В некоторых случаях продукты частичного гидролиза иона металла, описанные выше, могут быть обнаружены в кристаллических соединениях. Яркий пример - цирконий (IV). Из-за высокой степени окисления соли Zr 4+ сильно гидролизуются в воде даже при низком pH. Соединение, первоначально сформулированное как ZrOCl 2 8H 2 O, оказалось хлоридной солью тетрамерного катиона [Zr 4 (OH) 8 (H 2 O) 16 ] 8+, в котором есть квадрат ионов Zr 4+ с две гидроксидные группы, соединяющие атомы Zr с каждой стороны квадрата, и с четырьмя молекулами воды, прикрепленными к каждому атому Zr.
Минерал малахит является типичным примером основного карбоната. Формула, Cu 2 CO 3 (ОН) 2 показывает, что на полпути между карбонатом меди и гидроксидом меди. Действительно, раньше формула записывалась как CuCO 3 Cu (OH) 2. Кристаллическая структура состоит из меди, карбонат и гидроксид - ионы. Минерал атакамит является примером основного хлорида. Он имеет формулу Cu 2 Cl (OH) 3. В этом случае состав ближе к гидроксиду, чем к хлориду CuCl 2 3Cu (OH) 2. Медь образует гидроксифосфат ( либетенит ), арсенат ( оливенит ), сульфат ( брошантит ) и нитратные соединения. Белый свинец - это основной карбонат свинца (PbCO 3) 2 Pb (OH) 2, который использовался в качестве белого пигмента из-за его непрозрачности, хотя его использование в настоящее время ограничено, поскольку он может быть источником отравления свинцом.
Ион гидроксида, по-видимому, свободно вращается в кристаллах гидроксидов более тяжелых щелочных металлов при более высоких температурах, так что он представляет собой сферический ион с эффективным ионным радиусом около 153 мкм. Таким образом, высокотемпературные формы KOH и NaOH имеют структуру хлорида натрия, которая постепенно застывает в моноклинно искаженной структуре хлорида натрия при температурах ниже примерно 300 ° C. Группы ОН все еще вращаются вокруг своих осей симметрии даже при комнатной температуре и, следовательно, не могут быть обнаружены с помощью дифракции рентгеновских лучей. Форма NaOH при комнатной температуре имеет структуру иодида таллия. Однако LiOH имеет слоистую структуру, состоящую из тетраэдрических звеньев Li (OH) 4 и (OH) Li 4. Это согласуется со слабоосновным характером LiOH в растворе, указывая на то, что связь Li – OH имеет сильно ковалентный характер.
Гидроксид-ион демонстрирует цилиндрическую симметрию в гидроксидах двухвалентных металлов Ca, Cd, Mn, Fe и Co. Например, гидроксид магния Mg (OH) 2 ( брусит ) кристаллизуется со структурой слоя иодида кадмия с своего рода плотной упаковкой. магния и гидроксид-ионов.
Амфотерный гидроксид Al (OH) 3 имеет четыре основные кристаллические формы: гиббсит (наиболее стабильный), байерита, нордстрандит и doyleite. Все эти полиморфы состоят из двойных слоев гидроксид-ионов - атомов алюминия на двух третях октаэдрических отверстий между двумя слоями - и отличаются только последовательностью укладки слоев. Структуры похожи на структуру брусита. Однако, в то время как структуру брусита можно описать как структуру с плотной упаковкой в гиббсите, группы ОН на нижней стороне одного слоя опираются на группы нижележащего слоя. Такое расположение привело к предположению, что между группами ОН в соседних слоях существуют направленные связи. Это необычная форма водородной связи, поскольку два гидроксид-иона должны указывать друг от друга. Атомы водорода были обнаружены с помощью нейтронографических экспериментов на α-AlO (OH) ( диаспор ). Расстояние O – H – O очень короткое, 265 пм; водород не равноудалён между атомами кислорода, а короткая связь ОН составляет угол 12 ° с линией O — O. Подобный тип водородной связи был предложен для других амфотерных гидроксидов, включая Be (OH) 2, Zn (OH) 2 и Fe (OH) 3.
Известен ряд смешанных гидроксидов со стехиометрией A 3 M III (OH) 6, A 2 M IV (OH) 6 и AM V (OH) 6. Судя по формуле, эти вещества содержат октаэдрические структурные единицы M (OH) 6. Слоистые двойные гидроксиды могут быть представлены формулой [Mг + 1 - хM3+ х(ОЙ) 2] q + (X n -) q ⁄ n Y H 2O. Чаще всего z = 2 и M 2+ = Ca 2+, Mg 2+, Mn 2+, Fe 2+, Co 2+, Ni 2+, Cu 2+ или Zn 2+ ; следовательно, q = x.
Гидроксид калия и гидроксид натрия являются два хорошо известных реагентов в органической химии.
Ион гидроксида может действовать как основной катализатор. Основание отрывает протон от слабой кислоты, чтобы получить промежуточное соединение, которое продолжает реагировать с другим реагентом. Обычными субстратами для отрыва протонов являются спирты, фенолы, амины и углеродные кислоты. Р К значению для диссоциации С-Н - связи является чрезвычайно высоким, но рК а альфа - водороды из карбонильного соединения около 3 логарифмических единицы снижения. Типичные значения p K a составляют 16,7 для ацетальдегида и 19 для ацетона. Диссоциация может происходить в присутствии подходящего основания.
Основание должно иметь AP K на величину не менее чем около 4 логарифмических единиц меньше, или равновесие будет лежать почти полностью влево.
Ион гидроксида сам по себе не является достаточно сильным основанием, но его можно превратить в одно, добавив гидроксид натрия к этанолу.
для производства этоксид- иона. Значение pK a для самодиссоциации этанола составляет около 16, поэтому ион алкоксида является достаточно сильным основанием. Добавление спирта к альдегиду с образованием полуацеталя является примером реакции, которая может катализироваться в присутствии гидроксида. Гидроксид также может действовать как катализатор на основе основания Льюиса.
 Нуклеофильное ацильное замещение нуклеофилом (Nu) и уходящей группой (L)
Нуклеофильное ацильное замещение нуклеофилом (Nu) и уходящей группой (L) Ион гидроксида занимает промежуточное положение по нуклеофильности между фторид- ионом F - и амид- ионом NH.- 2. Гидролиз сложного эфира
также известное как омыление, является примером нуклеофильного ацильного замещения с ионом гидроксида, действующим как нуклеофил. В этом случае уходящей группой является ион алкоксида, который немедленно удаляет протон из молекулы воды с образованием спирта. При производстве мыла добавляют хлорид натрия, чтобы высолить натриевую соль карбоновой кислоты; это пример применения общего ионного эффекта.
Другими случаями, когда гидроксид может действовать как нуклеофильный реагент, являются гидролиз амида, реакция Канниццаро, нуклеофильное алифатическое замещение, нуклеофильное ароматическое замещение и реакции элиминирования. Реакционной средой для КОН и NaOH обычно является вода, но с катализатором межфазного переноса анион гидроксида также может быть переведен в органический растворитель, например, при образовании реакционноспособного промежуточного соединения дихлоркарбена.