| Карбонатдегидратаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Ленточная диаграмма человеческой карбоангидразы II, с ионами цинка, видимыми на центр Ленточная диаграмма человеческой карбоангидразы II, с ионами цинка, видимыми на центр | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 4.2.1.1 | ||||||||
| Номер CAS | 9001-03-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| Карбоангидраза эукариотического типа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Карбангидраза | ||||||||
| Pfam | PF00194 | ||||||||
| InterPro | IPR001148 | ||||||||
| PROSITE | PDOC00146 | ||||||||
| SCOPe | 1can / SUPFAM | ||||||||
| Мембранома | 333 | ||||||||
| |||||||||
угольные ангидразы (или карбонатдегидратазы ) образуют семейство ферментов, которые катализировать взаимное превращение между диоксидом углерода и водой и диссоциированными ионами угольной кислоты (т.е. бикарбонатом и ионы водорода ). активный центр большинства угольных ангидраз содержит ион цинка. Поэтому они классифицируются как металлоферменты. Фермент поддерживает кислотно-щелочной баланс и помогает транспортировать углекислый газ.
Карбоангидраза помогает поддерживать кислотно-щелочной гомеостаз, регулировать pH и баланс жидкости. В зависимости от расположения роль фермента меняется незначительно. Например, карбоангидраза производит кислоту в слизистой оболочке желудка. В почках контроль ионов бикарбоната влияет на содержание воды в клетке. Контроль ионов бикарбоната также влияет на содержание воды в глазах. Ингибиторы карбоангидразы используются для лечения глаукомы, чрезмерного скопления воды в глазах. Блокирование этого фермента смещает баланс жидкости в глазах пациента, чтобы уменьшить скопление жидкости, тем самым снимая давление.
Эффект Бора - это способ описания сродства гемоглобина к связыванию кислорода. Эффект Бора был описан Кристианом Бором в 1904 году и относится к сдвигу кривой диссоциации кислорода, вызванному изменением концентрации диоксида углерода или изменением pH. По сути, увеличение углекислого газа приводит к снижению pH крови, что снижает связывание кислорода с гемоглобином. Обратное верно, когда уменьшение концентрации углекислого газа повышает pH крови, что увеличивает скорость связывания кислорода с гемоглобином. Связать эффект Бора с карбоангидразой просто: карбоангидраза ускоряет реакцию углекислого газа, вступающего в реакцию с водой, с образованием протонов водорода и ионов бикарбоната.
Для описания равновесия в реакции карбоангидразы используется принцип Ле Шателье. Ткани более кислые, чем легкие, потому что углекислый газ вырабатывается клеточным дыханием и вступает в реакцию с водой в тканях с образованием протонов водорода. Поскольку концентрация углекислого газа выше, равновесие смещается вправо, в сторону бикарбоната. Противоположное явление наблюдается в легких, где выделяется диоксид углерода, поэтому его концентрация ниже, поэтому равновесие смещается влево в сторону диоксида углерода, чтобы попытаться повысить его концентрацию.
 Это изображение показывает циклический механизм карбоангидразы.
Это изображение показывает циклический механизм карбоангидразы. Фермент известен как вещество, которое действует в живых организмах как катализатор, который помогает ускорить химические реакции. Карбоангидраза - один из важных ферментов, который содержится в эритроцитах, слизистой оболочке желудка, клетках поджелудочной железы и даже почечных канальцах. Это очень старый фермент, который был открыт в 1932 году и разделен на три основных класса. Первый класс - это альфа-карбоангидраза, которая встречается у млекопитающих, второй класс - это бета-карбоангидраза, которая содержится в бактериях и растениях, и, наконец, третий класс - это гамма-карбоангидраза, которая содержится в метаногеновых бактериях горячих источников. Все три класса карбоангидразы имеют один и тот же активный центр с металлическим центром Zn, однако структурно они не похожи друг на друга. Основная роль карбоангидразы у людей - катализировать превращение диоксида углерода в угольную кислоту и обратно. Однако он также может помочь с переносом CO 2 в крови, что, в свою очередь, способствует дыханию. Он может даже участвовать в образовании соляной кислоты в желудке. Следовательно, роль карбоангидразы зависит от того, где она находится в организме.
Реакция, которая показывает катализирование карбоангидразы в наших тканях: CO 2 + H 2O 



Реакция, катализируемая карбоангидразой:
 CO 2 + H 2O
CO 2 + H 2OУгольная кислота имеет pK a около 6,36 (точное значение зависит от среды), поэтому при pH 7 протонируется небольшой процент бикарбоната.
Карбоангидраза - один из самых быстрых ферментов, и его скорость обычно ограничена скоростью диффузии его субстратов. Типичные каталитические скорости различных форм этого фермента находятся в диапазоне от 10 и 10 реакций в секунду.
Некаталитическая обратная реакция является относительно медленной (кинетика в 15-секундном диапазоне). Вот почему газированный напиток не дегазируется мгновенно при открытии контейнера, однако он быстро дегазируется. во рту при контакте с карбоангидразой, содержащейся в слюне.
Ангидраза определяется как фермент, который катализирует удаление молекулы воды из соединения, и поэтому именно эта «обратная» реакция дала карбоангидразу свое название, потому что она удаляет молекулу воды из угольной кислоты. кислота.
В легких карбоангидраза превращает бикарбонат в двуокись углерода, пригодную для выдоха.
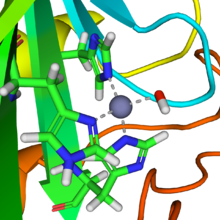 Изображение активного центра карбоангидразы II человека крупным планом, демонстрирующее три остатка гистидина и группу гидроксида, координирующую (пунктирные линии) ион цинка в центре. Из PDB : 1CA2 .
Изображение активного центра карбоангидразы II человека крупным планом, демонстрирующее три остатка гистидина и группу гидроксида, координирующую (пунктирные линии) ион цинка в центре. Из PDB : 1CA2 .A цинк простетическая группа в ферменте координирована в трех положениях гистидином боковыми цепями. Четвертую координационную позицию занимает вода. Четвертый гистидин близок к водному лиганду, облегчая образование центра Zn-OH, который связывает CO 2 с образованием бикарбоната цинка. Конструкция является примером общего кислотно-основного катализа (см. Статью «Кислотный катализ »). Активный центр также имеет карман, подходящий для углекислого газа, приближая его к гидроксидной группе.
 Ленточная диаграмма человеческой карбоангидразы II. Активный центр ион цинка виден в центре. Из PDB : 1CA2 .
Ленточная диаграмма человеческой карбоангидразы II. Активный центр ион цинка виден в центре. Из PDB : 1CA2 .Карбоангидраза была первоначально обнаружена в красных кровяных тельцах коров.
Распознаются по крайней мере пять различных семейств CA: α, β, γ, δ и ζ. Эти семейства не имеют значительного сходства аминокислотной последовательности и в большинстве случаев считаются примером конвергентной эволюции. Α-КА обнаружены у человека.
Позвоночные, водоросли и некоторые бактерии имеют это семейство CAs.
CA-ферменты, обнаруженные у млекопитающих, разделены на четыре широкие подгруппы, которые, в свою очередь, состоят из нескольких изоформ:
Существуют три дополнительных «акаталитических» изоформы карбоангидразы человека (CA-VIII, CA-X и CA-XI ) (CA8, CA10, CA11 ), функции которых остаются неясными.
 На этом изображении показаны лиганды и карманный тип углекислого ангидразы.
На этом изображении показаны лиганды и карманный тип углекислого ангидразы. | Изоформа | Ген | Молекулярная масса | Местоположение (клетка) | Местоположение (ткань) | Специфическое активность ферментов человека. (кроме CA XV мыши) (s) | Чувствительность к сульфонамидам. (ацетазоламид в этой таблице) K I (нМ) |
|---|---|---|---|---|---|---|
| CA-I | CA1 | 29 кДа | цитозоль | эритроцит и желудочно-кишечный тракт | 2,0 × 10 | 250 |
| CA-II | CA2 | 29 кДа | цитозоль | почти повсеместно | 1,4 × 10 | 12 |
| CA-III | CA3 | 29 кДа | цитозоль | 8% растворимого белка в типе I мышца | 1,3 × 10 | 240000 |
| CA-IV | CA4 | 35 кДа | внеклеточная GPI -связанная | желудочно-кишечный тракт, почка, эндотелий | 1,1 × 10 | 74 |
| CA-VA | CA5A | 34,7 кДа (прогнозируемый) | митохондрии | печень | 2,9 × 10 | 63 |
| CA-VB | CA5B | 36,4 кДа (предсказано) | митохондрии | широко распространенный | 9,5 × 10 | 54 |
| CA-VI | CA6 | 39–42 кДа | секреторная | слюна и молоко | 3,4 × 10 | 11 |
| CA-VII | CA7 | 29 кДа | цитозоль | широко распространенный | 9,5 × 10 | 2,5 |
| CA-IX | CA9 | 54,58 кДа | клеточная мембрана -ассоциированная | нормальная ЖКТ, несколько видов рака | 1,1 × 10 | 16 |
| CA-XII | CA12 | 44 кДа | внеклеточно расположенный активный центр | почка, некоторые раковые образования | 4,2 × 10 | 5,7 |
| CA-XIII | CA13 | 29 кДа | цитозоль | широко распространенный | 1,5 × 10 | 16 |
| CA- XIV | CA14 | 54 кДа | внеклеточно расположенный активный центр | почка, сердце, скелетная мышца, мозг | 3,1 × 10 | 41 |
| CA15 | 34–36 кДа | внеклеточный GPI -связанный | почка, не экспрессируется в тканях человека | 4,7 × 10 | 72 |
Большинство прокариотических и растительных хлоропластов Центры сертификации относятся к семейству бета-версий. Были идентифицированы два шаблона подписи для этого семейства:
Гамма-класс CA происходят от метаногенов, метан-продуцирующих бактерий, которые растут в горячих источниках.
Дельта-класс CA описан в диатомовых водорослях. Однако различие этого класса CA недавно стало предметом сомнений.
Дзета-класс СА встречается исключительно у бактерий у нескольких хемолитотрофов и морских цианобактерий, которые содержат cso- карбоксисомы. Недавний трехмерный анализ показывает, что ζ-CA имеет некоторое структурное сходство с β-CA, особенно рядом с участком иона металла. Таким образом, две формы могут быть отдаленно родственными, даже если лежащая в основе аминокислотная последовательность с тех пор значительно разошлась.
Семейство CA CA было недавно обнаружено у организмов рода Plasmodium. Раньше считалось, что это группа ферментов, принадлежащих к альфа-семейству КА, однако было продемонстрировано, что η-КА обладают уникальными особенностями, такими как их структура координации ионов металлов.
Класс iota - это самый последний описанный класс центров сертификации. Он был обнаружен у морской диатомеи Thalassiosira pseudonana и широко распространен среди морского фитопланктона. В диатомовых водорослях ι-CA важен для механизмов концентрирования CO 2 и - в отличие от других классов CA - он может использовать марганец вместо цинка в качестве кофактора металла. Гомологи ι-CA были также подтверждены у грамотрицательных бактерий, которые могут присутствовать в виде гомодимера белка.
В природе встречается несколько форм карбоангидразы. В наиболее изученной форме альфа-карбоангидразы, присутствующей у животных, ион цинка координирован кольцами имидазола из 3 остатков гистидина, His94, His96 и His119.
Основная функция фермента у животных - взаимное преобразование углекислого газа и бикарбоната для поддержания кислотно-щелочного баланса в крови и других тканях и помощи в транспортировке углекислого газа из тканей.
У млекопитающих существует не менее 14 различных изоформ. Растения содержат другую форму, называемую β-карбоангидраза, которая с эволюционной точки зрения является отдельным ферментом, но участвует в той же реакции, а также использует ион цинка в своем активном центре. У растений карбоангидраза помогает повысить концентрацию CO 2 в хлоропласте, чтобы увеличить скорость карбоксилирования фермента RuBisCO. Это реакция, которая объединяет CO 2 в органический углерод сахара во время фотосинтеза и может использовать только форму углерода CO 2, не угольная кислота или бикарбонат.
Морские диатомовые водоросли, как было обнаружено, экспрессируют новую форму ζ карбоангидразы. Т. weissflogii, вид фитопланктона, распространенный во многих морских экосистемах, содержит карбоангидразу с ионом кадмия вместо цинка. Раньше считалось, что кадмий - токсичный металл, не имеющий никакой биологической функции. Однако этот вид фитопланктона, похоже, адаптировался к низким уровням цинка в океане за счет использования кадмия, когда цинка недостаточно. Хотя концентрация кадмия в морской воде также невелика (около 1x10 моляр ), возможность использования любого металла дает экологическое преимущество в зависимости от того, какой из них более доступен в данный момент. Таким образом, этот тип карбоангидразы является камбиалистическим, что означает, что он может заменять металл в своем активном центре на другие металлы (а именно, цинк и кадмий).
Механизм образования карбоангидраза кадмия (CDCA) по существу такая же, как и у других углекислых ангидраз, в превращении диоксида углерода и воды в бикарбонат и протон. Кроме того, как и другие угольные ангидразы, CDCA заставляет реакцию идти почти так же быстро, как скорость диффузии ее субстратов, и ее можно ингибировать сульфонамидными и производными сульфамата.
В отличие от большинства других угольных ангидраз, ион металла активного центра не связывается тремя остатками гистидина и ионом гидроксида. Вместо этого он связан двумя остатками цистеина, одним остатком гистидина и ионом гидроксида, что характерно для β-CA. Поскольку кадмий является мягкой кислотой, он будет более прочно связываться лигандами с мягким основанием. Атомы серы на остатках цистеина являются мягкими основаниями, таким образом связывая кадмий более прочно, чем азот на остатках гистидина. CDCA также имеет трехмерную складчатую структуру, которая не похожа на любую другую карбоангидразу, а ее аминокислотная последовательность не похожа на другие карбоангидразы. Это мономер с тремя доменами, каждый из которых идентичен по аминокислотной последовательности и каждый содержит активный центр с ионом металла.
Еще одно ключевое различие между CDCA и другими угольно-ангидразами заключается в что CDCA имеет механизм замены своего иона кадмия на ион цинка в случае, если цинк становится более доступным для фитопланктона, чем кадмий. Активный сайт CDCA по существу «закрыт» цепочкой из девяти аминокислот с остатками глицина в положениях 1 и 9. Обычно этот порт остается закрытым, и ион кадмия улавливается. внутри. Однако из-за гибкости и положения остатков глицина этот вентиль можно открыть для удаления иона кадмия. Затем на его место можно поместить ион цинка, и ворота за ним закроются. Как пограничная кислота, цинк не будет связываться с цистеиновыми лигандами так прочно, как кадмий, но фермент все равно будет активен и достаточно эффективен. Металл в активном центре может переключаться между цинком и кадмием в зависимости от того, какой из них более распространен в данный момент. Именно способность CDCA утилизировать кадмий или цинк, вероятно, дает T. weissflogii преимущество в выживании.
Кадмий по-прежнему считается смертельным для фитопланктона в больших количествах. Исследования показали, что T. weissflogii проявляет первоначальную токсическую реакцию на кадмий при воздействии на него. Токсичность металла снижается за счет транскрипции и трансляции фитохелатина, который представляет собой белки, которые могут связывать и транспортировать кадмий. После связывания фитохелатином кадмий больше не токсичен и может безопасно транспортироваться к ферменту CDCA. Также было показано, что поглощение кадмия через фитохелатин приводит к значительному увеличению экспрессии CDCA.
Другой фитопланктон из других источников воды был протестирован на присутствие CDCA. Было обнаружено, что многие из них содержат белки, гомологичные CDCA, обнаруженным у T. weissflogii. Сюда входят виды из Грейт-Бей, Нью-Джерси, а также из Тихого океана вблизи экватора. У всех протестированных видов CDCA-подобные белки показали высокий уровень экспрессии даже при высоких концентрациях цинка и в отсутствие кадмия. Сходство между этими белками и CDCA, экспрессируемыми T. weissflogii, варьировалось, но они всегда были похожи по крайней мере на 67%.
Карбоангидраза в принципе может оказаться релевантной для 229>улавливание углерода. Некоторые углекислые ангидразы могут выдерживать температуры до 107 ° C и экстремальную щелочность (pH>10). Пилотный запуск с более стабильным СА на потоке дымовых газов, который состоял из 12–13% мольного состава CO₂, имел степень улавливания 63,6% за 60-часовой период без заметного влияния на производительность ферментов. CA был помещен в раствор N-метилдиэтаноламина (MDEA), где он служил для увеличения разницы концентраций (движущей силы) CO 2 между дымовым потоком электростанции и жидкой фазой в жидкостно-газовом контакторе..