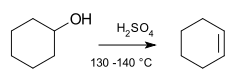
Реакция элиминирования
циклогексанола в
циклогексен с помощью
серной кислоты и нагревание
реакция элиминирования представляет собой тип органической реакции, в которой два заместителя удаляются из молекулы в одно- или двухстадийном механизм. Одностадийный механизм известен как реакция E2, а двухступенчатый механизм известен как реакция E1 . Цифры относятся не к количеству шагов в механизме, а к кинетике реакции: E2 бимолекулярен (второй порядок), а E1 - мономолекулярен (первый порядок). В случаях, когда молекула способна стабилизировать анион, но имеет плохую уходящую группу, существует третий тип реакции, E1CB. Наконец, пиролиз ксантогенатных и ацетатных эфиров протекает по «внутреннему» механизму элиминирования, Eiмеханизму.
Содержание
- 1 Потеря гидрона (H)
- 2 Механизм E2
- 3 Механизм E1
- 4 Конкуренция между механизмами
- 5 Реакции элиминирования, отличные от β-элиминирования
- 6 См. Также
- 7 Ссылки
- 8 Внешние ссылки
Потеря гидрона (H)
In в большинстве реакций органического отщепления по меньшей мере один гидрон (H) теряется с образованием двойной связи: ненасыщенность молекулы увеличивается. Также возможно, что молекула подвергается восстановительному отщеплению, в результате чего валентность атома в молекуле уменьшается на два, хотя это более распространено в неорганической химии. Важным классом реакций элиминирования являются реакции с участием алкилгалогенидов с хорошими уходящими группами, которые реагируют с основанием Льюиса с образованием алкена. Удаление можно рассматривать как обратное реакции присоединения. Когда субстрат асимметричный, региоселективность определяется по правилу Зайцева или посредством исключения Хофмана, если углерод с наиболее замещенным водородом недоступен.
Механизм E2
В 1920-х годах Кристофер Келк Ингольд предложил модель, объясняющую особый тип химической реакции: механизм E2. E2 означает бимолекулярное отщепление. Реакция включает одностадийный механизм, в котором связи углерод-водород и углерод-галоген разрываются с образованием двойной связи (C = C Pi-связь ).
Особенности реакции следующие:
- E2 представляет собой одностадийное отщепление с одним переходным состоянием .
- Обычно оно подвергается первично замещенным алкилгалогенидам, но возможно с некоторые вторичные алкилгалогениды и другие соединения.
- Скорость реакции составляет второй порядок, потому что на нее влияют как алкилгалогенид, так и основание (бимолекулярное).
- Поскольку механизм E2 приводит к образованию пи-связи, две уходящие группы (часто водород и галоген ) должны быть антиперипланарными. Антиперипланарное переходное состояние имеет ступенчатую конформацию с более низкой энергией, чем синперипланарное переходное состояние, которое находится в затменной конформации с более высокой энергией. Механизм реакции, включающий шахматную конформацию, более благоприятен для реакций E2 (в отличие от реакций E1).
- E2 обычно использует сильное основание. Он должен быть достаточно сильным, чтобы удалить слабокислый водород.
- Чтобы создать пи-связь, гибридизация атомов углерода должна быть понижена с sp до sp.
- Связь CH ослабляется на этапе определения скорости, и поэтому наблюдается первичный изотопный эффект дейтерия, намного превышающий 1 (обычно 2-6).
- E2 конкурирует с механизмом реакции SN2, если основание также может действовать как нуклеофил (верно для многих распространенных оснований).

Примером реакции этого типа на схеме 1 является реакция изобутилбромид с этоксидом калия в этаноле. Продуктами реакции являются изобутен, этанол и бромид калия..
Механизм E1
E1 представляет собой модель, объясняющую конкретный тип реакции химического элиминирования. E1 означает мономолекулярное отщепление и имеет следующие характеристики.
- Это двухэтапный процесс отщепления: ионизация и депротонирование.
- Ионизация : связь углерод-галоген разрывается с образованием промежуточного соединения карбокатион.
- депротонирование карбокатиона.
- E1 обычно происходит с третичным алкилгалогениды, но возможно с некоторыми вторичными алкилгалогенидами.
- На скорость реакции влияет только концентрация алкилгалогенида, поскольку образование карбокатиона является самой медленной стадией, известной как этап определения скорости. Следовательно, применяется кинетика первого порядка (мономолекулярная).
- Реакция обычно протекает при полном отсутствии основания или в присутствии только слабого основания (кислотные условия и высокая температура).
- Реакции E1 конкурируют с реакциями SN1, потому что они имеют общий карбокатионный промежуточный продукт.
- Вторичный изотопный эффект дейтерия немного больше 1 (обычно 1–1,5).
- Нет антиперипланарных требований. Примером является пиролиз определенного сульфонатного эфира ментола :

- . Только продукт реакции A является результатом антиперипланарного элиминирования. Присутствие продукта B является признаком того, что имеет место механизм E1.
- Он сопровождается реакциями карбокатионной перегруппировки

Примером на схеме 2 является реакция трет-бутилбромида с этилат калия в этаноле.
Удаление E1 происходит с высокозамещенными алкилгалогенидами по двум основным причинам.
- Сильнозамещенные алкилгалогениды являются объемными, что ограничивает возможности для одностадийного механизма E2; следовательно, предпочтение отдается двухстадийному механизму E1.
- Сильнозамещенные карбокатионы более стабильны, чем метильные или первично замещенные катионы. Такая стабильность дает время для того, чтобы сработал двухступенчатый механизм E1.
- Если пути S N 1 и E1 конкурируют, путь E1 может быть улучшен за счет увеличения тепла.
Особенности:
- Возможна перегруппировка
- Независимо от концентрации и основности основания
Конкуренция между механизмами
На скорость реакции влияет реактивность предпочтение отдается галогенам, иодиду и бромиду. Фторид не является хорошей уходящей группой, поэтому отщепление с фтором в качестве уходящей группы происходит медленнее, чем с другими галогенами. Существует определенный уровень конкуренции между реакцией элиминирования и нуклеофильным замещением. Точнее, есть соревнования между E2 и SN2, а также между E1 и SN1. Обычно преобладает замена, а выбывание происходит только при определенных обстоятельствах. Как правило, устранение предпочтительнее замещения, когда
- стерическое препятствие вокруг α-углерода увеличивается.
- используется более сильное основание.
- температура увеличивается (увеличение энтропия )
- основание представляет собой слабый нуклеофил. Основания со стерической массой (например, в трет-бутоксид калия ) часто являются плохими нуклеофилами.
В одном исследовании кинетический изотопный эффект (KIE) был определен для газофазной реакции нескольких алкилгалогенидов с ионом хлорат. В соответствии с элиминированием E2 реакция с трет-бутилхлоридом приводит к KIE 2,3. Реакция хлористого метила (возможен только S N 2), с другой стороны, имеет KIE 0,85, что соответствует S N <6.>2, потому что в этом типе реакции связи CH затягиваются в переходном состоянии. KIE для этил (0,99) и изопропил (1,72) аналогов предполагают конкуренцию между двумя режимами реакции.
Реакции элиминирования, отличные от β -элиминация
β-Элиминация с потерей электрофуги и нуклеофуги на вицинальных атомах углерода, безусловно, является наиболее распространенным типом устранения. Способность образовывать стабильный продукт, содержащий связь C = C или C = X, а также соображения орбитального выравнивания сильно отдают предпочтение β-элиминированию по сравнению с другими процессами удаления. Однако известны другие типы, как правило, для систем, в которых не может происходить β-элиминирование.

Следующим наиболее распространенным типом реакции элиминирования является α-элиминирование. Для углеродного центра результатом α-отщепления является образование карбена, который включает «стабильные карбены», такие как монооксид углерода или изоцианиды. Например, альфа-отщепление элементов HCl из хлороформа (CHCl 3) в присутствии сильного основания является классическим подходом для получения дихлоркарбена,: CCl 2, как реактивный промежуточный продукт. С другой стороны, муравьиная кислота подвергается α-элиминированию, давая стабильные продукты - воду и монооксид углерода в кислых условиях. α-Элиминирование также может происходить на металлическом центре, одним из наиболее частых результатов которого является снижение как степени окисления металла, так и координационного числа на 2 единицы в процессе, известном как восстановительное удаление. (Неудивительно, что в металлоорганической терминологии термины α-отщепление и α-отщепление относятся к процессам, которые приводят к образованию комплекса металл-карбен. В этих реакциях именно углерод, соседний с металлом, подвергается α-отщеплению.)
В некоторых особых случаях отщепление γ- и выше с образованием трехчленных или более крупных колец также возможно как в органических, так и в металлоорганических процессах. Например, некоторые комплексы Pt (II) подвергаются γ- и δ-элиминированию с образованием металлоциклов. Совсем недавно для получения напряженных бициклических систем использовали γ-силильное отщепление силилциклобутилтозилата.
См. Также
Ссылки
- ^Coleman, G.H.; Джонстон, Х. Ф. (1925). «Циклогексен». Organic Syntheses. 5: 33. doi : 10.15227 / orgsyn.005.0033.
- ^March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^Нэш, JJ; Leininger, M. A.; Киз, К. (апрель 2008 г.). «Пиролиз эфиров арилсульфоната в отсутствие растворителя: E1 или E2? Загадка для органической лаборатории». Журнал химического образования. 85(4): 552. Bibcode : 2008JChEd..85..552N. doi : 10.1021 / ed085p552.
- ^Стефани М. Виллано; Сюдзи Като; Вероника М. Бирбаум (2006). «Кинетические изотопные эффекты дейтерия в газофазных реакциях SN2 и E2: сравнение эксперимента и теории». Дж. Am. Chem. Soc. 128 (3): 736–737. doi : 10.1021 / ja057491d. PMID 16417360.
- ^1960-, Анслин, Эрик В. (2006). Современная физическая органическая химия. Догерти, Деннис А., 1952-. Саусалито, Калифорния: Университетская наука. ISBN 1891389319. OCLC 55600610. CS1 maint: числовые имена: список авторов (ссылка )
- ^1948-, Crabtree, Robert H. (2009). Металлоорганическая химия переходные металлы (5-е изд.). Hoboken, NJ: Wiley. ISBN 9780470257623. OCLC 268790870. CS1 maint : числовые имена: список авторов (ссылка )
- ^Мур, Стивен С.; ДиКозимо, Роберт; Совински, Аллан Ф.; Уайтсайдс, Джордж М. (1981-02-01). «Кольцевой штамм бис (триэтилфосфина)) -3,3-диметилплатинациклобутан мал ». Журнал Американского химического общества. 103 (4): 948–949. doi : 10.1021 / ja00394a043. ISSN 0002-7863.
- ^Kelly, Christopher B.; Colthart, Allison M.; Constant, Brad D.; Corning, Sean R.; Dubois, Lily NE; Genovese, Jacqueline T..; Radziewicz, Julie L.; Sletten, Ellen M.; Whitaker, Katherine R. (2011-04-01). «Обеспечение возможности синтеза перфторалкилбициклобутанов посредством отщепления 1,3 γ-силила». Organic Letters. 13 (7): 1646–1649. doi : 10.1021 / ol200121f. ISSN 1523-7060. PMID 21366262.
Внешние ссылки
 СМИ, относящиеся к реакциям элиминирования на Wikimedia Commons
СМИ, относящиеся к реакциям элиминирования на Wikimedia Commons Цитаты, относящиеся к реакции элиминирования на Wikiquote
Цитаты, относящиеся к реакции элиминирования на Wikiquote
 Реакция элиминирования циклогексанола в циклогексен с помощью серной кислоты и нагревание
Реакция элиминирования циклогексанола в циклогексен с помощью серной кислоты и нагревание 


