![{\displaystyle {\begin{matrix}\\{\ce {{CN^{-}}+{^{12}CH3-Br}->[k_ {12}] {^ {12} CH3-CN} + Br ^ {-}}} \\ {\ ce {{CN ^ {-}} + {^ {13} CH3-Br} ->[k_ {13}] {^ {13} CH3-CN} + Br ^ {-}}} \\ {} \ end {matrix}} \ qquad {\ text {KIE}} = {\ frac {k_ {12}} {k_ {13}}} = 1.082 \ pm 0.008}]( https://wikimedia.org/api/rest_v1/media/math/render/svg/438109ea220fd190ccc57f3e2c3726c47c24aae0 ) Пример кинетического изотопного эффекта. . В реакции метилбромид с цианидом,. кинетический изотопный эффект углерода в метильной группе оказался равным 1,082 ± 0,008.
Пример кинетического изотопного эффекта. . В реакции метилбромид с цианидом,. кинетический изотопный эффект углерода в метильной группе оказался равным 1,082 ± 0,008. In физическая органическая химия, кинетический изотопный эффект (KIE ) - это изменение скорости реакции химической реакции когда один из атомов в реагентах заменяется одним из его изотопов. Формально это соотношение констант скорости для реакций с участием легких (k L) и тяжелых (k H) изотопно замещенных реагентов (изотопологов). :

Это изменение скорости реакции является квантово-механическим эффект, который в первую очередь является результатом того, что более тяжелые изотопологи имеют более низкие колебательные частоты по сравнению с их более легкими аналогами. В большинстве случаев это означает, что более тяжелые изотопологи потребуют большей энергии для достижения переходного состояния (или, в редких случаях, предела диссоциации ), и, следовательно, более медленную скорость реакции.. Изучение кинетических изотопных эффектов может помочь в выяснении механизма реакции определенных химических реакций и иногда используется при разработке лекарств для улучшения неблагоприятной фармакокинетики путем защиты метаболически уязвимых связей C-H.
Кинетический изотопный эффект считается одним из наиболее важных и чувствительных инструментов для изучения механизмов реакции, знание которого позволяет улучшить желаемые качества соответствующих реакций.. Например, кинетические изотопные эффекты могут быть использованы для определения того, следует ли реакция нуклеофильного замещения по мономолекулярному (SN1) или бимолекулярному (SN2) пути.
В реакции бромистого метила и цианида (показано во введении) наблюдаемый кинетический изотопный эффект метила углерода указывает на S N 2 механизм. В зависимости от пути могут использоваться разные стратегии для стабилизации переходного состояния на определяющей скорость стадии реакции и повышения скорости реакции и селективности, которые важны для промышленного применения.

Изотопные изменения скорости наиболее выражены, когда относительное изменение массы наибольшее, поскольку эффект связан с частотами колебаний затронутых связей. Например, замена атома водорода (H) на его изотоп дейтерий (D) представляет собой увеличение массы на 100%, тогда как замена углерода -12 на углерода-13 масса увеличивается всего на 8 процентов. Скорость реакции с участием связи C – H обычно в 6–10 раз выше, чем скорость соответствующей связи C – D, тогда как реакция C всего на 4 процента быстрее, чем соответствующая реакция C (хотя в обоих случаях изотопная на одну атомную единицу массы тяжелее).
Изотопное замещение может изменять скорость реакции множеством способов. Во многих случаях разницу в скоростях можно объяснить, отметив, что масса атома влияет на частоту колебаний химической связи, которую он образует, даже если потенциальная энергия Поверхность для реакции практически идентична. Более тяжелые изотопы (классически ) приведут к более низким частотам вибрации или, с точки зрения квантовой механики, будут иметь более низкую энергию нулевой точки. При более низкой энергии нулевой точки необходимо подавать больше энергии для разрыва связи, что приводит к более высокой энергии активации для разрыва связи, что, в свою очередь, снижает измеренную скорость (см., Например, Уравнение Аррениуса ).
A первичный кинетический изотопный эффект могут быть обнаружены при образовании или разрыве связи с изотопно-меченым атомом. В зависимости от способа кинетический изотопный эффект исследуется (параллельное измерение скоростей против межмолекулярной конкуренции против внутримолекулярной конкуренции), наблюдение первичного кинетического изотопного эффекта указывает на разрыв / образование связи с изотопом на стадии ограничения скорости или последующий продукт- (Ошибочное представление о том, что первичный кинетический изотопный эффект должен отражать разрыв / образование связи с изотопом на этапе ограничения скорости, часто повторяется в учебниках и основной литературе: см. раздел эксперименты ниже.)
Для ранее упомянутых реакций нуклеофильного замещения были исследованы эффекты первичных кинетических изотопов как для уходящих групп, так и для нуклеофилов, и для α-углерода, на котором происходит замещение. Интерпретация кинетических изотопных эффектов уходящей группы поначалу была затруднена из-за значительного вклада температурно-независимых факторов. Кинетические изотопные эффекты на α-углероде могут быть использованы для развития некоторого понимания симметрии переходного состояния в реакциях S N 2, хотя этот кинетический изотопный эффект менее чувствителен, чем то, что было бы идеальным, также из-за влияние не колебательных факторов.
A вторичный кинетический изотопный эффект наблюдается, когда связь с изотопно-меченным атомом в реагенте не разрывается или не образуется. Вторичные кинетические изотопные эффекты обычно намного меньше, чем первичные кинетические изотопные эффекты; однако эффекты вторичных изотопов дейтерия могут достигать 1,4 на атом дейтерия, и были разработаны методы для измерения изотопных эффектов тяжелых элементов с очень высокой точностью, поэтому вторичные кинетические изотопные эффекты по-прежнему очень полезны для выяснения механизмов реакции.
Для вышеупомянутых реакций нуклеофильного замещения эффекты вторичных кинетических изотопов водорода у α-углерода обеспечивают прямое средство различения реакций S N 1 и S N 2.. Было обнаружено, что реакции S N 1 обычно приводят к большим вторичным кинетическим изотопным эффектам, приближающимся к их теоретическому максимуму примерно при 1,22, в то время как реакции S N 2 обычно приводят к первичным кинетическим изотопным эффектам. которые очень близки к единице или меньше нее. Кинетические изотопные эффекты, превышающие 1, называются нормальными кинетическими изотопными эффектами, тогда как кинетические изотопные эффекты, которые меньше единицы, называются обратными кинетическими изотопными эффектами . В общем, ожидается, что меньшие силовые постоянные в переходном состоянии вызовут нормальный кинетический изотопный эффект, а более высокие силовые постоянные в переходном состоянии, как ожидается, приведут к обратному кинетическому изотопическому эффекту, когда вклады валентных колебаний доминируют над кинетическим изотопическим эффектом.

Величины таких вторичных изотопных эффектов у -углерода в значительной степени определяются колебаниями C α -H (D). Для реакции S N 1, поскольку углерод превращается в sp-гибридизированный ион карбения во время переходного состояния для стадии, определяющей скорость, с увеличением C α -H (D) порядка связи, обратный кинетический изотопический эффект можно было бы ожидать, если бы были важны только валентные колебания. Обнаружено, что наблюдаемые большие нормальные кинетические изотопные эффекты вызываются значительными внеплоскостными изгибными колебательными колебаниями при переходе от реагентов к переходному состоянию образования карбения. Для реакций S N 2 изгибные колебания по-прежнему играют важную роль для кинетического изотопного эффекта, но валентные колебательные вклады более сопоставимы по величине, и результирующий кинетический изотопный эффект может быть нормальным или обратным в зависимости от конкретного вклад соответствующих колебаний.
Теоретическая трактовка изотопных эффектов в значительной степени опирается на теорию переходных состояний, которая предполагает наличие единственной поверхности потенциальной энергии для реакции, и барьер между реагентами и продуктами на этой поверхности, поверх которой находится переходное состояние. Кинетический изотопный эффект возникает в основном из-за изменений основных колебательных состояний, вызванных изотопическим возмущением вдоль пути минимальной энергии поверхности потенциальной энергии, что может быть объяснено только с помощью квантово-механических обработок системы. В зависимости от массы атома, который движется вдоль координаты реакции, и характера (ширины и высоты) энергетического барьера, квантово-механическое туннелирование также может вносить большой вклад в наблюдаемый кинетический изотопный эффект и может потребоваться следует рассматривать отдельно, в дополнение к "полуклассической" модели теории переходного состояния.
Кинетический изотопный эффект дейтерия (H KIE), безусловно, является наиболее распространенным, полезным и хорошо изученным типом кинетического изотопа. эффект. Точное предсказание численного значения кинетического изотопного эффекта дейтерия с использованием расчетов по теории функционала плотности в настоящее время является относительно обычным делом. Более того, несколько качественных и полуколичественных моделей позволяют сделать грубые оценки изотопных эффектов дейтерия без расчетов, часто предоставляя достаточно информации для рационализации экспериментальных данных или даже для подтверждения или опровержения различных механистических возможностей. Исходные материалы, содержащие дейтерий, часто имеются в продаже, что делает синтез исходных материалов, обогащенных изотопами, относительно простым. Кроме того, из-за большой относительной разницы в массе дейтерия и протия и сопутствующих различий в частотах колебаний, величина изотопного эффекта больше, чем у любой другой пары изотопов, кроме протия и трития, что позволяет проявлять как первичный, так и вторичный изотопные эффекты. легко измерить и интерпретировать. Напротив, вторичные эффекты обычно очень малы для более тяжелых элементов и близки по величине к экспериментальной неопределенности, что усложняет их интерпретацию и ограничивает их полезность. В контексте изотопных эффектов водород часто используется для обозначения легкого изотопа, в частности протия (H). В остальной части этой статьи ссылки на водород и дейтерий в параллельных грамматических конструкциях или прямые сравнения между ними следует интерпретировать как относящиеся к протию и дейтерию.
Теория кинетических изотопных эффектов была впервые сформулирована Якоб Бигелейзен в 1949 году. Общая формула Бигелейзена для кинетических изотопных эффектов дейтерия (которая также применима к более тяжелым элементам) приводится ниже. Он использует теорию переходного состояния и статистическую механическую обработку поступательных, вращательных и колебательных уровней для вычисления констант скорости k H и k D. Однако эта формула является «полуклассической» в том смысле, что в ней не учитывается вклад квантового туннелирования, который часто вводится как отдельный поправочный коэффициент. Формула Бигелейзена также не рассматривает различия в несвязанных отталкивающих взаимодействиях, вызванных немного более короткой связью C – D по сравнению со связью C – H. В уравнении величины с нижними индексами H или D относятся к замещенным водородом или дейтерием частицам соответственно, тогда как величины с или без двойного крестика ‡ относятся к переходному состоянию или основному состоянию реагента соответственно. (Строго говоря, термин 
![{\ displaystyle {\ frac {k _ {{\ ce {H}}}} {k _ {{\ ce {D}}}}} = \ left ({\ frac {\ sigma _ {{\ ce {H}}} \ sigma _ {{\ ce {D}}} ^ {\ ddagger}} {\ sigma _ {{\ ce {D}}} \ sigma _ {{\ ce {H}}} ^ {\ ddagger}}} \ right) \ left ({\ frac {M _ {{\ ce {H}}} ^ {\ ddagger} M _ {{\ ce {D}}}} { M _ {{\ ce {D}}} ^ {\ ddagger} M _ {\ ce {H}}}}} \ right) ^ {\ frac {3} {2}} \ left ({\ frac {I_ { х {\ се {H}}} ^ {\ ddagger} I_ {y {\ ce {H}}} ^ {\ ddagger} I_ {z {\ ce {H}}} ^ {\ ddagger}} {I_ {x {\ ce {D}}} ^ {\ ddagger} I_ {y {\ ce {D}}} ^ {\ ddagger} I_ {z {\ ce {D}}} ^ {\ ddagger}}} {\ frac {I_ { x {\ ce {D}}} I_ {y {\ ce {D}}} I_ {z {\ ce {D}}}} {I_ {x {\ ce {H}}} I_ {y {\ ce {H}}} I_ {z {\ ce {H}}}} \ right) ^ {\ frac {1} {2}} \ left ({\ frac {\ prod \ limits _ {i = 1} ^ {3N ^ {\ ddagger} -7} {\ frac {1-e ^ {- u_ {i {\ ce {D}}} ^ {\ ddagger}}} {1-e ^ {- u_ {i {\ ce {H}}} ^ {\ ddagger}}}}} {\ prod \ limits _ {i = 1} ^ {3N-6} {\ frac {1-e ^ {- u_ {i {\ ce {D) }}}}} {1-e ^ {- u_ {i {\ ce {H}}}}}}} \ right) e ^ {- {\ frac {1} {2}} \ left [\ sum \ limits _ {i = 1} ^ {3N ^ {\ ddagger} -7} (u_ {i {\ ce {H}}} ^ {\ ddagger} -u_ {i {\ ce {D}}} ^ { \ ddagger}) - \ sum \ limits _ {i = 1} ^ {3N-6} (u_ {i {\ ce {H}}} - u_ {i {\ ce {D}}}) \ right]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f26faede9d0fba35d6f675e641c716e7284c0d) ,
,где мы определяем
 и
и  .
.Здесь h - постоянная Планка, k B - постоянная Больцмана, 
 .
.Для особого случая изотопа дейтерия эффектов, мы будем утверждать, что первые три члена можно рассматривать как равные или хорошо приближенные к единице. Первый фактор S (содержащий σ X) - это соотношение чисел симметрии для различных видов. Это будет рациональное число (отношение целых чисел), которое зависит от числа вращений молекул и связей, приводящих к перестановке идентичных атомов или групп в реагентах и переходном состоянии. Для систем с низкой симметрией все σ X (реагент и переходное состояние) будут равны единице; таким образом, S часто можно пренебречь. Фактор MMI (содержащий M X и I qX) относится к отношению молекулярных масс и моментов инерции. Поскольку водород и дейтерий имеют тенденцию быть намного легче по сравнению с большинством реагентов и переходных состояний, существует небольшая разница в молекулярных массах и моментах инерции между молекулами, содержащими H и D, поэтому коэффициент MMI обычно также приближается как единство. Фактор EXC (содержащий произведение колебательных статистической суммы ) корректирует кинетический изотопный эффект, вызванный реакциями колебательно-возбужденных молекул. Доля молекул, обладающих достаточной энергией, чтобы иметь колебания связи A – H / D в возбужденном состоянии, обычно мала для реакций при комнатной температуре или около нее (связи с водородом обычно колеблются на высоте 1000 см или выше, поэтому exp (-u i) = exp (-hν i/kBT) < 0.01 at 298 K, resulting in negligible contributions from the 1–exp(-ui) факторов). Следовательно, для кинетических изотопных эффектов водорода / дейтерия в наблюдаемых значениях обычно преобладает последний фактор, ZPE (экспоненциальная функция разностей колебательных нулевых энергий), состоящий из вкладов нулевой энергии различия для каждой из форм колебаний реагентов и переходного состояния, которые можно представить следующим образом:
![{\ displaystyle {\ begin {align} {\ frac {k _ {{\ ce {H}}}} {k _ {{\ ce { D}}}}} \ cong \ exp \ left \ {- {\ frac {1} {2}} \ left [\ sum \ limits _ {i = 1} ^ {3N ^ {\ ddagger} -7} (u_ {i {\ ce {H}}} ^ {\ ddagger} -u_ {i {\ ce {D}}} ^ {\ ddagger}) - \ sum \ limits _ {i = 1} ^ {3N- 6} (u_ {i {\ ce {H}}} - u_ {i {\ ce {D}}}) \ right] \ right \} \\ \ cong \ exp \ left [\ sum _ {i} ^ {\ mathrm {(реагировать.)}} {\ frac {1} {2}} \ Delta u_ {i} - \ sum _ {i} ^ {\ mathrm {(TS)}} {\ frac {1} {2}} \ Delta u_ {i} ^ {\ ddagger} \ right] \ end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20d669d624e10fcb89d116442c5543998ea4fbf8) ,
,где мы определяем
 и
и  .
.Суммы в показателе степени второго выражения можно интерпретировать как бегущие по всем колебательным модам основного состояния реагента и переходного состояния. В качестве альтернативы их можно интерпретировать как переход по тем режимам, уникальным для реагента или переходного состояния, или чьи колебания изменяются при продвижении по координатам реакции. Остальные пары колебательных мод реагента и переходного состояния очень похожи 

Как уже упоминается, особенно для ущерба водород / дейтерий, большинство кинетических изотопных эффектов возникают из-за разницы в энергии нулевой точки (ZPE) между реагентами и переходным состоянием рассматриваемых изотопологов, и это различие можно понять качественно с помощью следующего описания: в пределах Приближение Борна - Оппенгеймера, потенциальной энергии одинакова для обоих изотопов. Однако квантово-механическое рассмотрение представляет собой дискретные колебательные уровни на эту кривую, и самое низкое возможное энергетическое состояние молекулы соответствует самому низкому уровню колебательной энергии, который немного выше по энергии, чем минимум потенциальной энергии. Эта разница, называемая энергией нулевой точки, является проявлением принципа неопределенности Гейзенберга, который требует неопределенности в длине связи C-H или C-D. Уровни энергии ближе к классической потенциальной энергии, и она имеет более низкую нулевую энергию. Разница в нулевой энергии между двумя изотопными частями, по крайней мере, в большинстве случаев, уменьшается в переходном состоянии, поскольку константа силы связи уменьшается во время разрыва связи. Следовательно, более низкая энергия нулевой точки дейтерированных частиц переводится в большую энергию его реакции, как показано на следующем рисунке, что приводит к нормальному кинетическому изотопному эффекту. Этот эффект, в принципе, следует учитывать все колебательные моды 3N - 6 для исходного материала и колебательные моды 3N - 7 в переходном состоянии (одна мода, соответствующая координата реакции, отсутствует в переходном состоянии, поскольку связь разрывается и нет восстановительной силы против движения). Гармонический осциллятор - хорошее приближение для колеблющейся связи, по крайней мере, для низкоэнергетических колебательных состояний. Квантовая механика дает колебательную энергию нулевой точки как 

 ,
,где k f - силовая постоянная. Более того, приведенная масса приблизительно равна массе легкого атома системы, X = H или D. Прим. D приблизительно равно 2m H,
 .
.В случае гомолитической диссоциации связи C - H / D член переходного состояния исчезает, и при пренебрежении другими колебательными модами k H/kD= exp (½Δu i). Таким образом, больший изотопный эффект наблюдается для более жесткой («более сильной») C - H / D. Для большей жесткости используется C - H / D. Для этого необходимо использовать переходное состояние [A ··· H ···], представляющее интерес атома водорода, переносится между двумя атомами. B] и колебательные моды в переходном состоянии. Тем не менее, разрыв с более высокой частотой колебания даст больший изотопный эффект.
 Различия в энергии ZPE и соответствующие энергиях активации для разрыва аналогичных связей C-H и C-D. Обратите внимание, что на этой схематической диаграмме кривые на самом деле представляют (3N-6) - и (3N-7) -мерные гиперповерхности, и колебательная мода, ZPE, которая проиллюстрирована в переходном состоянии, не совпадает с координатой реакции. Координата реакции представляет собой колебание с отрицательной силовой (и воображаемой модели колебаний) для переходного состояния. ZPE, показанный для основного состояния, может относиться к вибрации, координате реакции в случае первичного KIE.
Различия в энергии ZPE и соответствующие энергиях активации для разрыва аналогичных связей C-H и C-D. Обратите внимание, что на этой схематической диаграмме кривые на самом деле представляют (3N-6) - и (3N-7) -мерные гиперповерхности, и колебательная мода, ZPE, которая проиллюстрирована в переходном состоянии, не совпадает с координатой реакции. Координата реакции представляет собой колебание с отрицательной силовой (и воображаемой модели колебаний) для переходного состояния. ZPE, показанный для основного состояния, может относиться к вибрации, координате реакции в случае первичного KIE. Чтобы вычислить максимально возможное значение для KIE, мы рассматриваем случайную, когда ноль -точечная разность энергий между валентными колебаниями типичной связи углерод-водород (3000 см) и углерод-дейтерий (2200 см) в переходном состоянии (разница энергий (1/2) (3000-2200 см) = 400 см, или около 1,15 ккал / моль), без какой-либо компенсации от нулевой разности энергий в переходном состоянии (например, от симметричного участка A ··· H ··· B, являющийся уникальным для переходного состояния). Упрощенная формула, приведенная выше, предсказывает максимум для k H/kDкак 6,9. Если также включить полное исчезновение двух изгибных колебаний, можно прогнозировать значения k H/kDдо 15-20. Однако маловероятно, что частоты изгиба исчезают в переходном состоянии, и есть только несколько случаев, когда значения k H/kDпревышают 7-8 вблизи комнатной температуры. Более того, часто обнаруживается, что туннелирование является основным фактором, когда они превышают такие значения. Значение k H/kD~ 10 считается максимальным для полуклассического первичного кинетического изотопного эффекта (без туннелирования) для факторов, протекающих при температуре около 298 К. (Формула для k H/kDимеет температурную зависимость, поэтому больше изотопные эффекты возможны при более низких температурах). В зависимости от природы переходного состояния переноса водорода (симметричный по сравнению с «ранним» или «поздним» и линейный по сравнению с изогнутым) степень прибли эффекта первичного изотопа дейтерия к максимуму вариируется. Модель, разработанная Вестхаймером, предсказывала, что симметричные (термонейтральные, согласно Постулату Хаммонда ) линейные переходные состояния имеют наибольшие изотопные эффекты, в то время как переходные состояния являются «ранними» или «ранними» (для экзотермических или эндотермических сил соответственно) или нелинейные (например, циклические) проявляют меньшие эффекты. Эти прогнозы с тех пор получили широкую экспериментальную поддержку.
Для вторичных изотопных эффектов дейтерия Стрейтвизер предположил, что ослабление (или усиление, в случае обратного изотопного эффекта) изгибных мод от реагента основное состояние в переходное состояние в степени ответственны за наблюдаемые изотопические эффекты. Эти объясняются изменением стерического окружения, когда углерод, связанный с H / D, подвергается повторной гибридизации от sp к sp или наоборот (эффект вторичного кинетического изотопа α), или ослабление связи из-за гиперконъюгации в случаях, когда карбокатион подвергается действию. генерировал один атом углерода (вторичный кинетический изотопный эффект β). Эти изотопические эффекты имеют теоретический максимум k H/kD= 2 ≈ 1,4. Для вторичного кинетического изотопного эффекта приводит в положение α, регибридизация от sp к sp дает нормальный изотопный эффект, в то время как регибридизация от sp к sp обратному изотопному эффекту с теоретическим эффектом k H/kD= 2 ≈ 0,7. На практике k H/kD~ 1,1-1,2 и k H/kD~ 0,8-0,9 типичны для вторичных кинетических изотопных эффектов α, а k H/kD~ 1,15-1,3 типичны для вторичного кинетического изотопного эффекта β. Для реагентов, вызывающих несколько изотопно-заменяемых результатов, наблюдаемый изотопный эффект является результатом воздействия нескольких H / D в β-положения. В этих случаях эффект каждого изотопно-меченого атома является мультипликативным, и случаи, когда k H/kD>2, не редкость.
Следующие простые выражения, связывающие кинетические изотопные эффекты дейтерия и трития, также известны как уравнение Суэйна (или уравнения Суэйна-Шаада-Стиверс), может быть получено из выражения общего, приведенного, с Использование некоторых упрощений:
 ;
;т.е.
 .
.В d При выводе этих выражений использовалось разумное приближение, согласно приведенным массам равны массам водорода, дейтерия или трития. Кроме того, предполагалось, что колебательное движение действует гармоническим осциллятором, так что 
Для изотопных эффектов с участием элементов, отличных от водорода, многих из этих упрощений недействительны, и величина изотопного эффекта может сильно зависеть от всех игнорируемых факторов. Таким образом, кинетические изотопные эффекты для элементов, отличных от водорода, намного труднее рационализировать или интерпретировать. Во многих случаях, особенно в реакциях переноса водорода, вклад в кинетические изотопные эффекты от туннелирования значительный (см. Ниже).
В некоторых случаях дополнительное повышение скорости для более легкого изотопа, возможно, из-за квантово-механического туннелирования. Обычно это наблюдается только для взаимодействия с атомами водорода. Туннелирование происходит, когда молекула проникает через барьер потенциальной энергии, а не через него. Хотя это и не разрешены законами классической механики, частицы могут проходить через классически запрещенные области в квантовой механике, основанной на дуальности волны-частица.
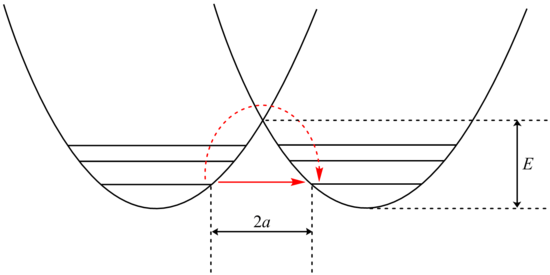 Яма потенциальной энергии туннельной реакции. Красная стрелка показывает классический активированный процесс, а сплошная красная стрелка показывает путь туннелирования.
Яма потенциальной энергии туннельной реакции. Красная стрелка показывает классический активированный процесс, а сплошная красная стрелка показывает путь туннелирования. Анализ туннелирования может быть выполнен с использованием модификации Белла уравнения Аррениуса, которое включает добавление коэффициента туннелирования Q:

где A - параметр Аррениуса, E - высота барьера и

где 
Исследование члена β показывает экспоненциальную зависимость от массы частицы. В результате туннелирование более вероятно для более легкой частицы, такой как водород. Простое удвоение массы туннельного протона путем замены его изотопом дейтерий резко снижает скорость таких реакций. В результате наблюдаются очень большие кинетические изотопные эффекты, которые нельзя объяснить различиями в энергиях нулевой точки.
 Донорно-акцепторная модель переноса протона.
Донорно-акцепторная модель переноса протона. Кроме того, β-член линейно зависит от ширины барьера, 2a. Как и в случае с массой, туннелирование лучше всего при небольшой ширине барьера. Оптимальное туннельное расстояние протонов между донорным и акцепторным атомами составляет 0,4 Å.
Температурная зависимость при туннелированииТуннелирование - это квантово-механический эффект, связанный с законами волновой механики, а не кинетикой. Таким образом, туннелирование становится более важным при низких температурах, когда даже самые маленькие барьеры кинетической энергии не могут быть преодолены, но могут быть преодолены.
Питер С. Зуев и др. сообщенные константы скорости расширения кольца 1-метилциклобутилфторкарбена составляют 4,0 · 10 / с в азоте и 4,0 · 10 / с в аргоне при 8 кельвинах. Они подсчитали, что при температуре 8 кельвинов реакция будет протекать через одно квантовое состояние реагента, так что указанная константа скорости не зависит от температуры, а вклад туннелирования в скорость был на 152 порядка величины больше, чем вклад перехода через переходное состояние. энергетический барьер.
Итак, несмотря на то, что обычные химические реакции имеют тенденцию резко замедляться при понижении температуры, туннельные реакции редко меняются вообще. Частицы, которые проходят сквозь активационный барьер, являются прямым результатом того факта, что волновая функция промежуточных частиц, реагента или продукта не ограничивается энергетической ямой конкретного желоба вдоль энергетической поверхности реакции, но может «просачиваться». в следующий минимум энергии. В свете этого туннелирование не должно зависеть от температуры.
Для отрыва водорода от газообразных н-алканов и циклоалканов атомами водорода в диапазоне температур 363–463 К были охарактеризованы данные кинетического изотопного эффекта H / D. небольшими коэффициентами предэкспоненциального множителя A H/ADв диапазоне от 0,43 до 0,54 и большими различиями в энергии активации от 9,0 до 9,7 кДж / моль. Основываясь на своих аргументах на теории переходных состояний, небольшие отношения A-факторов, связанные с большими различиями в энергии активации (обычно около 4,5 кДж / моль для связей C – H (D)), являются убедительным доказательством туннелирования. Для целей данного обсуждения важно, чтобы коэффициент А для различных парафинов, которые они использовали, был приблизительно постоянным во всем температурном диапазоне.
Наблюдение, что туннелирование не полностью зависит от температуры, можно объяснить тем фактом, что не все молекулы определенного вида занимают свое основное колебательное состояние при различных температурах. Добавление тепловой энергии к потенциальной энергетической яме может привести к заселению более высоких колебательных уровней, отличных от основного состояния. Для обычной кинетической реакции это возбуждение будет иметь лишь небольшое влияние на скорость. Однако для туннельной реакции разница между нулевой энергией и первым уровнем колебательной энергии может быть огромной. Поправочный член Q на туннелирование линейно зависит от ширины барьера, и эта ширина значительно уменьшается по мере увеличения числа колебательных мод на потенциале Морзе. Уменьшение ширины барьера может иметь такое огромное влияние на скорость туннелирования, что даже небольшая совокупность возбужденных колебательных состояний будет доминировать в этом процессе. Критерии туннелирования KIEЧтобы определить, участвует ли туннелирование в KIE При реакции с H или D учитывается несколько критериев:.
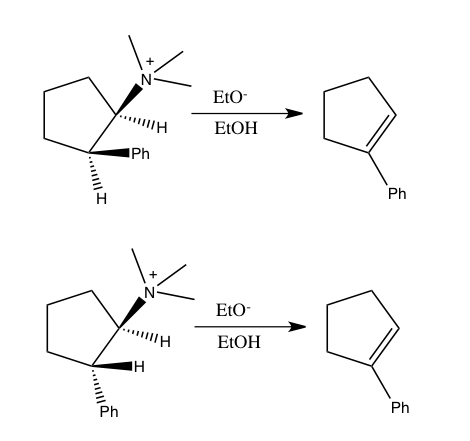
Также для реакций, в которых изотопы включают H, D и T, критерием туннелирования является критерий Свейна-Шаада. rel isotopologues. Примером такого эффекта является рацемизация 9,10-дигидро-4,5-диметилфенантрена. Меньшая амплитуда колебаний для дейтерия по сравнению с водородом в связях C – H (углерод – водород), C – D (углерод – дейтерий) приводит к меньшему ван-дер-ваальсовому радиусу или эффективному размеру в дополнение к разнице в ZPE между два. Когда существует большая эффективная масса молекул, содержащих одну над другой, это может проявляться стерическим влиянием на константу скорости. В приведенном выше примере дейтерий рацемизируется быстрее, чем изотополог водорода, что приводит к стерическому изотопному эффекту. Модель стерического изотопного эффекта была разработана Бартеллом. Эффект стерического изотопа обычно невелик, если преобразования не проходят через переходное состояние с серьезными стерическими препятствиями, как в процессе рацемизации, показанном выше.
Другой пример стерического изотопного эффекта - это реакция удаления ротаксанов. Изотоп дейтерия, благодаря своему меньшему эффективному размеру, позволяет более легкому прохождению стопоров через макроцикл, что приводит к более высокой скорости удаления дейтерированных ротаксанов.
Реакции известны где дейтерированные частицы реагируют быстрее, чем недейтерированный аналог, и в этих случаях, как говорят, проявляются обратные кинетические изотопные эффекты (IKIE). IKIE часто наблюдаются при восстановительном удалении алкилгидридов металлов, например (Me2NCH 2CH2NMe 2 ) PtMe (H). В таких случаях связь CD в переходном состоянии, агостическая разновидность, сильно стабилизирована по отношению к связи C – H.
Обратный эффект также может иметь место в многоступенчатой реакции, если общая константа скорости зависит от предварительного равновесия перед этапом определения скорости, который имеет обратный равновесный изотопный эффект. Например, скорости реакций, катализируемых кислотой, обычно в 2-3 раза больше для реакций в D 2 O, катализируемых D 3 O, чем для аналогичных реакции в H 2 O, катализируемые H 3 O Это можно объяснить механизмом специфического водородно-ионного катализа реагента R с помощью H 3 O (или D 3 O).
Тогда скорость образования продуктов равна d [P ] / dt = k 2 [RH] = k 2K1[H3O] [R] = k obs [H3O] [R]. На первой стадии H 3 O обычно является более сильной кислотой, чем RH. Дейтерирование смещает равновесие в сторону более сильно связанных разновидностей кислоты RD, в которых влияние дейтерирования на нулевую колебательную энергию больше, так что дейтерированная константа равновесия K 1D больше, чем K 1H. Этот равновесный изотопный эффект на первом этапе обычно перевешивает кинетический изотопный эффект на втором этапе, так что существует очевидный обратный изотопный эффект и наблюдаемая общая константа скорости k obs = k 2K1уменьшается.
Чтобы изотопные эффекты растворителя можно было измерить, конечная доля растворителя должна составлять имеют другой изотопный состав, чем остальные. Следовательно, должны быть доступны большие количества менее распространенных изотопов, что ограничивает наблюдаемые изотопные эффекты растворителя изотопными замещениями с участием водорода. Обнаруживаемые кинетические изотопные эффекты возникают только тогда, когда растворенные вещества обмениваются водородом с растворителем или когда существует определенное взаимодействие растворенного вещества и растворителя рядом с местом реакции. Оба эти явления характерны для протонных растворителей, в которых водород является обменным, и они могут образовывать диполь-дипольные взаимодействия или водородные связи с полярными молекулами.
Большинство органических реакции включают разрыв и образование связей с углеродом; таким образом, можно ожидать обнаруживаемых изотопных эффектов углерода. Когда C используется в качестве метки, изменение массы изотопа составляет всего ~ 8%, что ограничивает наблюдаемые кинетические изотопные эффекты до гораздо меньших значений, чем те, которые наблюдаются с изотопными эффектами водорода.
Часто самым большим источником ошибок в исследовании, которое зависит от естественного содержания углерода, является небольшое изменение самого естественного содержания углерода. Такие вариации возникают из-за того, что исходные материалы, используемые в реакции, сами являются продуктами некоторых других реакций, которые имеют кинетические изотопные эффекты и соответствующее изотопное обогащение в продуктах. Чтобы компенсировать эту ошибку, когда ЯМР-спектроскопия используется для определения кинетического изотопного эффекта, были предложены следующие рекомендации:
Если эти, а также некоторые другие меры предосторожности перечислены Янковского, кинетические изотопные эффекты с точностью до трех десятичных знаков могут быть достигнуты.
Интерпретация изотопных эффектов углерода обычно осложняется одновременным образованием и разрушением приятный DS в углерод. Даже реакции, которые включают только разрыв связи с углеродом, такие как реакции S N 1, включают усиление оставшихся связей с углеродом. Во многих таких реакциях изотопные эффекты уходящей группы, как правило, легче интерпретировать. Например, реакции замещения и элиминирования, в которых хлор действует как уходящая группа, удобно интерпретировать, особенно потому, что хлор действует как одноатомная разновидность без внутренних связей, усложняющих координату реакции, и он имеет два стабильных изотопа, Cl и Cl, оба с большим обилием. Основной проблемой при интерпретации таких изотопных эффектов является сольватация уходящей группы.
Из-за экспериментальных неопределенностей измерение изотопного эффекта может повлечь за собой значительную неопределенность. Часто изотопные эффекты определяются путем дополнительных исследований ряда изотопомеров. Соответственно, весьма полезно сочетать изотопные эффекты водорода с изотопными эффектами тяжелых атомов. Например, определение изотопного эффекта азота наряду с изотопным эффектом водорода было использовано, чтобы показать, что реакция иона 2-фенилэтилтриметиламмония с этоксидом в этаноле при 40 ° C следует по механизму E2, в отличие от альтернативных несогласованных механизмов. Этот вывод был сделан после того, как было показано, что эта реакция дает изотопный эффект азота, k 14/k15, равный 1,0133 ± 0,0002, наряду с кинетическим изотопным эффектом водорода, равным 3,2, на выходящем водороде. изотопные эффекты использовались, чтобы показать, что син-элиминация простых солей аммония также следует согласованному механизму, который ранее был предметом дискуссий. В следующих двух реакциях иона 2-фенилциклопентилтриметиламмония с этоксидом, обе из которых дают 1-фенилциклопентен, оба изомера проявляют изотопный эффект азота k 14/k15при 60 ° C. Хотя реакция транс-изомера, которая следует за син-элиминированием, имеет меньший кинетический изотопный эффект азота (1,0064) по сравнению с цис-изомером, который подвергается антиэлиминированию (1,0108), оба результата достаточно велики, чтобы указывать на ослабление связи CN. в переходном состоянии, которое произойдет в согласованном процессе.
Поскольку кинетические изотопные эффекты возникают из-за различий в изотопных массах, наибольшие наблюдаемые кинетические изотопные эффекты связаны с изотопными замещениями водорода дейтерием (увеличение массы на 100%) или тритием (увеличение массы на 200%). в массе). Кинетические изотопные эффекты от отношения изотопных масс могут достигать 36,4 при использовании мюонов. Они создали самый легкий атом водорода, H (0,113 а.е.м.), в котором электрон вращается вокруг положительного мюонного (μ) «ядра», которое имеет массу 206 электронов. Они также подготовили аналог самого тяжелого атома водорода, заменив один электрон в гелии отрицательным мюоном (μ), чтобы сформировать Heμ с атомной массой 4,116 а.е.м. Поскольку отрицательный мюон намного тяжелее электрона, он вращается намного ближе к ядру, эффективно экранируя один протон, заставляя Heμ вести себя как H. С этими экзотическими частицами реакция H с H 2 была исследованы. Константы скорости реакции самых легких и тяжелых аналогов водорода с H 2 затем были использованы для расчета кинетического изотопного эффекта k 0,11 / k 4,1, в котором разница в массах изотопов составляет 36,4 раза. В этой реакции изотопное замещение вызывает обратный кинетический изотопный эффект, и авторы сообщают, что кинетический изотопный эффект составляет всего 1,74 x 10, что является наименьшим кинетическим изотопным эффектом, о котором когда-либо сообщалось.
Кинетический изотопный эффект приводит к определенному распределению изотопов дейтерия в природных продуктах в зависимости от того, каким путем они были синтезированы в природе. Таким образом, с помощью ЯМР-спектроскопии легко определить, был ли спирт в вине сброжен из глюкозы или из незаконно добавленной сахарозы.
Другой механизм реакции, который был выяснен с использованием кинетический изотопный эффект представляет собой галогенирование толуола :

. В этом конкретном исследовании «внутримолекулярного KIE» бензильный водород подвергается радикальному замещению бромом с использованием N- бромсукцинимид в качестве бромирующего агента. Было обнаружено, что PhCH 3 бромируется в 4,86 раза быстрее, чем PhCD 3. Большой KIE, равный 5,56, связан с реакцией кетонов с бромом и гидроксидом натрия.

. В этой реакции лимитирующей стадией является образование енолят депротонированием кетона. В этом исследовании KIE рассчитывается на основе констант скорости реакции для обычного 2,4-диметил-3-пентанона и его дейтерированного изомера с помощью измерений оптической плотности.
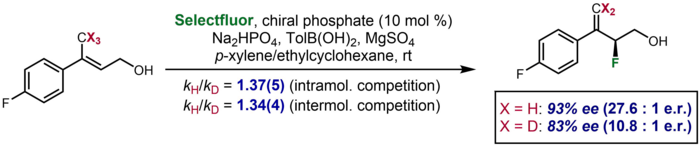
При асимметричном катализе в редких случаях кинетический изотопный эффект проявляется в виде значительного различия в энантиоселективности, наблюдаемой для дейтерированного субстрата по сравнению с недейтерированным. Один пример был описан Toste и соавторами, в котором дейтерированный субстрат давал энантиоселективность 83% ee по сравнению с 93% ee для недейтерированного субстрата. Эффект был предпринят для подтверждения дополнительных данных KIE о меж- и внутримолекулярной конкуренции, которые предполагали разрыв связи CH / D на стадии энантиоопределения.