Оксианион или oxoanion, является ион с общей формулой А ИксОг - у(где A представляет собой химический элемент, а O представляет собой атом кислорода ). Оксианионы образуются из подавляющего большинства химических элементов. Формулы простых оксианионов определяются правилом октетов. Соответствующая оксикислота оксианиона представляет собой соединение H zА ИксО у. Структуры конденсированных оксианионов могут быть объяснены в терминах многогранных единиц AO n с разделением углов или ребер между многогранниками. Оксианионы (в частности, фосфатные и полифосфатные эфиры) аденозинмонофосфат ( AMP ), аденозиндифосфат ( ADP ) и аденозинтрифосфат (ATP) важны в биологии.
Формула мономерных оксианионов, АОм - н, продиктовано степенью окисления элемента A и его положением в периодической таблице. Максимальное координационное число элементов первого ряда ограничено 4. Однако ни один из элементов первого ряда не имеет мономерного оксианиона с таким координационным числом. Вместо этого карбонат ( CO2- 3) и нитратов ( NO- 3) имеют тригональную планарную структуру с π-связью между центральным атомом и атомами кислорода. Этой π-связи способствует сходство размеров центрального атома и кислорода.
Оксианионы элементов второго ряда в групповой степени окисления тетраэдрические. Тетраэдрический SiO 4единицы найдены в минералах оливина, [Mg, Fe] SiO 4, но анион не существует отдельно, поскольку атомы кислорода тетраэдрически окружены катионами в твердом состоянии. Фосфат ( PO3- 4), сульфат ( SO2- 4) и перхлорат ( ClO- 4) ионы могут быть найдены как таковые в различных солях. Многие оксианионы элементов в более низкой степени окисления подчиняются правилу октетов, и это можно использовать для рационализации принятых формул. Например, хлор (V) имеет два валентных электрона, поэтому он может вместить три пары электронов из связей с ионами оксида. Заряд иона равен +5 - 3 × 2 = −1, поэтому формула ClO- 3. Теория VSEPR предсказывает пирамидальную структуру иона с тремя связующими электронными парами и одной неподеленной парой. Аналогичным образом оксианион хлора (III) имеет формулу ClO- 2, и изгибается двумя неподеленными парами и двумя парами соединений.
| Состояние окисления | Имя | Формула | Изображение |
|---|---|---|---|
| +1 | Гипохлорит ион | ClO - |  |
| +3 | Хлорит ион | ClO- 2 |  |
| +5 | Хлорат ион | ClO- 3 |  |
| +7 | Перхлорат ион | ClO- 4 |  |
В третьей и последующих строках периодической таблицы возможна 6-координация, но изолированные октаэдрические оксианионы неизвестны, потому что они несут слишком высокий электрический заряд. Таким образом, молибден (VI) не образует MoO6- 6, но образует тетраэдрический молибдат- анион MoO2- 4. Единицы MoO 6 находятся в конденсированных молибдатах. Полностью протонированные оксианионы с октаэдрической структурой обнаруживаются в таких частицах, как Sn (OH).2- 6и Sb (OH)- 6. Кроме того, ортопериодат может быть протонирован только частично, при этом H 3IO2- 6|| ⇌ || ЧАС 2IO3- 6|| + H + с p K a = 11,60.
Обозначение мономерных оксианионов следует по следующим правилам.
| Степень окисления центрального атома | Схема именования | Примеры |
|---|---|---|
| = Номер группы | *-съел | Борат ( BO3- 3), Карбонат ( CO2- 3), Нитраты ( NO- 3), Фосфат ( PO3- 4), Сульфат ( SO2- 4), Хромат ( CrO2- 4), Арсенат ( AsO3- 4), Феррат ( FeO2- 4) |
| = Номер группы - 2 | * -ite | Нитриты ( НЕТ- 2), Фосфит ( PO3- 3), Сульфит ( SO2- 3), Арсенит ( AsO3- 3) |
| = Номер группы - 4 | гипо - * - ите | Гипофосфит ( ПО3- 2), Гипосульфит ( SO2- 2) |
| Степень окисления центрального атома | Схема именования | Примеры |
|---|---|---|
| = Номер группы | за - * - съел | Перхлорат ( ClO- 4), Пербромат ( BrO- 4), Periodate ( IO- 4), Перманганат ( MnO- 4), Perxenate ( XeO4- 6) |
| = Номер группы - 2 | *-съел | Хлорат ( ClO- 3), Бромат ( BrO- 3), Йодат ( IO- 3) |
| = Номер группы - 4 | * -ite | Хлорит ( ClO- 2), Бромит ( BrO- 2) |
| = Номер группы - 6 | гипо - * - ите | Гипохлорит (ClO -), Гипобромит (BrO -) |
 Дихромат-ион; два тетраэдра имеют общий угол
Дихромат-ион; два тетраэдра имеют общий угол В водном растворе оксианионы с высоким зарядом могут вступать в реакции конденсации, такие как образование дихромат- иона Cr 2О2- 7:
Движущей силой этой реакции является уменьшение плотности электрического заряда на анионе и устранение иона H +. Количество порядка в растворе уменьшается, высвобождая определенное количество энтропии, что делает свободную энергию Гиббса более отрицательной и способствует прямой реакции. Это пример кислотно-основной реакции, в которой мономерный оксианион действует как основание, а конденсированный оксианион действует как сопряженная кислота. Обратная реакция - это реакция гидролиза, когда молекула воды, выступающая в роли основания, расщепляется. Возможна дальнейшая конденсация, особенно с анионами с более высоким зарядом, как это происходит с аденозинфосфатами.
 | 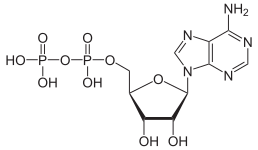 | 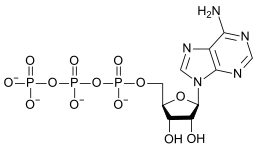 |
| AMP | ADP | АТФ |
Превращение АТФ в АДФ представляет собой реакцию гидролиза и является важным источником энергии в биологических системах.
Образование большинства силикатных минералов можно рассматривать как результат реакции деконденсации, в которой кремнезем реагирует с основным оксидом, кислотно-щелочная реакция в смысле Люкс – Флуда.
 Цепи метаванадата в метаванадате аммония
Цепи метаванадата в метаванадате аммония Polyoxyanion представляет собой полимерный оксианион, в котором множественные оксианионных мономеры, как правило, рассматривается как МО п многогранников, соединены путем обмена углов или краев. Когда два угла многогранника являются общими, результирующая структура может быть цепочкой или кольцом. Короткие цепи встречаются, например, в полифосфатах. Иносиликаты, такие как пироксены, имеют длинную цепочку тетраэдров SiO 4, каждый из которых имеет два угла. Такая же структура встречается в так называемых метаванадатах, таких как метаванадат аммония, NH 4 VO 3.
Формула оксианиона SiO2- 3получается следующим образом: каждый номинальный ион кремния (Si 4+) присоединен к двум номинальным ионам оксида (O 2-) и имеет половину доли в двух других. Таким образом, стехиометрия и заряд определяются по формуле:
Кольцо можно рассматривать как цепочку, в которой соединены два конца. Циклический трифосфат, P 3О3- 9 это пример.
Когда три угла являются общими, структура расширяется в два измерения. У амфиболов ( примером которых является асбест ) две цепи связаны друг с другом, разделяя третий угол в разных местах цепи. Это приводит к идеальной формуле Si 4О6- 11и линейная цепочечная структура, которая объясняет волокнистую природу этих минералов. Совместное использование всех трех углов может привести к структуре листа, как и в слюды, Si, 2О2- 5, в котором каждый кремний имеет один кислород и половину доли в трех других. Кристаллическую слюду можно расколоть на очень тонкие листы.
Совместное использование всех четырех углов тетраэдров приводит к трехмерной структуре, например, в кварце. Алюмосиликаты - это минералы, в которых некоторое количество кремния заменено алюминием. Однако степень окисления алюминия на единицу меньше, чем у кремния, поэтому замена должна сопровождаться добавлением другого катиона. Число возможных комбинаций такой структуры очень велико, что отчасти является причиной того, что существует так много алюмосиликатов.
 Декаванадат-ион, В 10О4- 28
Декаванадат-ион, В 10О4- 28 Октаэдрические звенья МО 6 распространены в оксианионах более крупных переходных металлов. Некоторые соединения, такие как соли цепно-полимерного иона Mo 2О2- 7даже содержат как тетраэдрические, так и октаэдрические звенья. Совместное использование ребер является обычным явлением для ионов, содержащих октаэдрические строительные блоки, и октаэдры обычно искажаются, чтобы уменьшить напряжение на мостиковых атомах кислорода. В результате образуются трехмерные структуры, называемые полиоксометаллатами. Типичные примеры встречаются в структуре Кеггина от фосфоромолибдата иона. Совместное использование ребер является эффективным средством снижения плотности электрического заряда, что можно увидеть на примере гипотетической реакции конденсации с участием двух октаэдров:
Здесь средний заряд на каждом атоме M уменьшается на 2. Эффективность разделения ребер демонстрируется следующей реакцией, которая происходит при подкислении щелочного водного раствора молибдата.
Тетраэдрический ион молибдата превращается в кластер из 7 связанных ребер октаэдров, что дает средний заряд каждого молибдена 6 ⁄ 7. Гептамолибдатный кластер настолько стабилен, что кластеры, содержащие от 2 до 6 молибдатных звеньев, не были обнаружены, даже если они должны быть образованы в качестве промежуточных продуктов.
О pKa родственных кислот можно судить по количеству двойных связей с кислородом. Таким образом, хлорная кислота является очень сильной кислотой, в то время как хлорноватистая кислота очень слабой. Простое правило обычно работает с точностью до 1 единицы pH.
Большинство оксианионов являются слабыми основаниями и могут протонироваться с образованием кислот или кислотных солей. Например, фосфат-ион можно последовательно протонировать с образованием фосфорной кислоты.
 HPO2- 3(фосфит-ион) структура
HPO2- 3(фосфит-ион) структура  Молекула серной кислоты
Молекула серной кислоты Степень протонирования в водном растворе будет зависеть от констант диссоциации кислоты и pH. Например, АМФ (аденозинмонофосфата) имеет Ap K на значение 6,21, так что при рН 7 будет составлять около 10% протонированного. Нейтрализация заряда является важным фактором в этих реакциях протонирования. Напротив, перхлорат- и перманганат- ионы одновалентных анионов очень трудно протонировать, и поэтому соответствующие кислоты являются сильными кислотами.
Хотя кислоты, такие как фосфорная кислота, записываются как H 3 PO 4, протоны присоединяются к атомам кислорода, образуя гидроксильные группы, поэтому формулу также можно записать как OP (OH) 3, чтобы лучше отражать структуру. Серная кислота может быть записана как O 2 S (OH) 2 ; это молекула, наблюдаемая в газовой фазе.
Фосфита ион, РО3- 3, является сильным основанием и поэтому всегда несет хотя бы один протон. В этом случае протон присоединяется непосредственно к атому фосфора со структурой HPO2- 3. При образовании этого иона ион фосфита действует как основание Льюиса и отдает пару электронов кислоте Льюиса, H +.
 Диаграмма преобладания хромата
Диаграмма преобладания хромата Как упоминалось выше, реакция конденсации также является кислотно-щелочной реакцией. Во многих системах могут происходить реакции как протонирования, так и конденсации. Случай с ионом хромата представляет собой относительно простой пример. На диаграмме преобладания хромата, показанной справа, pCr обозначает отрицательный логарифм концентрации хрома, а pH обозначает отрицательный логарифм концентрации ионов H +. Есть два независимых состояния равновесия. Константы равновесия определяются следующим образом.
| CrO2- 4+ H + ⇌ HCrO- 4 | журнал K 1 = 5,89 | |
| 2 HCrO- 4⇌ Cr 2О2- 7+ H 2 O | журнал K 2 = 2,05 |
Диаграмма преобладания интерпретируется следующим образом.
Виды H 2 CrO 4 и HCr 2О- 7 не показаны, поскольку они образуются только при очень низком pH.
Диаграммы преобладания могут стать очень сложными, когда могут быть образованы многие полимерные частицы, такие как ванадаты, молибдаты и вольфраматы. Еще одна сложность заключается в том, что многие из высших полимеров образуются чрезвычайно медленно, так что равновесие может не достигаться даже за месяцы, что приводит к возможным ошибкам в константах равновесия и диаграмме преобладания.
| HClO 4 | Он | ||||||||||||||||
| LiClO 4 | Be (ClO 4) 2 | B (ClO 4)- 4 B (ClO 4) 3 | ROClO 3 | N (ClO 4) 3 NH 4 ClO 4 NOClO 4 | О | FClO 4 | Ne | ||||||||||
| NaClO 4 | Mg (ClO 4) 2 | Al (ClO 4) 3 | Si | п | S | ClO- 4 ClOClO 3 Cl 2 O 7 | Ar | ||||||||||
| KClO 4 | Ca (ClO 4) 2 | Sc (ClO 4) 3 | Ti (ClO 4) 4 | VO (ClO 4) 3 VO 2 (ClO 4) | Cr (ClO 4) 3 | Mn (ClO 4) 2 | Fe (ClO 4) 2 | Co (ClO 4) 2, Co (ClO 4) 3 | Ni (ClO 4) 2 | Cu (ClO 4) 2 | Zn (ClO 4) 2 | Ga (ClO 4) 3 | Ge | В виде | Se | Br | Kr |
| RbClO 4 | Sr (ClO 4) 2 | Y (ClO 4) 3 | Zr (ClO 4) 4 | Nb (ClO 4) 5 | Пн | Tc | RU | Rh (ClO 4) 3 | Pd (ClO 4) 2 | AgClO 4 | Cd (ClO 4) 2 | В (ClO 4) 3 | Sn (ClO 4) 4 | Sb | TeO (ClO 4) 2 | я | Xe |
| CsClO 4 | Ba (ClO 4) 2 | Hf (ClO 4) 4 | Та (ClO 4) 5 | W | Re | Операционные системы | Ir | Pt | Au | Hg 2 (ClO 4) 2, Hg (ClO 4) 2 | Tl (ClO 4), Tl (ClO 4) 3 | Pb (ClO 4) 2 | Bi (ClO 4) 3 | По | В | Rn | |
| FrClO 4 | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла | Ce (ClO 4) x | Pr | Nd | Вечера | Sm (ClO 4) 3 | Eu (ClO 4) 3 | Gd (ClO 4) 3 | Tb (ClO 4) 3 | Dy (ClO 4) 3 | Ho (ClO 4) 3 | Er (ClO 4) 3 | Tm (ClO 4) 3 | Yb (ClO 4) 3 | Lu (ClO 4) 3 | |||
| Ac | Th (ClO 4) 4 | Па | UO 2 (ClO 4) 2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||