| Реакция Джонсона-Кори-Чайковского | |
|---|---|
| Названа в честь | А. Уильям Джонсон. Элиас Джеймс Кори. Майкл Чайковский |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | corey-chaykovsky-response |
Реакция Джонсона – Кори – Чайковского (иногда называемая реакцией Кори – Чайковского или CCR ) - это используемая химическая реакция в органической химии для синтеза эпоксидов, азиридинов и циклопропанов. Он был открыт в 1961 году А. Уильямом Джонсоном и значительно развит Э. Дж. Кори и Михаил Чайковский. Реакция включает добавление илида серы к кетону, альдегиду, имину или енону с получением соответствующее 3-членное кольцо. Реакция является диастереоселективной, благоприятствующей транс-замещению в продукте, независимо от исходной стереохимии. Синтез эпоксидов этим методом служит важной ретросинтетической альтернативой традиционным реакциям эпоксидирования олефинов.

. Реакция используется чаще всего. для эпоксидирования посредством переноса метилена, и с этой целью он был использован в нескольких известных полных синтезах (см. Синтез эпоксидов ниже). Кроме того, ниже подробно описаны история, механизм, объем и энантиоселективные варианты реакции. Было опубликовано несколько обзоров.
Первоначальная публикация Джонсона касалась реакции 9-диметилсульфоний флуоренилида с замещенными производными бензальдегида. Попытка подобной реакции Виттига не удалась, и вместо нее был получен оксид бензалфлуорена, при этом было отмечено, что «реакция между илидом серы и бензальдегидами не дала бензальфлуорены, как это было с илидами фосфора и мышьяка».

Последующее развитие (диметилоксосульфанил) метанида, (CH 3)2SOCH 2 и (диметилсульфанил) метанида, (CH 3)2SCH 2 (известные как реактивы Кори-Чайковского ) Кори и Чайковского в качестве эффективных реагентов для переноса метилена установили реакцию как часть органического канона.

Механизм реакции для реакции Джонсона – Кори – Чайковского состоит из нуклеофильного присоединения илида к карбонильной или иминовой группе. Отрицательный заряд переносится на гетероатом и поскольку катион сульфония является хорошей уходящей группой, он удаляется, образуя кольцо. В связанной реакции Виттига формирование большого количества tronger фосфор -кислород двойная связь предотвращает образование оксирана и вместо этого происходит через 4-членный циклический интермедиат.

Транс диастереоселективность наблюдалась в результате обратимости начального добавления, что позволяет уравновесить предпочтительный анти бетаин по сравнению с синбетаином. Первоначальное добавление илида приводит к бетаину с соседними зарядами; расчеты по теории функционала плотности показали, что ограничивающий скорость этап представляет собой вращение центральной связи в конформер, необходимый для обратной атаки на сульфоний.

Степень обратимости на начальной стадии (и, следовательно, диастереоселективность) зависит от четырех факторов, причем большая обратимость соответствует более высокой селективности:
Применение реакции Джонсона – Кори – Чайковского в органическом синтезе разнообразно. Реакция стала охватывать реакции многих типов илидов серы с электрофилами, выходящими далеко за рамки оригинальных публикаций. Он нашел применение в ряде громких тотальных синтезов, как подробно описано ниже, и, как правило, признан мощным трансформирующим инструментом в органическом репертуаре.
 Общая форма используемого илидного реагента
Общая форма используемого илидного реагента Многие типы илидов могут быть получены с различными функциональными группами как на анионном углеродном центре, так и на сере. Тип замещения может влиять на легкость приготовления реагентов (обычно из галогенида сульфония, например, иодид триметилсульфония ) и общую скорость реакции различными способами. Общий формат реагента показан справа.
Использование сульфоксония позволяет более легко приготовить реагент с использованием более слабых оснований по сравнению с илидами сульфония. (Разница в том, что сульфоксоний содержит кислород с двойной связью, а сульфоний нет.) Первые реагируют медленнее из-за их повышенной стабильности. Кроме того, диалкилсульфоксид побочные продукты сульфоксониевых реагентов намного предпочтительнее значительно более токсичных, летучих и пахучих диалкилсульфидных побочных продуктов сульфониевых реагентов.
Подавляющее большинство реагентов являются монозамещенными по илиду углерода (либо R 1, либо R 2 в качестве водорода). Дизамещенные реагенты встречаются гораздо реже, но были описаны:
R-группы на сере, хотя обычно метил, использовались для синтеза реагентов, которые могут выполнять энантиоселективно варианты реакции (см. Варианты ниже). Размер групп также может влиять на диастереоселективность в алициклических субстратах.
Реакции сернистых илидов с кетонами и альдегиды с образованием эпоксидов на сегодняшний день являются наиболее распространенным применением реакции Джонсона – Кори – Чайковского. Сообщалось о примерах, включающих сложные субстраты и «экзотические» илиды, как показано ниже.

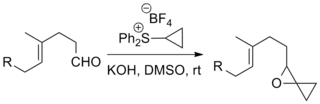
Реакция была использована в ряде заметных общих синтезов, включая общий синтез таксола Данишефского, который дает химиотерапевтический препарат таксол и общий синтез стрихнина Кюне, который производит пестицид стрихнин.


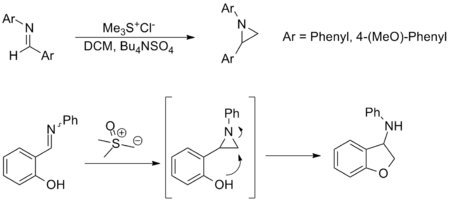
Синтез азиридины из иминов - еще одно важное применение реакции Джонсона-Кори-Чайковского и обеспечивает альтернативу переносу амина из оксазиридинов. Хотя эта реакция менее широко применяется, она имеет такой же объем субстрата и устойчивость по функциональным группам к карбонильному эквиваленту. Примеры, показанные ниже, являются репрезентативными; в последнем азиридин образуется in situ и открывается посредством нуклеофильной атаки с образованием соответствующего амина.
Для добавления сернистых илидов к енонам, более высокая 1,4-селективность обычно достигается с сульфоксониевыми реагентами, чем с сульфониевыми реагентами. Было показано, что многие электроноакцепторные группы совместимы с реакцией, включая кетоны, сложные эфиры и амиды (в приведенном ниже примере используется амид Вайнреба ). В других сопряженных системах 1,6-присоединение имеет тенденцию преобладать над 1,4-присоединением.

В дополнение к реакциям, первоначально описанным Джонсоном, Кори и Чайковским, использовались илиды серы. для ряда связанных реакций омологации, которые, как правило, группируются под одним и тем же названием.

![[4 + 1] циклоприсоединение с Кори –Реагент Чайковского](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/CCR41.png/320px-CCR41.png)

Разработка энантиоселективного (т.е. дающего энантиомерный избыток, который обозначен как «ее») варианта Реакция Джонсона – Кори – Чайковского остается активной областью академических исследований. Использование хиральных сульфидов в стехиометрическом способе оказалось более успешным, чем соответствующие каталитические варианты, но объем субстрата по-прежнему ограничен во всех случаях. Каталитические варианты были разработаны почти исключительно для энантиоселективных целей; типичные органосульфидные реагенты не являются чрезмерно дорогими, и рацемические реакции можно проводить с эквимолярными количествами илида без значительного увеличения затрат. С другой стороны, хиральные сульфиды являются более дорогостоящими в получении, что стимулирует развитие каталитических энантиоселективных методов.
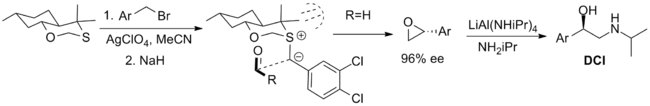
Наиболее успешные реагенты, используемые стехиометрическим способом, показаны ниже. Первый - это бициклический оксатиан, который был использован в синтезе β-адренергического соединения дихлоризопротеренола (DCI), но ограничен доступностью только одного энантиомера реагента. Синтез аксиального диастереомера рационализирован за счет 1,3- аномерного эффекта, который снижает нуклеофильность экваториальной неподеленной пары. конформация илида ограничена трансаннулярным штаммом, а приближение альдегида к одной стороне илида ограничено стерическими взаимодействиями с метильными заместителями.
Другой главный реагент представляет собой реагент на основе камфары, разработанный Вариндером Аггарвалом из Бристольского университета. Оба энантиомера легко синтезируются, хотя выходы ниже, чем для оксатианового реагента. Конформация илида определяется взаимодействием с мостиком атомами водорода, и приближение альдегида блокируется камфорным фрагментом. В реакции используется фосфазен основание, чтобы способствовать образованию илида.
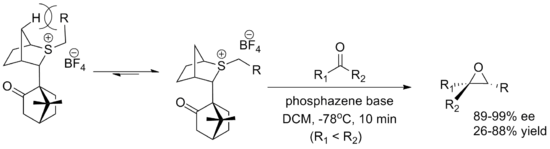
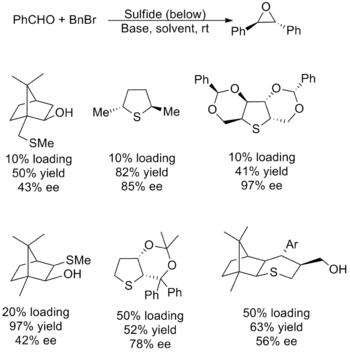
Каталитические реагенты были менее успешными, при этом большинство вариантов страдали низким выходом, низкой энантиоселективностью или обоими. Также существуют проблемы с областью применения субстрата, большинство из которых имеет ограничения по переносу метилена и алифатических альдегидов. Проблема возникает из-за необходимости в нуклеофильном сульфиде, который эффективно генерирует илид, который также может действовать как хорошая уходящая группа для образования эпоксида. Поскольку факторы, лежащие в основе этих желаний, противоречат друг другу, настройка свойств катализатора оказалась сложной. Ниже показаны некоторые из наиболее успешных катализаторов, а также выходы и энантиомерный избыток для их использования в синтезе (E) -стильбена оксида.
Аггарвал разработал альтернативный метод с использованием того же сульфида, что и выше. и новое алкилирование с участием родия карбеноида, образованного in situ. Метод также имеет ограниченную область применения субстрата, не подходя для любых электрофилов, обладающих основными заместителями из-за конкурентного потребления карбеноида.
