 Стилизованное изображение активированного NMDAR. Глутамат находится в сайте связывания глутамата, а глицин находится в сайте связывания глицина. Аллостерический сайт , который модулирует функцию рецептора при связывании с лигандом, не занят. NMDAR требует связывания двух молекул глутамата или аспартата и двух молекул глицина.
Стилизованное изображение активированного NMDAR. Глутамат находится в сайте связывания глутамата, а глицин находится в сайте связывания глицина. Аллостерический сайт , который модулирует функцию рецептора при связывании с лигандом, не занят. NMDAR требует связывания двух молекул глутамата или аспартата и двух молекул глицина. Рецептор N-метил-D-аспартата (также известный как рецептор NMDA или NMDAR ), представляет собой рецептор глутамата и ионный канал белок, обнаруженный в нервные клетки. Рецептор NMDA является одним из трех типов ионотропных рецепторов глутамата. Другими рецепторами являются AMPA и каинатные рецепторы. Он активируется, когда с ним связываются глутамат и глицин (или D-серин ), и при активации он позволяет положительно заряженным ионам течь. через клеточную мембрану. Рецептор NMDA очень важен для управления синаптической пластичностью и функцией памяти.
NMDAR представляет собой особый тип ионотропного глутамата. рецептор. Рецептор NMDA назван так потому, что молекула агониста N-метил- D -аспартат (NMDA) селективно связывается с ним, а не с другими рецепторами глутамата. Активация рецепторов NMDA приводит к открытию ионного канала, который является неселективным по отношению к катионам, с комбинированным реверсивным потенциалом около 0 мВ. В то время как открытие и закрытие ионного канала в основном регулируется связыванием лиганда, ток, протекающий через ионный канал, зависит от напряжения. Внеклеточные ионы магния (Mg) и цинка (Zn) могут связываться с определенными участками рецептора, блокируя прохождение других катионов через открытый ионный канал. Деполяризация клетки вытесняет и отталкивает ионы Mg и Zn из поры, тем самым обеспечивая зависящий от напряжения поток ионов натрия (Na) и небольшого количества ионов кальция (Ca) в клетку и калия (K) из клетки.
Поток Ca через NMDAR считается критическим для синаптической пластичности, клеточного механизма обучения и памяти. Открытие и закрытие (стробирование) рецептора NMDA сложны. Хотя это в первую очередь канал, управляемый лигандом, он действительно демонстрирует более слабую модуляцию зависимого от напряжения лиганд-зависимого переключения. Блокирование лиганда требует совместной активации двумя лигандами: глутаматом и либо D-серином, либо глицином. Зависимость тока через канал от напряжения в основном связана с связыванием ионов Mg или Zn с белком, как описано выше.
На активность рецептора NMDA влияют многие психоактивные препараты, такие как фенциклидин (PCP), алкоголь (этанол ) и декстрометорфан (ДХМ). анестезирующее и обезболивающее эффекты препаратов кетамин и закиси азота частично обусловлены их эффектами на активность рецепторов NMDA. С 1989 года мемантин был признан неконкурентным антагонистом рецептора N-метил- D -аспартата (рецептора NMDA), проникающего в канал рецептора. после того, как он был активирован и тем самым блокировал поток ионов.
Каналы рецепторов NMDA играют важную роль в синаптическая пластичность и формирование синапсов, лежащих в основе памяти, обучения и формирования нейронных сетей во время развития в центральной нервной системе (ЦНС). Сверхактивация рецептора, вызывающая чрезмерный приток Са, может привести к эксайтотоксичности, которая, как предполагается, участвует в некоторых нейродегенеративных расстройствах. Следовательно, блокирование рецепторов NMDA может быть теоретически полезным при лечении таких заболеваний.
Однако гипофункция рецепторов NMDA (из-за дефицита глутатиона или по другим причинам) может быть вовлечена в нарушение функции синаптическая пластичность и может иметь другие негативные последствия. Основная проблема с использованием антагонистов рецептора NMDA для нейрозащиты заключается в том, что физиологические действия рецептора NMDA важны для нормальной функции нейронов. Чтобы получить клиническое признание, успешное клиническое применение антагонистов NMDA должно блокировать чрезмерную активацию без нарушения нормальных функций.
За открытием рецепторов NMDA последовали синтез и изучение N -метил- D -аспарагиновая кислота (NMDA) в 1960-х годах Джеффом Уоткинсом и его коллегами. В начале 1980-х было показано, что рецепторы NMDA участвуют в нескольких центральных синаптических путях. Селективность субъединицы рецептора была открыта в начале 1990-х годов, что привело к открытию нового класса соединений, которые избирательно ингибируют субъединицу NR2B. Эти результаты привели к активной кампании в фармацевтической промышленности. Исходя из этого, было сочтено, что рецепторы NMDA связаны с множеством неврологических расстройств, таких как эпилепсия, болезнь Паркинсона, болезнь Альцгеймера, Болезнь Хантингтона и другие расстройства ЦНС.
Случайное открытие было сделано в 1968 году, когда женщина принимала амантадин в качестве лекарства от гриппа, и у нее наступила заметная ремиссия симптомов Паркинсона. Это открытие, о котором сообщили Scawab et al., Явилось началом медицинской химии производных адамантана в контексте заболеваний, влияющих на ЦНС. До этого открытия мемантин, другое производное адамантана, был синтезирован Eli Lilly and Company в 1963 году. Целью было разработать гипогликемический препарат, но он не показал такой эффективности. Только в 1972 году было обнаружено возможное терапевтическое значение мемантина для лечения нейродегенеративных расстройств. С 1989 года мемантин был признан неконкурентоспособным антагонистом рецептора NMDA.
Функциональные рецепторы NMDA представляют собой гетеротетрамеры, состоящие из двух GluN1 и обычно двух субъединиц GluN2. Существует один гена, кодирующий субъединицу GluN1, четыре GluN2 и два GluN3, и каждый ген может продуцировать более одного варианта сплайсинга.
 Рисунок 1: рецептор NR1 / NR2 NMDA
Рисунок 1: рецептор NR1 / NR2 NMDA NMDA Рецептор представляет собой рецептор белка глутамата и ионного канала, который активируется, когда с ним связываются глицин и глутамат. Рецептор представляет собой гетеромерный комплекс, который взаимодействует с множеством внутриклеточных белков с помощью трех различных субъединиц: GluN1, GluN2 и GluN3. GluN1 имеет восемь различных изоформ из-за альтернативного сплайсинга гена GRIN1. Существует четыре разных субъединицы GluN2 (A-D) и две разные субъединицы Glun3 (A и B). Шесть отдельных генов кодируют GluN2 и GluN3. Все субъединицы имеют общую мембранную топологию, в которой преобладает большой внеклеточный N-конец, мембранная область, состоящая из трех трансмембранных сегментов, петля входящей поры, внеклеточная петля между трансмембранными сегментами, которые структурно малоизвестны, и внутриклеточный C-конец, который различается по размеру в зависимости от субъединицы и обеспечивает множественные сайты взаимодействия со многими внутриклеточными белками. На рисунке 1 показана базовая структура субъединиц GluN1 / GluN2, которая формирует сайт связывания для мемантина, Mg и кетамина.
 Рисунок 2: Трансмембранная область NR1 (слева) и NR2B ( справа) субъединицы рецептора NMDA.
Рисунок 2: Трансмембранная область NR1 (слева) и NR2B ( справа) субъединицы рецептора NMDA. Mg блокирует канал рецептора NMDA в зависимости от напряжения. Каналы также очень проницаемы для Ca. Активация рецептора зависит от связывания глутамата, D-серина или связывания глицина в его GluN1-связанном сайте связывания и опосредованной рецептором AMPA деполяризации постсинаптической мембраны, который снимает блокировку канала, зависящего от напряжения, за счет Mg. Таким образом, активация и открытие рецепторного канала позволяет потоку ионов K, Na и Ca, а приток Ca запускает внутриклеточные сигнальные пути. Сайты связывания аллостерических рецепторов для цинка, белков и полиаминов, спермидин и спермин также являются модуляторами каналов рецептора NMDA.
Субъединица GluN2B участвует в модуляции активности, такой как обучение, память, процессинг и пищевое поведение, например а также причастен к ряду человеческих расстройств. Основная структура и функции, связанные с рецептором NMDA, могут быть отнесены к субъединице GluN2B. Например, сайт связывания глутамата и контроль блока Mg формируются субъединицей GluN2B. Сайты с высоким сродством к антагонисту глицина также отображаются исключительно рецептором GluN1 / GluN2B.
Трансмембранные сегменты GluN1 / GluN2B считаются частью рецептора, которая формирует карманы связывания для неконкурентоспособные антагонисты рецептора NMDA, но структуры трансмембранных сегментов полностью не известны, как указано выше. Утверждается, что три сайта связывания внутри рецептора, A644 на субъединице GluNB и A645 и N616 на субъединице GluN1, важны для связывания мемантина и родственных соединений, как показано на рисунке 2.
Формы рецептора NMDA гетеротетрамер между двумя субъединицами GluN1 и двумя GluN2 (субъединицы ранее обозначались как GluN1 и GluN2), двумя обязательными субъединицами GluN1 и двумя регионально локализованными субъединицами GluN2. Родственное семейство гена субъединиц A и B GluN3 оказывает ингибирующее действие на активность рецептора. Множественные изоформы рецептора с различными распределениями в головном мозге и функциональными свойствами возникают в результате избирательного сплайсинга транскриптов GluN1 и дифференциальной экспрессии субъединиц GluN2.
Каждая субъединица рецептора имеет модульную конструкцию, и каждый структурный модуль также представляет собой функциональную единицу:
Глицин-связывающие модули субъединиц GluN1 и GluN3 и глутамат-связывающий модуль субъединицы GluN2A были экспрессированы как растворимые белки, и их трехмерная структура была представлена решено с атомным разрешением с помощью рентгеновской кристаллографии. Это выявило общую укладку со связывающими аминокислоты бактериальными белками и с глутамат-связывающим модулем AMPA-рецепторов и каинатных рецепторов.
Избыточная активация рецепторов NMDA, вызывающая чрезмерный приток Са, может привести к эксайтотоксичности. Предполагается, что эксайтотоксичность связана с некоторыми нейродегенеративными расстройствами, такими как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. Следовательно, блокирование рецепторов NMDA могло бы теоретически быть полезным при лечении таких заболеваний. Однако важно сохранить физиологическую активность рецептора NMDA, пытаясь блокировать его чрезмерную эксайтотоксическую активность. Это может быть достигнуто с помощью неконкурентоспособных антагонистов, блокирующих ионный канал рецептора, когда он чрезмерно открыт.
Неконкурентные антагонисты рецептора NMDA или блокаторы каналов проникают в канал рецептора NMDA после его активации и тем самым блокируют поток ионов. MK-801, кетамин, амантадин и мемантин являются примерами таких антагонистов, см. фиг.1. антагониста из рецепторного канала является важным фактором, поскольку слишком медленное снижение скорости может мешать нормальной функции рецептора, а слишком быстрое снижение скорости может привести к неэффективной блокаде чрезмерно открытого рецептора.
Мемантин является пример неконкурентного блокатора каналов рецептора NMDA с относительно быстрым выходом из строя и низким сродством. При физиологическом pH его аминогруппа заряжена положительно, и его антагонизм к рецепторам зависит от напряжения. Таким образом, он имитирует физиологическую функцию Mg как блокатора каналов. Мемантин блокирует каналы, связанные с рецептором NMDA, только во время длительной активации рецептора, как это происходит в эксайтотоксических условиях, путем замены магния в сайте связывания. Во время нормальной активности рецептора каналы остаются открытыми только в течение нескольких миллисекунд, и в этих условиях мемантин не может связываться внутри каналов и, следовательно, не мешает нормальной синаптической активности.
Существует восемь вариантов субъединицы GluN1, полученных альтернативным сплайсингом GRIN1 :
 субъединица NR2 у позвоночных (слева) и беспозвоночных (справа). Ryan et al., 2008
субъединица NR2 у позвоночных (слева) и беспозвоночных (справа). Ryan et al., 2008 В то время как одна субъединица GluN2 обнаружена в организмах беспозвоночных, четыре различные изоформы субъединицы GluN2 экспрессируются у позвоночных и обозначаются номенклатурой GluN2A через GluN2D (кодируется GRIN2A, GRIN2B, GRIN2C, GRIN2D ). Убедительные доказательства показывают, что гены, кодирующие субъединицы GluN2 у позвоночных, прошли по крайней мере два раунда дупликации генов. Они содержат сайт связывания для нейротрансмиттера глутамата. Что еще более важно, каждая субъединица GluN2 имеет отдельный внутриклеточный C-концевой домен, который может взаимодействовать с разными наборами сигнальных молекул. В отличие от субъединиц GluN1, субъединицы GluN2 по-разному экспрессируются в разных типах клеток и временных точках развития и контролируют электрофизиологические свойства рецептора NMDA. GluN2B в основном присутствует в незрелых нейронах и во внесинаптических местах и содержит сайт связывания для селективного ингибитора ифенпродила.
 Временной ход переключения GluN2B-GluN2A в мозжечке человека. Bar-Shira et al., 2015
Временной ход переключения GluN2B-GluN2A в мозжечке человека. Bar-Shira et al., 2015 В то время как GluN2B преобладает в раннем постнатальном мозге, количество субъединиц GluN2A увеличивается на раннем этапе развития; со временем субъединицы становятся более многочисленными, чем GluN2B. Это называется переключением развития GluN2B-GluN2A и примечательно из-за различной кинетики, которую каждая субъединица GluN2 вносит в функцию рецептора. Например, более высокие соотношения субъединицы GluN2B приводят к рецепторам NMDA, которые остаются открытыми дольше по сравнению с рецепторами с большим количеством GluN2A. Это может частично объяснять большую способность памяти в ближайшем послеродовом периоде по сравнению с поздним периодом жизни, что лежит в основе генетически измененных «doogie mice ». Подробный временной ход этого переключения в мозжечке человека был оценен с помощью микрочипа экспрессии и последовательности РНК и показан на рисунке справа.
Существует три гипотетических модели для описания этого механизма переключения:
Субъединицы GluN2B и GluN2A также играют разные роли в опосредовании эксайтотоксической гибели нейронов. Считается, что онтогенетический переключатель в составе субъединиц объясняет онтогенетические изменения нейротоксичности NMDA. Гомозиготное нарушение гена GluN2B у мышей вызывает перинатальную летальность, тогда как нарушение гена GluN2A дает жизнеспособных мышей, хотя и с нарушенной пластичностью гиппокампа. Одно исследование предполагает, что рилин может играть роль в созревании рецептора NMDA за счет увеличения подвижности субъединицы.
Гранулярные предшественники клеток (GCP) мозжечок после симметричного деления клеток во внешнем гранулярно-клеточном слое (EGL) мигрируют во внутренний слой гранулярных клеток (IGL), где они подавляют GluN2B и активируют GluN2C, процесс, который не зависит от передачи сигналов нейрегулина бета через ErbB2 и ErbB4. рецепторы.
Рецепторы NMDA были вовлечены в ряде исследований как сильно связанные с эксайтотоксичностью. Поскольку рецепторы NMDA играют важную роль в здоровье и функционировании нейронов, было много дискуссий о том, как эти рецепторы могут влиять как на выживание клеток, так и на гибель клеток. Последние данные подтверждают гипотезу о том, что чрезмерная стимуляция внесинаптических рецепторов NMDA имеет больше общего с эксайтотоксичностью, чем стимуляция их синаптических аналогов. Кроме того, хотя стимуляция внесинаптических рецепторов NMDA, по-видимому, способствует гибели клеток, есть данные, позволяющие предположить, что стимуляция синаптических рецепторов NMDA способствует здоровью и долголетию клетки. Существует достаточно доказательств, подтверждающих двойную природу рецепторов NMDA, основанную на местоположении, и гипотеза, объясняющая два различных механизма, известна как «гипотеза локализации».
По порядку Для подтверждения гипотезы локализации необходимо показать, что различные клеточные сигнальные пути активируются рецепторами NMDA в зависимости от их расположения в клеточной мембране. Эксперименты были разработаны для стимуляции исключительно синаптических или несинаптических рецепторов NMDA. Эти типы экспериментов показали, что различные пути активируются или регулируются в зависимости от местоположения источника сигнала. Многие из этих путей используют одни и те же белковые сигналы, но противоположно регулируются NMDAR в зависимости от их местоположения. Например, синаптическое возбуждение NMDA вызывает снижение внутриклеточной концентрации митоген-активированной протеинкиназы p38 (p38MAPK ). Внесинаптическая стимуляция. NMDAR регулируют p38MAPK противоположным образом, вызывая увеличение внутриклеточной концентрации. С тех пор эксперименты этого типа были повторены, и результаты показали, что эти различия охватывают многие пути, связанные с выживанием клеток и эксайтотоксичностью.
Два специфических белка были идентифицированы как главный путь, ответственный за эти разные клеточные ответы ERK1 / 2 и Иаков. ERK1 / 2 отвечает за фосфорилирование Якоба при возбуждении синаптическими NMDAR. Затем эта информация переносится в ядро . Фосфорилирование Якоба не происходит при внесинаптической стимуляции NMDA. Это позволяет факторам транскрипции в ядре реагировать по-разному в зависимости от состояния фосфорилирования Якоба.
рецепторы NMDA также связаны с синаптической пластичностью. Также изучалась идея о том, что как синаптические, так и внесинаптические рецепторы NMDA могут по-разному влиять на долгосрочную потенциацию (LTP) и долгосрочную депрессию (LTD). Экспериментальные данные предполагают, что внесинаптические рецепторы NMDA ингибируют LTP, продуцируя LTD. Ингибирование LTP можно предотвратить путем введения антагониста NMDA. Стимуляция тета-выброса, которая обычно индуцирует LTP с помощью синаптических NMDAR, при селективном применении к внесинаптическим NMDAR производит LTD. Эксперименты также показывают, что внесинаптическая активность не требуется для образования LTP. Кроме того, в экспрессии полной LTD участвуют как синаптические, так и внесинаптические.
Другим фактором, который, по-видимому, влияет на индуцированную NMDAR токсичность, является наблюдаемое изменение в субъединице макияж. Рецепторы NMDA представляют собой гетеротетрамеры с двумя субъединицами GluN1 и двумя вариабельными субъединицами. Было показано, что две из этих вариабельных субъединиц, GluN2A и GluN2B, предпочтительно приводят к каскадам выживания и гибели клеток соответственно. Хотя обе субъединицы обнаруживаются в синаптических и внесинаптических NMDAR, есть некоторые доказательства того, что субъединица GluN2B чаще встречается во внесинаптических рецепторах. Это наблюдение может помочь объяснить двойственную роль, которую рецепторы NMDA играют в эксайтотоксичности.
Несмотря на убедительные доказательства и относительную простоту этих двух теорий, работающих в тандеме, все еще существуют разногласия по поводу значимости этих утверждений. Некоторые проблемы при доказательстве этих теорий возникают из-за сложности использования фармакологических средств для определения подтипов конкретных NMDAR. Кроме того, теория субъединичной вариации не объясняет, как этот эффект может преобладать, поскольку широко распространено мнение, что наиболее распространенный тетрамер, состоящий из двух субъединиц GluN1 и одной из каждой субъединицы GluN2A и GluN2B, составляет высокий процент NMDAR..
Считалось, что эксайтотоксичность играет роль в дегенеративных свойствах нейродегенеративных состояний с конца 1950-х годов. Рецепторы NMDA, по-видимому, играют важную роль во многих из этих дегенеративных заболеваний, поражающих мозг. В частности, эксайтотоксические явления, связанные с рецепторами NMDA, были связаны с болезнью Альцгеймера и Хантингтона, а также с другими заболеваниями, такими как инсульты и эпилепсия. Однако лечение этих состояний одним из многих известных антагонистов рецепторов NMDA приводит к множеству нежелательных побочных эффектов, некоторые из которых могут быть серьезными. Эти побочные эффекты отчасти наблюдаются потому, что рецепторы NMDA не только сигнализируют о гибели клетки, но также играют важную роль в ее жизнеспособности. Лечение этих состояний можно найти в блокировании рецепторов NMDA, которых нет в синапсе. Один класс эксайтотоксичности при заболевании включает мутации с усилением функции в GRIN2B и GRIN1, связанные с корковыми пороками, такие как полимикрогирия.
 L-Глутаминовая кислота (глутамат), главный эндогенный агонист основного сайта NMDAR.
L-Глутаминовая кислота (глутамат), главный эндогенный агонист основного сайта NMDAR.  Глицин, главный эндогенный агонист сайта коагониста глицина NMDAR.
Глицин, главный эндогенный агонист сайта коагониста глицина NMDAR. Активация рецепторов NMDA требует связывания глутамата или аспартат (аспартат не так сильно стимулирует рецепторы). Кроме того, NMDAR также требует связывания коагониста глицина для эффективного открытия ионного канала, который является частью этого рецептора.
D-Серин, как было обнаружено, коагонизирует рецептор NMDA с даже большей эффективностью, чем глицин. Он продуцируется серинрацемазой и имеет те же области, что и рецепторы NMDA. Удаление D -серина может блокировать NMDA-опосредованную возбуждающую нейротрансмиссию во многих областях. Недавно было показано, что D -серин может высвобождаться как нейронами, так и астроцитами для регулирования рецепторов NMDA.
Опосредованные рецептором NMDA (NMDAR) токи напрямую связаны с деполяризацией мембраны. Следовательно, агонисты NMDA демонстрируют быструю кинетику разрыва связывания Mg, увеличивая вероятность открытия канала при деполяризации. Это свойство является фундаментальным для роли рецептора NMDA в памяти и обучении, и было высказано предположение, что этот канал является биохимическим субстратом обучения Хебба, где он может действовать как детектор совпадений для деполяризации мембраны и синаптической передачи.
Некоторые известные агонисты рецепторов NMDA включают:
Положительные аллостерические модуляторы 245>включают:
 Рисунок 6: Химическая структура нерамексана, производное мемантина второго поколения.
Рисунок 6: Химическая структура нерамексана, производное мемантина второго поколения. Примером производного мемантина является нерамексан, который был обнаружен путем изучения количества аминоалкил циклогексанов с мемантином в качестве матрицы в качестве антагонистов рецептора NMDA. Нерамексан, который можно увидеть на фигуре 6, связывается с тем же сайтом, что и мемантин, в канале, связанном с рецептором NMDA, и с сопоставимой аффинностью. Он также показывает очень похожую биодоступность и кинетику блокирования in vivo, как мемантин. Нерамексан прошел клинические испытания по четырем показаниям, включая болезнь Альцгеймера.
 N-метил- D -аспарагиновая кислота (NMDA), синтетический частичный агонист основного сайта NMDAR.
N-метил- D -аспарагиновая кислота (NMDA), синтетический частичный агонист основного сайта NMDAR. N-метил- D -аспарагиновая кислота (NMDA), в честь которой был назван рецептор NMDA, является частичным агонистом активный сайт или сайт распознавания глутамата.
3,5-Дибром- L -фенилаланин, встречающееся в природе галогенированное производное L-фенилаланина, является слабым частичным агонистом рецептора NMDA, действующим на сайт глицина. 3,5-Дибром- L -фенилаланин был предложен в качестве нового терапевтического лекарства-кандидата для лечения психоневрологических расстройств и заболеваний, таких как шизофрения, и неврологических расстройств, таких как ишемический инсульт. и эпилептические припадки.
Другие слабые частичные агонисты глицинового сайта рецептора NMDA, такие как рапастинел (GLYX-13) и апимостинел (NRX-1074) сейчас рассматриваются для разработки новых лекарств с антидепрессивным и обезболивающим действием без очевидной психотомиметической активности.
Положительные аллостерические модуляторы включают:
 Кетамин, синтетический общий анестетик и один из наиболее известных антагонистов NMDAR.
Кетамин, синтетический общий анестетик и один из наиболее известных антагонистов NMDAR. Антагонисты рецептора NMDA используются в качестве анестетиков для животных, а иногда и людей, и часто используются в качестве рекреационных наркотиков из-за их галлюциногенных свойств, в дополнение к их уникальным эффектам при повышенных дозах, таких как диссоциация. Когда определенные антагонисты рецепторов NMDA вводятся грызунам в больших дозах, они могут вызвать форму повреждения мозга, называемую поражением Олни. Антагонисты рецепторов NMDA, которые, как было показано, вызывают поражения Олни, включают кетамин, фенциклидин и декстрорфан (метаболит декстрометорфана ), как а также некоторые антагонисты рецепторов NMDA, используемые только в исследовательской среде. На данный момент опубликованные исследования поражений Олни неубедительны в отношении их появления в тканях мозга человека или обезьяны в отношении увеличения присутствия антагонистов рецепторов NMDA.
Большинство антагонистов NMDAR неконкурентоспособны или неконкурентные блокаторы поры канала, или являются антагонистами ко-регуляторного сайта глицина, а не антагонистами активного / глутаматного сайта.
Обычные агенты, в которых антагонизм к рецепторам NMDA является первичным или основным механизмом действия:
Некоторые распространенные агенты, у которых слабый антагонизм к рецепторам NMDA является вторичным или дополнительным действием, включают:
Рецептор NMDA регулируется посредством нитрозилирования и аминоадамантан можно использовать в качестве нацеленного на цель челнока, чтобы доставить оксид азота (NO) близко к участку внутри рецептора NMDA, где он может нитрозилировать и регулировать проводимость ионного канала. Донором NO, который можно использовать для снижения активности рецептора NMDA, является алкилнитрат нитроглицерин. В отличие от многих других доноров NO, алкилнитраты не обладают потенциальными связанными с NO нейротоксическими эффектами. Алкилнитраты отдают NO в форме нитрогруппы, как показано на рисунке 7, -NO 2 -, который является безопасным донором, который избегает нейротоксичности. Нитрогруппа должна быть нацелена на рецептор NMDA, иначе могут возникнуть другие эффекты NO, такие как расширение кровеносных сосудов и, как следствие, гипотензия. Нитромемантин является производным мемантина второго поколения, он снижает эксайтотоксичность, опосредованную чрезмерной активацией глутаматергической системы, путем блокирования рецептора NMDA без ущерба для безопасности. Предварительные исследования на животных моделях показывают, что нитромемантины более эффективны, чем мемантин в качестве нейропротекторов, как in vitro, так и in vivo. Мемантин и более новые производные могут стать очень важным оружием в борьбе с повреждением нейронов.
 Рисунок 7: Нитроглицерин жертвует ONO 2 группой, которая приводит к аналогу мемантина второго поколения, нитромемантину.
Рисунок 7: Нитроглицерин жертвует ONO 2 группой, которая приводит к аналогу мемантина второго поколения, нитромемантину. Отрицательный результат. аллостерические модуляторы включают:
Рецептор NMDA модулируется рядом эндогенных и экзогенных соединений:
Основная проблема с разработкой антагонистов NMDA для нейрозащиты состоит в том, что физиологическая активность рецептора NMDA важна для нормальной функции нейронов. Полная блокада активности всех рецепторов NMDA приводит к побочным эффектам, таким как галлюцинации, возбуждение и анестезия. Чтобы быть клинически значимым, антагонист рецептора NMDA должен ограничивать свое действие блокадой чрезмерной активации, не ограничивая нормальную функцию рецептора. На рисунке 3 показаны упрощенные модели различных типов антагонистов рецептора NMDA, которые будут обсуждаться далее.
Конкурентные антагонисты рецепторов NMDA, которые были разработаны первыми, не являются хорошим вариантом, поскольку они конкурируют и связываются с тем же участком (субъединицей NR2) рецептора, что и агонист, глутамат и, следовательно, также блокируют нормальную функцию. Они будут блокировать здоровые области мозга до того, как окажут воздействие на патологические области, потому что здоровые области содержат более низкие уровни агониста, чем патологические области. Эти антагонисты могут быть вытеснены из рецептора высокой концентрацией глутамата, который может существовать в эксайтотоксических условиях.
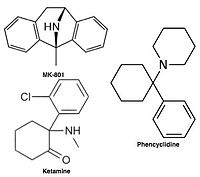 Рисунок 4: Химические структуры MK-801, фенциклидина и кетамина, высокоаффинные неконкурентные антагонисты рецептора NMDA.
Рисунок 4: Химические структуры MK-801, фенциклидина и кетамина, высокоаффинные неконкурентные антагонисты рецептора NMDA. Неконкурентоспособные антагонисты рецептора NMDA блокируют внутри ионного канала на участке Mg (область поры) и предотвращают чрезмерный приток Ca. Неконкурентный антагонизм относится к типу блока, который не может преодолеть повышенная концентрация глутамата, и зависит от предшествующей активации рецептора агонистом, т. Е. Он попадает в канал только тогда, когда он открывается агонистом.
 Рисунок 5: Химические структуры мемантина (справа) и амантадина (слева).
Рисунок 5: Химические структуры мемантина (справа) и амантадина (слева). Из-за этих неблагоприятных побочных эффектов высокоаффинных блокаторов поиск клинически эффективных антагонистов рецепторов NMDA для нейродегенеративных заболеваний продолжался и сосредоточился на разработке блокаторов с низким сродством. Однако сродство не может быть слишком низким, а время пребывания не слишком коротким (как видно на примере Mg), когда деполяризация мембраны снимает блок. Таким образом, открытием стало развитие неконкурентоспособного антагониста с более длительным временем пребывания в канале, чем Mg, но более коротким, чем MK-801. Таким образом, полученное лекарство будет блокировать только чрезмерно открытые каналы, связанные с рецептором NMDA, но не нормальную нейротрансмиссию. Мемантин - это лекарство. Это производное амантадина, который сначала был противогриппозным средством, но позже по совпадению было обнаружено, что он эффективен при болезни Паркинсона. Химические структуры мемантина и амантадина можно увидеть на рисунке 5. Сначала считалось, что соединение является дофаминергическим или холинолитическим, но позже было обнаружено, что оно является антагонистом рецептора NMDA.
Мемантин - первый препарат, одобренный для лечения тяжелых и более запущенных болезни Альцгеймера, от которой, например, антихолинергические препараты малоэффективны. Это помогает восстановить синаптическую функцию и, таким образом, улучшает нарушенную память и обучение. В 2015 году мемантин также проходит испытания на предмет терапевтического значения при других неврологических расстройствах.
Многие производные мемантина второго поколения находятся в стадии разработки, которые могут показать даже лучшие нейропротекторные эффекты, где основная мысль заключается в использовании других безопасных, но эффективных модуляторные сайты на рецепторе NMDA в дополнение к связанному с ним ионному каналу.
 Рисунок 8: Взаимосвязь структурной активности (SAR) амантадина и родственных соединений
Рисунок 8: Взаимосвязь структурной активности (SAR) амантадина и родственных соединений Мемантин (1-амино-3,5-диметиладамантан) представляет собой производное аминоалкилциклогексана и атипичное лекарственное соединение с неплоской трехмерной трициклической структурой. На рис. 8 показана SAR для производного аминоалкилциклогексана. Мемантин имеет несколько важных особенностей в своей структуре, обеспечивающих его эффективность:
Несмотря на небольшое структурное различие между мемантином и амантадином, двумя производными адамантана, сродство к сайту связывания субъединицы NR1 / NR2B намного больше для мемантина. В измерениях патч-зажим мемантин имеет IC50 (2,3 + 0,3) мкМ, в то время как амантадин имеет IC 50 (71,0 + 11,1) мкМ. Сайт связывания с наивысшим сродством называется доминантным сайтом связывания. Он включает связь между аминогруппой мемантина и связывающим карманом NR1-N161 субъединицы NR1 / NR2B. Боковые метильные группы играют важную роль в увеличении сродства к открытым каналам рецептора NMDA и делают его гораздо лучшим нейрозащитным препаратом, чем амантадин. Считается, что связывающие карманы для метильных групп находятся в NR1-A645 и NR2B-A644 в NR1 / NR2B. Карманы связывания показаны на фиг. 2. Мемантин связывается на участке Mg или рядом с ним внутри канала, связанного с рецептором NMDA. Группа -NH 2 на мемантине, которая протонируется при физиологическом pH тела, представляет собой область, которая связывается на сайте Mg или рядом с ним. Добавление двух метильных групп к -N в структуре мемантина показало снижение аффинности, давая значение IC 50 (28,4 + 1,4) мкМ.
Несколько производных нитромемантина, производного мемантина второго поколения, были синтезированы для того, чтобы получить подробную взаимосвязь структурной активности (SAR) этих новых лекарственных средств. Один класс, содержащий нитро (NO 2) группу, противоположную амину-плацдарму (NH 2), показал многообещающий результат. Нитромемантин использует сайт связывания мемантина на рецепторе NMDA для нацеливания на группу NO x (X = 1 или 2) для взаимодействия с сайтом S-нитрозилирования / окислительно-восстановительного потенциала, внешним по отношению к сайту связывания мемантина. Удлинение боковых цепей мемантина компенсирует худшее сродство к лекарственному средству в канале, связанное с добавлением группы –ONO 2
Предполагается, что эксайтотоксичность вовлечены в некоторые нейродегенеративные расстройства, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз. Следовательно, блокирование рецепторов NMDA могло бы теоретически быть полезным при лечении таких заболеваний. Однако важно сохранить физиологическую активность рецептора NMDA, пытаясь блокировать его чрезмерную эксайтотоксическую активность. Это может быть достигнуто с помощью неконкурентоспособных антагонистов, блокирующих ионный канал рецепторов, когда он чрезмерно открыт.
Мемантин является примером неконкурентоспособного антагониста рецептора NMDA, который имеет одобренные показания для нейродегенеративного заболевания болезни Альцгеймера. В 2015 году мемантин все еще проходит клинические испытания для лечения других неврологических заболеваний.
Рецептор NMDA - это неспецифический катионный канал, который может обеспечивать прохождение Са и Na в клетку и К. из клетки. Возбуждающий постсинаптический потенциал (ВПСП), продуцируемый активацией рецептора NMDA, увеличивает концентрацию Са в клетке. Ca, в свою очередь, может функционировать как второй мессенджер в различных сигнальных путях. Однако катионный канал рецептора NMDA блокируется Mg при мембранном потенциале покоя. Разблокировка магнием не происходит мгновенно, чтобы разблокировать все доступные каналы, постсинаптическая клетка должна быть деполяризована на достаточно длительный период времени (в миллисекундах).
Следовательно, рецептор NMDA функционирует как «молекулярный детектор совпадений ". Его ионный канал открывается только при соблюдении следующих двух условий: глутамат связан с рецептором, а постсинаптическая клетка деполяризуется (что удаляет Mg, блокирующий канал). Это свойство рецептора NMDA объясняет многие аспекты долгосрочной потенциации (LTP) и синаптической пластичности.
Рецепторы NMDA модулируются рядом эндогенных и экзогенных соединений и играют ключевую роль в широкий диапазон физиологических (например, память ) и патологических процессов (например, эксайтотоксичность ).
Антагонисты NMDAR, такие как кетамин, эскетамин, тилетамин, фенциклидин, закись азота и ксенон используются в качестве общих анестетиков. Эти и аналогичные препараты, такие как декстрометорфан и метоксетамин, также вызывают диссоциативный, галлюциногенный и эйфориантный эффекты и используются в качестве рекреационных наркотиков.
ингибиторов NMDAR, включая кетамин, эскетамин (JNJ-54135419), рапастинел (GLYX-13), апимостинел (NRX -1074), 4-хлорокинуренин (AV-101) и рисленемдаз (CERC-301, MK-0657) находятся в стадии разработки для лечения расстройств настроения, включая большое депрессивное расстройство и устойчивую к лечению депрессию. Кроме того, кетамин уже используется для этой цели в качестве терапии не по назначению в некоторых клиниках.
Исследования показывают, что тианептин оказывает антидепрессивный эффект за счет непрямого изменения и ингибирования активности и высвобождения рецептора глутамата. из BDNF, что, в свою очередь, влияет на нервную пластичность. Тианептин также действует на рецепторы NMDA и AMPA. В моделях на животных тианептин подавляет вызванные патологическим стрессом изменения глутаматергической нейротрансмиссии в миндалевидном теле и гиппокампе.
Мемантин, антагонист NMDAR с низким улавливанием, одобрен в США и Европе для лечения болезни Альцгеймера от средней до тяжелой степени, и в настоящее время получили ограниченную рекомендацию Национального института здравоохранения и качества ухода Великобритании для пациентов, у которых другие варианты лечения не подходят.
Cochlear NMDAR являются целью интенсивных исследований для поиска фармакологических решений для лечения тиннитус. NMDAR связаны с редким аутоиммунным заболеванием, энцефалитом против рецепторов NMDA (также известным как энцефалит NMDAR), которое обычно возникает из-за перекрестной реактивности антител, вырабатываемых иммунной системой против эктопические ткани головного мозга, такие как обнаруженные в тератоме. Они известны как антитела против рецептора глутамата.
По сравнению с дофаминергическими стимуляторами, такими как метамфетамин, антагонист NMDAR фенциклидин может продуцировать более широкий диапазон симптомы, напоминающие шизофрению у здоровых добровольцев, что привело к глутаматной гипотезе шизофрении. Эксперименты, в которых грызунов лечат антагонистами рецепторов NMDA, сегодня являются наиболее распространенной моделью, когда дело доходит до тестирования новых методов лечения шизофрении или изучения точного механизма препаратов, уже одобренных для лечения шизофрении.
антагонисты NMDAR, например, элипродил, дальстинел, ликостинел и selfotel, были тщательно исследованы для лечения. опосредованной эксайтотоксичностью нейротоксичностью в таких ситуациях, как ишемический инсульт и черепно-мозговая травма, но безуспешно в клинических испытаниях используется в малых дозах, чтобы избежать седативного эффекта, но антагонисты NMDAR могут блокировать распространение деполяризации у животных и пациентов с травмой головного мозга. Это использование еще не проходило клинических испытаний.