Обнаружение совпадений в контексте нейробиологии - это процесс, с помощью которого нейрон или нейронная схема может кодировать информацию, обнаруживая появление близких по времени, но пространственно распределенных входных сигналов. Детекторы совпадений влияют на обработку нейронной информации, уменьшая временной джиттер, уменьшая спонтанную активность и формируя ассоциации между отдельными нейронными событиями. Эта концепция привела к большему пониманию нейронных процессов и формированию вычислительных карт в мозге.
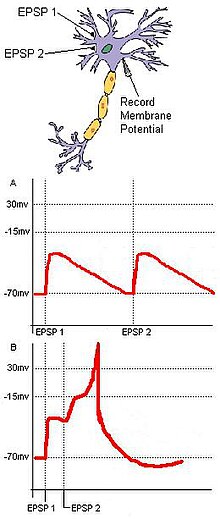 Рис. 1: Два ВПСП, иннервируемых в быстрой последовательности, суммируются, чтобы произвести больший ВПСП или даже потенциал действия в постсинаптической клетке.
Рис. 1: Два ВПСП, иннервируемых в быстрой последовательности, суммируются, чтобы произвести больший ВПСП или даже потенциал действия в постсинаптической клетке. Обнаружение совпадений основывается на отдельных входах, сходящихся на общей цели. Рассмотрим базовую нейронную цепь с двумя входными нейронами, A и B, которые имеют возбуждающие синаптические терминалы, сходящиеся на одном выходном нейроне C (рис. 1). Если EPSP каждого входного нейрона является подпороговым для потенциала действия в точке C, то C не сработает, если два входа от A и B не будут во времени близки друг к другу. Синхронное поступление этих двух входов может подтолкнуть мембранный потенциал целевого нейрона выше порога, необходимого для создания потенциала действия. Если два входа прибывают слишком далеко друг от друга, деполяризация первого входа может иметь время значительно снизиться, не позволяя мембранному потенциалу целевого нейрона достичь порога потенциала действия. В этом примере используются принципы пространственного и временного суммирования. Кроме того, обнаружение совпадений может уменьшить дрожание, вызванное спонтанной активностью. В то время как случайные подпороговые стимуляции нейронными клетками не часто могут срабатывать случайно, совпадающие синаптические входы, полученные от единого внешнего стимула, будут гарантировать, что целевой нейрон срабатывает в результате стимула.
Вышеприведенное описание хорошо применимо к входным сигналам с прямой связью в нейроны, которые обеспечивают входные данные либо от сенсорных нервов, либо от низкоуровневых областей мозга. Однако около 90% межнейронных связей носят не прямой, а прогнозирующий (или модулирующий, или привлекающий внимание) характер. Эти соединения получают входные данные в основном от соседних ячеек в том же слое, что и принимающая ячейка, а также от удаленных подключений, которые проходят через Уровень 1. Дендриты, которые получают эти входные данные, довольно удалены от тела ячейки, и поэтому они демонстрируют разные электрические и поведение обработки сигналов по сравнению с проксимальными (или прямолинейными) дендритами, описанными выше.
На коротком участке (возможно, 40 мкм длиной) дистального дендрита реакция на активацию, поступающую через синапсы в дендритные шипы, увеличивает общий локальный потенциал с каждым входящим сигналом. Этот растущий потенциал действует на фоне спада потенциала обратно на уровень покоя. Если достаточное количество сигналов получено в течение короткого периода времени (то есть до того, как общее напряжение упадет до фонового значения), напряжение сегмента поднимется выше порогового значения, вызывая нелинейный дендритный всплеск, который распространяется, фактически не уменьшаясь, все путь к телу клетки, что приводит к его частичной деполяризации.
Это, пожалуй, самая важная форма обнаружения совпадений дендритов в мозге. Более понятная проксимальная активация действует в течение гораздо более длительных периодов времени и, таким образом, гораздо менее чувствительна к временному фактору при обнаружении совпадений.
 Рис. 2: Если звук поступает в левое ухо перед правым ухом, импульс в левом слуховом тракте достигнет X раньше, чем импульс в правом слуховом тракте достигнет Y. Следовательно, нейроны 4 или 5 могут получать совпадающие входные сигналы.
Рис. 2: Если звук поступает в левое ухо перед правым ухом, импульс в левом слуховом тракте достигнет X раньше, чем импульс в правом слуховом тракте достигнет Y. Следовательно, нейроны 4 или 5 могут получать совпадающие входные сигналы. Было показано, что обнаружение совпадений является основным фактором локализации звука вдоль плоскости азимута у нескольких организмов. В 1948 году Ллойд А. Джеффресс предположил, что некоторые организмы могут иметь набор нейронов, которые получают слуховой сигнал от каждого уха. Нейронные пути к этим нейронам называются линиями задержки. Джеффресс утверждал, что нейроны, с которыми связаны линии задержки, действуют как детекторы совпадений, максимально срабатывая при получении одновременных сигналов от обоих ушей. Когда звук слышен, звуковые волны могут достигать ушей в разное время. Это называется межуральной разницей во времени (ITD). Из-за разной длины и конечной скорости проводимости в аксонах линий задержки разные нейроны детектора совпадений срабатывают, когда звук исходит из разных положений по азимуту. Модель Джеффресса предполагает, что два сигнала даже от асинхронного поступления звука в улитку каждого уха будут синхронно сходиться на детекторе совпадений в слуховой коре в зависимости от величины ITD (рис. 2). Следовательно, ITD должен соответствовать анатомической карте, которую можно найти в головном мозге. Исследование Масакадзу Кониси о сипухах показывает, что это правда. Сенсорная информация от волосковых клеток ушей перемещается к ипсилатеральному магноцеллюлярному ядру. Отсюда сигналы проецируются ипсилатерально и контралатерально к двум ламинарным ядрам. Каждое ламинарное ядро содержит детекторы совпадений, которые получают слуховой сигнал от левого и правого уха. Поскольку ипсилатеральные аксоны входят в ламинарное ядро дорсально, а контралатеральные аксоны входят вентрально, звуки из разных положений по азимуту напрямую соответствуют стимуляции ламинарного ядра разной глубины. На основе этой информации была сформирована нейронная карта слухового пространства. Функция ламинарного ядра аналогична функции медиальной верхней оливы у млекопитающих.
В 1949 году Дональд Хебб постулировал что синаптическая эффективность будет увеличиваться за счет многократной и постоянной стимуляции постсинаптической клетки пресинаптической клеткой. Это часто неофициально называют «ячейки, которые срабатывают вместе, соединяются вместе». Теория была частично подтверждена открытием долгосрочного потенцирования. Исследования LTP на множественных пресинаптических клетках, стимулирующих постсинаптическую клетку, выявили свойство ассоциативности. Слабая нейрональная стимуляция пирамидного нейрона может не вызывать долговременной потенциации. Однако эта же стимуляция в сочетании с одновременной сильной стимуляцией от другого нейрона усилит оба синапса. Этот процесс предполагает, что два нейрональных пути, сходящиеся к одной и той же клетке, могут усилиться, если стимулировать их случайно.
LTP в гиппокампе требует длительной деполяризации, которая может вытеснить Mg-блок постсинаптических рецепторов NMDA. Удаление Mg-блока позволяет Ca поступать в ячейку. Большое повышение уровня кальция активирует протеинкиназы, что в конечном итоге увеличивает количество постсинаптических рецепторов AMPA. Это увеличивает чувствительность постсинаптической клетки к глутамату. В результате укрепляются оба синапса. Длительная деполяризация, необходимая для изгнания Mg из рецепторов NMDA, требует высокочастотной стимуляции. Ассоциативность становится фактором, потому что это может быть достигнуто за счет двух одновременных входов, которые могут быть недостаточно сильными, чтобы активировать LTP сами по себе.
Помимо процессов, основанных на NMDA-рецепторах, дополнительные клеточные механизмы позволяют установить связь между двумя разными входными сигналами, сходящимися на одном и том же нейроне, в определенный период времени. При одновременном повышении внутриклеточных концентраций цАМФ и Са активируется коактиватор транскрипции под названием TORC1 (CRTC1 ), который преобразует временное совпадение двух вторых мессенджеров в долгосрочные изменения. например LTP. Этот клеточный механизм через кальций-зависимую активацию аденилатциклазы может также учитывать обнаружение повторяющейся стимуляции данного синапса.
аденилатциклазы (также известной как аденилциклаза и аденилатциклаза ) участвует в формировании памяти как детектор совпадений
Длительная депрессия также работает через ассоциативную properties, хотя это не всегда процесс, обратный LTP. LTD в мозжечке требует одновременной стимуляции параллельных волокон и лазящих волокон. Глутамат, высвобождаемый из параллельных волокон, активирует рецепторы AMPA, которые деполяризуют постсинаптическую клетку. Параллельные волокна также активируют метаботропные рецепторы глутамата, которые высвобождают вторичные мессенджеры IP 3 и DAG. Волокна для лазания при активации стимулируют значительное повышение постсинаптического уровня кальция. Са, IP3 и DAG работают вместе в пути передачи сигнала для интернализации рецепторов AMPA и снижения чувствительности постсинаптических клеток к глутамату.