| |
| Клинические данные | |
|---|---|
| Другие названия | Кетобемидон, Клирадон, Цимидон, Кетоган, Кеторакс |
| AHFS / Drugs.com | Международные названия лекарств |
| Пути введения. | Пероральный, ректальный, внутривенный |
| код ATC | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Биодоступность | 34∼40% (перорально), 44% (ректально) |
| Период полувыведения | 2–4 часа |
| Продолжительность действия | 3 –5 часов |
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL |
|
| CompTox Dashboard (EPA ) | |
| ECHA InfoCard | 100.006.748 |
| Химические и физические данные a | |
| Формула | C15H21NO2 |
| Молярная масса | 247,338 г · моль |
| 3D-модель (JSmol ) | |
SMILES
| |
InChI
| |
| (что это?) | |
Кетобемидон, продаваемый, среди прочего, под торговой маркой Кетоган, является сильным синтетическим опиоидом обезболивающим. Его эффективность против боли находится в том же диапазоне, что и у морфина, и он также обладает некоторыми свойствами NMDA -антагониста, частично обусловленными его метаболитом норкетобемидоном. Это может сделать его полезным при некоторых типах боли, которые плохо поддаются лечению другими опиоидами. Он продается в Дании, Исландии, Норвегии и Швеции и используется при сильной боли.
Кетобемидон был впервые синтезирован в 1942 году Эйслебом и его коллегами в лаборатория ИГ Farbenindustrie в Хёхсте во время Второй мировой войны. Первое его исследование на людях было опубликовано в 1946 году, и вскоре после этого оно было внедрено в клиническую медицину. Он не использовался в клинических условиях в Соединенных Штатах, когда был обнародован Закон о контролируемых веществах 1970 г. и был отнесен к Списку I с ACSCN 9628. По состоянию на 2013 год DEA не назначало годовой производственной квоты.
Pfizer производит кетобемидон под торговыми марками Ketogan и Ketorax. Он доступен в виде таблеток, суппозиториев и жидкости для инъекций. В некоторых странах существует препарат с замедленным высвобождением, продаваемый как Ketodur, содержащий 10 или 25 мг кетобемидона.
Эксперименты на бывших наркоманах показали, что он вызывает сильное привыкание и в высоких дозах, по сравнению с другими опиоидами, может увеличивать потенциал злоупотребления у бывших и нынешних наркоманов. Хотя сначала были предложены некоторые усилия для разработки резолюции, призывающей правительства прекратить производство и использование кетобемидона. Этот результат не согласуется с клиническими наблюдениями, и другое исследование, проведенное в 1958 году, не показало, что он вызывает большую зависимость, чем морфин. В этом исследовании было замечено, что в то время как для морфина доза для эйфории такая же, как для обезболивания, для кетобемидона анальгетическая доза была значительно ниже эйфорической. Таким образом, даже по сравнению с морфином кетобемидон может быть гораздо более эффективным, не вызывая значительной эйфории, и это снижает риск привыкания под наблюдением или квалифицированным врачом. Кетобемидон в основном используется в скандинавских странах, причем Дания возглавляет статистику.
Обезболивание после 5-10 мг перорально или 5-7,5 мг внутривенно длится 3–5 часов. Кетобемидон также доступен в виде препаратов с спазмолитическим действием, которые могут улучшить анальгезию.
Кетобемидон в основном метаболизируется путем конъюгации фенольной гидроксильной группы и N-деметилирования. Только около 13-24% выводится без изменений после внутривенного введения.
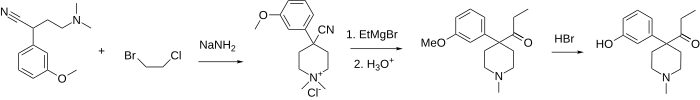
Кетобемидон представляет собой 1-метил-4- (3-гидроксифенил) -4-пропионилпиперидин. Обычно он доступен в виде гидрохлорида, который представляет собой белый порошок. Его синтезируют путем алкилирования (3-метоксифенил) ацетонитрила бис (2-хлорэтил) метиламином с последующей реакцией с этилмагнийбромидом и, наконец, O-деметилированием с бромистоводородной кислотой..
Из-за сильной пузырьковой природы бис (2-хлорэтил) метиламина существует множество других способов получения кетобемидона. Путь, изображенный ниже, заключается в первом алкилировании того же (3-метоксифенил) ацетонитрила 2-хлор-N, N-диметилэтиламином или 2-хлор-N-бензил-N-метилэтиламином. Затем эти амины еще раз алкилируют с использованием смешанного 1-бром-2-хлорэтана, таким образом завершая пиперидиновое кольцо и получая соль четвертичного аммония, которую можно декватернизовать с помощью соли тиофенола (для N, N-диметиламмония) или каталитического гидрирования ( для обоих соединений) в общий 4- (3-метоксифенил) -4-циано-1-метилпиперидин. Последний дает кетобемидон после реакции Гриньяра с этилмагнийбромидом и расщепления эфиром.