| Лечение болезни Паркинсона | |
|---|---|
| Специальность | неврология |
| [ редактировать в Викиданных ] | |
Для лечения болезни Паркинсона из-за хронической природы болезни Паркинсона (БП) необходима обширная программа, которая включает обучение пациентов и членов их семей, услуги групп поддержки, общее поддержание здоровья, упражнения и питание. В настоящее время не известно лекарства от этой болезни, но лекарства или хирургическое вмешательство могут облегчить симптомы.
Хотя болезнь Паркинсона лечатся многими лекарствами, на самом деле ни одно из них не устраняет последствия болезни. Кроме того, золотой стандарт лечения зависит от состояния болезни. Поэтому людям с болезнью Паркинсона часто необходимо принимать различные лекарства для лечения симптомов болезни. Несколько лекарств, которые в настоящее время разрабатываются, стремятся лучше справиться с двигательными колебаниями и немоторными симптомами БП. Однако на рынке еще нет специального одобренного препарата для лечения болезни Паркинсона.
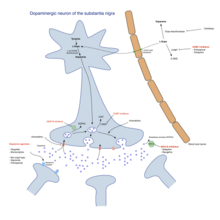 Фармакологическое лечение болезни Паркинсона
Фармакологическое лечение болезни Паркинсона Основным семейством лекарств, полезных для лечения двигательных симптомов, являются леводопа, агонисты дофамина и ингибиторы МАО-В. Наиболее часто используемый подход к лечению варьируется в зависимости от стадии заболевания. Обычно различают две фазы: начальную фазу, на которой у человека с БП уже развился какой-либо недостаток, в связи с которым он или она нуждается в медикаментозном лечении, и вторую стадию, на которой у пациента развиваются двигательные осложнения, связанные с применением леводопы. Лечение в исходном состоянии направлено на достижение оптимального компромисса между хорошим лечением симптомов и побочными эффектами, возникающими в результате усиления дофаминергической функции. Начало лечения L-ДОФА может быть отложено за счет использования других лекарств, таких как ингибиторы МАО-В и агонисты дофамина, в надежде замедлить наступление дискинезий. На втором этапе цель состоит в том, чтобы уменьшить симптомы, одновременно контролируя колебания реакции на лекарства. Внезапный отказ от лекарств и чрезмерное их употребление некоторыми пациентами также необходимо контролировать. Когда лекарств недостаточно для контроля симптомов, хирургические методы, такие как глубокая стимуляция мозга, могут облегчить связанные с ними двигательные расстройства.
 Сталево, коммерческий препарат, сочетающий энтакапон, леводопу и карбидопу для лечения болезни Паркинсона.
Сталево, коммерческий препарат, сочетающий энтакапон, леводопу и карбидопу для лечения болезни Паркинсона.  Цепи базальных ганглиев при лечении болезни Паркинсона - модель влияния лекарств на двигательные симптомы: леводопа, агонисты дофамина и ингибиторы МАО-B стимулируют возбуждающие сигналы от таламуса к коре, воздействуя на полосатое тело, компенсируя снижение дофаминергических сигналов. из черной субстанции (видно внизу справа).
Цепи базальных ганглиев при лечении болезни Паркинсона - модель влияния лекарств на двигательные симптомы: леводопа, агонисты дофамина и ингибиторы МАО-B стимулируют возбуждающие сигналы от таламуса к коре, воздействуя на полосатое тело, компенсируя снижение дофаминергических сигналов. из черной субстанции (видно внизу справа). Леводопа (или L-ДОПА ) является наиболее широко используемым лечением более 30 лет. L-ДОФА превращается в дофамин в дофаминергических нейронах под действием допа-декарбоксилазы. Поскольку двигательные симптомы вызваны недостатком дофамина в черной субстанции, введение L-дофа временно уменьшает двигательную симптоматику.
Только 5–10% L-ДОФА проникает через гематоэнцефалический барьер. Остальная часть часто метаболизируется до дофамина в другом месте, вызывая широкий спектр побочных эффектов, включая тошноту, дискинезию и скованность. Карбидопа и бенсеразид являются периферическими ингибиторами допа-декарбоксилазы. Они ингибируют метаболизм L-DOPA на периферии, тем самым увеличивая доставку леводопы в центральную нервную систему. Обычно их назначают в виде комбинированных препаратов с леводопой. Существующие препараты представляют собой карбидопа / леводопа (co-Careldopa, торговые названия Sinemet, Pharmacopa, Atamet) и бенсеразид / леводопа (co-beneldopa, торговое название Madopar). Леводопа также была связана с синдромом дисрегуляции дофамина, который представляет собой компульсивное чрезмерное употребление лекарства и пандинг.
Контролируемые версии Sinemet и Madopar с медленным высвобождением усиливают эффект леводопы. Дуодопа - это комбинация леводопы и карбидопы. Препараты леводопы с медленным высвобождением не показали усиленного контроля моторных симптомов или двигательных осложнений по сравнению с препаратами с немедленным высвобождением.
Толкапон подавляет фермент катехол-О-метилтрансферазу ( СОМТ ), который расщепляет дофамин и левадопа, тем самым продлевая терапевтические эффекты леводопы. Он, наряду с ингибиторами периферической допа-декарбоксилазы, использовался в качестве дополнения к леводопе. Однако из-за возможных побочных эффектов, таких как печеночная недостаточность, его доступность ограничена. Подобный препарат, энтакапон, не вызывает значительных изменений функции печени и поддерживает адекватное ингибирование СОМТ с течением времени. Энтакапон доступен для лечения отдельно (КОМТан) или в сочетании с карбидопой и леводопой ( Сталево ).
Леводопа приводит к снижению эндогенного образования L-DOPA и в конечном итоге становится контрпродуктивным. Препараты леводопы в долгосрочной перспективе приводят к развитию двигательных осложнений, характеризующихся непроизвольными движениями, называемыми дискинезиями, и колебаниями реакции на лекарства. Когда это происходит, пациенты с БП быстро переходят от стадий с хорошей реакцией на лекарства и небольшим количеством симптомов (состояние «включено») к фазам без ответа на лекарства и важных двигательных симптомов (состояние «выключено»). По этой причине дозы леводопы сохраняются как можно более низкими при сохранении функциональности. Отсрочка начала допатерапии с использованием альтернатив на некоторое время также является обычной практикой. Прежняя стратегия уменьшения двигательных осложнений заключалась в отказе пациентов от L-DOPA на некоторое время. Сейчас это не рекомендуется, так как может вызвать опасные побочные эффекты, такие как злокачественный нейролептический синдром. Большинству людей в конечном итоге требуется леводопа, и позже у них развиваются двигательные осложнения.
Феномен включения-выключения является почти неизменным следствием длительного лечения леводопой у пациентов с болезнью Паркинсона. Фазы неподвижности и нетрудоспособности, связанные с депрессией, сменяются ликующими оттепелями. В его патогенез вовлечены как фармакокинетические, так и фармакодинамические факторы, но представлены доказательства, указывающие на то, что важность обращения с леводопой недооценивается, и прогрессивное снижение емкости выживших нигростриатных дофаминовых окончаний не является критическим фактором. Перераспределение доз леводопы, которое может означать меньшие, более частые дозы или большие и менее частые приращения, может быть полезным для контроля колебаний у некоторых пациентов. Ограничение диетического белка и использование селегилина гидрохлорида и бромокриптина также могут временно улучшить двигательные колебания. Новые подходы к лечению включают использование подкожного апоморфина, препаратов леводопы с контролируемым высвобождением с периферическим ингибитором допа-декарбоксилазы и непрерывное интрадуоденальное введение леводопы.
На животных моделях было показано, что прием антагонистов аденозиновых рецепторов вместе с леводопой может усилить его терапевтические эффекты.
Агонисты дофамина в головном мозге действуют аналогично леводопе, поскольку они связываются с дофаминергическими постсинаптическими рецепторами. Агонисты дофамина первоначально использовались для пациентов с колебаниями включения-выключения и дискинезиями в качестве дополнительной терапии к леводопе, но теперь они в основном используются самостоятельно в качестве начальной терапии двигательных симптомов с целью отсрочить двигательные осложнения. При использовании на поздних стадиях БП они полезны для сокращения периодов отключения. Агонисты дофамина включают бромокриптин, перголид, прамипексол, Ropinirole, Пирибедила, каберголину, апоморфина и лизурид.
Агонисты вызывают значительные, хотя и легкие, побочные эффекты, включая сонливость, галлюцинации, бессонницу, тошноту и запор. Иногда побочные эффекты проявляются даже при минимальной клинически эффективной дозе, что заставляет врача искать другой агонист или вид лекарства. По сравнению с леводопой, они задерживают двигательные осложнения, но контролируют более тяжелые симптомы. Тем не менее, они обычно достаточно эффективны для лечения симптомов в первые годы. К тому же они дороже. Дискинезии, вызванные агонистами дофамина, редко возникают у молодых пациентов, но наряду с другими побочными эффектами чаще встречаются у пожилых пациентов. Все это привело к тому, что агонисты стали предпочтительным начальным лечением для первого, по сравнению с леводопой для последнего. Агонисты в более высоких дозах также связаны с широким спектром нарушений контроля над импульсами.
Апоморфин, который является агонистом дофамина, который не вводится перорально, может использоваться для уменьшения периодов перерыва и дискинезии на поздних стадиях болезни Паркинсона. Поскольку вторичные эффекты, такие как спутанность сознания и галлюцинации, не редкость, пациенты, принимающие апоморфин, должны находиться под тщательным наблюдением. Апоморфин можно вводить подкожно с помощью небольшого насоса, который носит на себе пациент. Низкая доза вводится автоматически в течение дня, уменьшая колебания двигательных симптомов, обеспечивая стабильную дозу дофаминергической стимуляции. После первоначальной «провокации апоморфином» в больнице для проверки его эффективности и краткого инструктажа пациента и основного лица, осуществляющего уход (часто супруга или партнера), последний из которых берет на себя обслуживание помпы. Место инъекции необходимо менять ежедневно и вращать вокруг тела, чтобы избежать образования узелков. Апоморфин также доступен в более острой дозе в виде автоинъектора- ручки для экстренной дозы, например, после падения или первым делом утром. Часто наблюдаются тошнота и рвота; может потребоваться домперидон (противорвотное средство).
В исследовании, оценивающем эффективность агонистов дофамина по сравнению с леводопой, результаты показали, что пациенты, принимавшие агонисты дофамина, с меньшей вероятностью имели дискинезию, дистонию и двигательные колебания, хотя с большей вероятностью прервали терапию из-за негативных побочных эффектов, таких как тошнота и т. отеки, запоры и др.
Ингибиторы моноаминоксидазы ( селегилин и разагилин ) повышают уровень дофамина в базальных ганглиях, блокируя его метаболизм. Они ингибируют моноаминоксидазу-B (MAO-B), которая расщепляет дофамин, секретируемый дофаминергическими нейронами. Следовательно, уменьшение МАО-В приводит к увеличению количества L-ДОФА в полосатом теле. Подобно агонистам дофамина, ингибиторы МАО-В улучшают двигательные симптомы и отсрочивают необходимость приема леводопы при использовании в качестве монотерапии на первых стадиях заболевания, но вызывают больше побочных эффектов и менее эффективны, чем леводопа. Доказательства их эффективности на поздней стадии уменьшаются, хотя они указывают на их полезность для уменьшения колебаний между периодами включения и выключения. Хотя первоначальное исследование показало, что селегилин в сочетании с леводопой увеличивает риск смерти, это позже было опровергнуто.
Метаболиты селегилина включают L-амфетамин и L-метамфетамин (не путать с более сильными правовращающими изомерами). Это может привести к побочным эффектам, таким как бессонница. Еще одним побочным эффектом сочетания может стать стоматит. В отличие от других неселективных ингибиторов моноаминоксидазы, тираминсодержащие продукты не вызывают гипертонического криза.
Некоторые данные указывают на то, что другие препараты, такие как амантадин и холинолитики, могут быть полезны для лечения двигательных симптомов на ранних и поздних стадиях болезни Паркинсона, но, поскольку качество доказательств эффективности снижается, они не являются препаратами первого выбора. Помимо двигательных симптомов, БП сопровождается рядом различных симптомов. Для решения некоторых из этих проблем используются различные соединения. Примерами являются использование клозапина при психозе, ингибиторов холинэстеразы при деменции, модафинила при дневной сонливости и атомоксетина при исполнительной дисфункции.
Предварительные исследования показывают, что прием донепезила (арисепта) может помочь предотвратить падения у людей с болезнью Паркинсона. Донепезил повышает уровень нейромедиатора ацетилхолина и в настоящее время является одобренным препаратом для лечения когнитивных симптомов болезни Альцгеймера. В исследовании участники, принимавшие донепезил, падали вдвое реже, чем участники, принимавшие плацебо, а те, кто ранее падал больше всего, показали наибольшее улучшение.
Введение клозапина (Clozaril) представляет собой прорыв в лечении психотических симптомов БП. До его введения лечение психотических симптомов основывалось на сокращении дофаминовой терапии или лечении нейролептиками первого поколения, все из которых ухудшали двигательную функцию. Другие атипичные нейролептики, полезные для лечения, включают кветиапин (Сероквель), зипразидон (Геодон), арипипразол (Абилифай) и палиперидон (Инвега). Считается, что клозапин обладает наивысшей эффективностью и наименьшим риском экстрапирамидных побочных эффектов.
Пациенты с болезнью Паркинсона, которые не получают правильные лекарства в нужное время, когда они находятся в больнице (часто они попадают в больницу из-за не связанных заболеваний), иногда не могут говорить или ходить. Состояние здоровья большинства ухудшилось из-за неудовлетворительного приема лекарств в больнице. Британская служба здравоохранения Паркинсона считает, что NHS может сэкономить до 10 миллионов фунтов стерлингов в год и улучшить уход за пациентами с болезнью Паркинсона, если будет введено обязательное обучение для всего персонала больницы.
Паркинсон Великобритания обнаружила:
 Иллюстрация, показывающая электрод, глубоко расположенный в головном мозге.
Иллюстрация, показывающая электрод, глубоко расположенный в головном мозге. Когда-то хирургическое лечение БП было обычной практикой, но после открытия леводопы хирургическое вмешательство было ограничено лишь несколькими случаями. Исследования, проведенные за последние несколько десятилетий, привели к значительным улучшениям в хирургических методах, и хирургия снова используется у людей с продвинутой стадией болезни Паркинсона, для которых лекарственная терапия больше не является достаточной.
Менее 10% пациентов, страдающих БП, могут считаться подходящими кандидатами для хирургического вмешательства. Три различных механизма хирургического ответа на БП: абляционная хирургия (необратимое сжигание или замораживание ткани головного мозга), хирургическая стимуляция или глубокая стимуляция мозга (DBS), а также трансплантация или восстановительная хирургия.
Целевые области для DBS или поражений включают таламус, бледный шар (метод поражения называется паллидотомией ) или субталамическое ядро.
Хирургия нейроаблативных поражений определяет местонахождение и разрушает под действием тепла те части мозга, которые вызывают неврологические симптомы паркинсонизма. Обычно процедуры включают таламотомию и / или паллидотомию. Таламотомия - это разрушение части таламуса, в частности промежуточной брюшной мышцы, для подавления тремора у 80-90% пациентов. Если ригидность и акинезия очевидны, то место абляции является ядром субталамиса.
Паллидотомия включает разрушение бледного шара, в частности внутреннего бледного шара, у пациентов с болезнью Паркинсона, страдающих ригидностью и акинезией.
Поскольку трудно точно измерить количество разрушаемой ткани, тремор нередко сохраняется после нескольких курсов хирургического вмешательства, поскольку ткань необратимо повреждается и удаляется, и тестирование меньших участков ткани является более безопасным для предотвращения серьезных осложнений, таких как инсульт или инсульт. паралич. .. Этот метод обычно заменяют глубокими операциями на головном мозге.
Глубокая стимуляция головного мозга (DBS) в настоящее время является наиболее часто используемым методом хирургического лечения, поскольку она не разрушает ткань мозга, является обратимой и может быть адаптирована для людей на их конкретной стадии заболевания. DBS использует три аппаратных компонента: нейростимулятор, также называемый имплантированным генератором импульсов (IPG), который генерирует электрические импульсы, используемые для модуляции нейронной активности, провод отведения, который направляет импульсы к нескольким металлическим электродам к кончику провода рядом с проводом. мишень для стимуляции и удлинительный провод, соединяющий электрод с IPG. IPG, который питается от батареи и заключен в титановый корпус, традиционно имплантируется под ключицу и подкожно соединяется с проводом, который проходит снаружи черепа под скальпом вниз в мозг к цели стимуляции. IPG или всю трехкомпонентную систему иногда называют кардиостимулятором мозга из-за приоритета и известности кардиостимуляторов и сходства компонентов обоих типов систем.
Предоперационное нацеливание на правильные места имплантации может быть выполнено косвенными и прямыми методами. Непрямой метод использует компьютерную томографию, магнитно-резонансную томографию или вентрикулографию для определения местоположения передней и задней комиссур, а затем использует заранее определенные координаты и расстояния от межкомиссуральной линии для определения целевой области. Последующие гистологически определенные карты атласа также могут быть использованы для проверки целевой области. Прямой метод обеспечивает визуализацию и нацеливание на глубокие ядра с помощью стереотаксической предоперационной МРТ, которая, в отличие от непрямого метода, учитывает анатомические вариации размера ядер, положения и функциональной сегрегации среди людей.
Функциональное электрофизическое картирование, инструмент, используемый в обоих методах для проверки ядер-мишеней, подверглось тщательной проверке из-за связанных с ним рисков кровотечений, дизартрии или тетанических сокращений. Недавно визуализация, взвешенная по восприимчивости, тип МРТ, продемонстрировала невероятную способность различать эти глубокие ядра мозга и используется в DBS для уменьшения чрезмерного использования EFM.
DBS рекомендуется пациентам с БП без важных психоневрологических противопоказаний, страдающим двигательными колебаниями и тремором, плохо контролируемым лекарствами, или тем, кто не переносит лекарства.
DBS эффективен при подавлении симптомов болезни Паркинсона, особенно тремора. Недавнее клиническое исследование привело к рекомендациям по определению, каким пациентам с болезнью Паркинсона с наибольшей вероятностью поможет DBS.
БП могут поражать мышцы и нервы, контролирующие процесс пищеварения, поэтому часто возникают запоры и гастропарез (пища, остающаяся в желудке дольше, чем обычно). Для улучшения пищеварения рекомендуется сбалансированная диета. Диета должна включать продукты с высоким содержанием клетчатки и много воды. Леводопа и белки используют одну и ту же транспортную систему в кишечнике и через гематоэнцефалический барьер, конкурируя между собой за доступ. В совокупности последствия такой конкуренции - снижение эффективности препарата. Поэтому, когда леводопа вводится, чрезмерные белки не рекомендуется, а в более поздних стадиях, дополнительный прием с низким содержанием белка продуктов, таких как хлеб или макароны рекомендуется по тем же причинам. Чтобы свести к минимуму взаимодействие с белками, леводопу рекомендуется принимать за 30 минут до еды. В то же время схемы лечения БП ограничивают потребление белков во время завтрака и обеда и обычно принимаются за ужином. По мере развития болезни может появиться дисфагия. В таких случаях особые меры включают использование загустителей для приема жидкости, специальные позы во время еды и в худшем случае гастростомию.
Исследования по реабилитации при болезни Паркинсона немногочисленны и низкого качества. Частичные доказательства указывают на то, что проблемы с речью или подвижностью можно улучшить после реабилитации. Регулярные физические упражнения и / или терапия могут быть полезны для поддержания и улучшения подвижности, гибкости, силы, скорости походки и качества жизни. Упражнения также могут уменьшить запор. Было доказано, что упражнения с упражнениями приносят пользу пациентам с болезнью Паркинсона в отношении физического функционирования, качества жизни, связанного со здоровьем, а также равновесия и риска падений. В обзоре 14 исследований, посвященных изучению воздействия физических упражнений на людей с болезнью Паркинсона, никаких побочных эффектов или побочных эффектов после каких-либо вмешательств не наблюдалось. Известно пять предложенных механизмов, с помощью которых упражнения повышают нейропластичность. Интенсивная активность максимизирует синаптическую пластичность; комплексные мероприятия способствуют большей структурной адаптации; полезные занятия повышают уровень дофамина и, следовательно, способствуют обучению / повторному обучению; дофаминергические нейроны очень чувствительны к упражнениям и бездействию («используй или потеряй»); и там, где упражнения вводятся на ранней стадии заболевания, прогрессирование может быть замедлено. Одним из наиболее широко применяемых методов лечения речевых расстройств, связанных с болезнью Паркинсона, является голосовая терапия Ли Сильвермана (LSVT), которая направлена на повышение громкости голоса и имеет интенсивный подход в течение одного месяца. Логопедия и, в частности, LSVT могут улучшить голосовую и речевую функцию. Трудотерапия (ОТ) направлена на укрепление здоровья и повышение качества жизни, помогая людям с этим заболеванием участвовать в как можно большем количестве повседневных дел. Было проведено несколько исследований эффективности ОТ, и их качество низкое, хотя некоторые показания показывают, что он может улучшить моторику и качество жизни на время терапии.
Для наблюдения за пациентами с болезнью Паркинсона исследовательские группы изучают, могут ли виртуальные вызовы на дом заменить посещения клинических учреждений. При испытании таких видеосещений пациенты предпочитали удаленного специалиста через 1 год. Уход на дому считался удобным, но требует доступа к Интернет-технологиям и знания их.
Регулярные физические упражнения с физиотерапией или без нее могут быть полезны для поддержания и улучшения подвижности, гибкости, силы, скорости походки и качества жизни. Было обнаружено, что с точки зрения улучшения гибкости и диапазона движений у пациентов с ригидностью, общие методы расслабления, такие как легкое покачивание, уменьшают чрезмерное мышечное напряжение. Другие эффективные методы, способствующие расслаблению, включают медленные вращательные движения конечностей и туловища, ритмическое начало, диафрагмальное дыхание и техники медитации. Общие изменения походки, связанные с заболеванием, такие как гипокинезия (замедленность движений), шарканье и уменьшение размаха рук, устраняются с помощью различных стратегий, направленных на улучшение функциональной мобильности и безопасности. Цели в отношении походки во время программ реабилитации включают улучшение скорости походки, опоры, длины шага, движения туловища и рук. Стратегии включают использование вспомогательного оборудования (ходьба с шестом и ходьба по беговой дорожке), вербальные подсказки (ручные, визуальные и слуховые), упражнения (походы и паттерны PNF ) и различные условия (поверхности, входы, открытые и закрытые).
Укрепляющие упражнения привели к улучшению силовых и двигательных функций у пациентов с первичной мышечной слабостью и слабостью, связанной с бездействием в случаях болезни Паркинсона от легкой до умеренной. Пациенты выполняют упражнения в лучшем виде - от 45 минут до одного часа после приема лекарств. 8-недельное исследование тренировок с отягощениями, направленное на голени, показало, что пациенты с болезнью Паркинсона увеличили силу живота и улучшили длину шага, скорость ходьбы и углы позы. Кроме того, из-за согнутой позы и респираторной дисфункции на поздних стадиях болезни Паркинсона упражнения на глубокое диафрагмальное дыхание полезны для улучшения подвижности грудной клетки и улучшения жизненной емкости. Упражнения могут исправить запор.
Тренировки на вибрационной платформе, также называемые тренировками с использованием вибрации всего тела (WBV), были недавно представлены в качестве тренировочного инструмента, дополняющего стандартные программы физической реабилитации для людей с болезнью Паркинсона. По сравнению с отсутствием вмешательства однократные сеансы WBV привели к улучшению двигательных способностей, что отражено в показателях тремора и ригидности по унифицированной шкале оценки болезни Паркинсона (UPDRS). Однако более долгосрочные (3-5 недель) программы WBV не привели к улучшению моторных показателей UPDRS по сравнению с обычными упражнениями. Кроме того, несколько сеансов WBV не смогли усилить меры мобильности (т.е. Timed Up и Go Test и 10-Meter прогулочный тест ) у людей с болезнью Паркинсона. Недавний обзор показал, что доказательства влияния тренировки WBV на сенсомоторную и функциональную работоспособность остаются неубедительными.
Психологическое лечение основано на когнитивно-поведенческих вмешательствах. Подтверждена эффективность когнитивно-поведенческой терапии при лечении паркинсонической боли, бессонницы, тревоги, депрессии и нарушений контроля над импульсами. Лечение болезни Паркинсона требует междисциплинарного подхода и включает участие психолога, поскольку двигательные симптомы могут усугубляться психосоциальными факторами, такими как тревога, фобия и панические атаки. Психологическое лечение подбирается индивидуально для каждого человека на основе клинических рекомендаций, особенно если у него серьезные двигательные нарушения или когнитивные проблемы.
Ухудшение походки у людей с болезнью Паркинсона возникает из-за неправильной длины шага. Поскольку доказано, что тремор-доминантный и акинетический ригидный типы болезни Паркинсона имеют различные зрительно-моторные дефекты, такие как проблемы со зрительным восприятием и координацией движений, которые могут влиять на их тренировку ходьбы, им рекомендуется пройти нейропсихологическое обследование перед физиотерапией.
Тренировка походки с учетом конкретной задачи также может привести к долгосрочному улучшению походки у пациентов с болезнью Паркинсона. В предыдущих исследованиях использовались системы поддержки веса тела во время тренировки походки, когда люди подвешивались к подвесным ремням с ремнями вокруг тазового пояса во время ходьбы на беговой дорожке. Было показано, что эта форма тренировки походки улучшает долгосрочную скорость ходьбы и шаркающую походку после месячного периода вмешательства.
Исследования также изучают влияние тай-чи на показатели походки и равновесие у людей с болезнью Паркинсона. Первое исследование пришло к выводу, что тай-чи был неэффективен, так как не было улучшения показателей походки и улучшения показателей части III Объединенной рейтинговой шкалы болезни Паркинсона (UPDRS). Второе исследование показало, что пациенты, принимающие тай-чи, улучшили свои показатели UPDRS, тест Timed Up and Go, шестиминутную ходьбу и ходьбу назад. Однако он не показал никаких улучшений в их ходьбе вперед или в тесте на стойку на одной ноге.
Одним из наиболее широко применяемых методов лечения речевых расстройств, связанных с болезнью Паркинсона, является голосовая терапия Ли Сильвермана (LSVT). Логопедия и, в частности, LSVT могут улучшить речь.
У людей с болезнью Паркинсона может развиться дизартрия, которая характеризуется пониженной разборчивостью речи. Может помочь просодическое лечение.
Трудотерапия направлена на укрепление здоровья и повышение качества жизни, помогая людям с этим заболеванием участвовать в повседневной жизни, насколько это возможно. Есть указания на то, что трудотерапия может улучшить моторику и качество жизни на время терапии.
Ритмическая слуховая стимуляция (РАС) - это метод неврологической реабилитации, заключающийся в компенсации потери моторной регуляции посредством внешней сенсорной стимуляции, опосредованной звуком. Этот метод основан на тесном взаимодействии слуховой и двигательной нервной системы. Синхронизируя свои шаги с издаваемым звуком (это могут быть «метрономные» сигналы или сложная музыка), пациент может улучшить свою скорость походки и длину шага.
Годовое рандомизированное контролируемое исследование, проведенное в 2017 году, показало, что оказание удаленной неврологической помощи людям с болезнью Паркинсона в их собственных домах возможно и так же эффективно, как и личное лечение. Хотя удаленным лицам, осуществляющим уход, может быть сложнее установить доверительные отношения при оказании удаленной помощи, эта оценка видеосещений на дому у пациента показала, что после четырех виртуальных посещений в течение одного года люди с болезнью Паркинсона предпочли связь с удаленным специалистом своей местный врач.
Преимущества телемедицины включают удобство и рентабельность, поскольку было обнаружено, что виртуальные посещения на дому сокращают транспортные расходы и время для пациентов по сравнению с визитами в офис. Некоторые исследования показали, что технология поддерживает персонализированные соединения, аналогичные вызовам на дом в прошлом. Пять рандомизированных контролируемых испытаний показали, что качество жизни у лиц, получавших телемедицинскую помощь, было аналогичным или улучшилось.
Проблемы, связанные с телемедициной при лечении людей с болезнью Паркинсона, связаны с технологическими требованиями, поскольку пациенты и их друзья или семьи должны иметь доступ к Интернет-технологиям и быть знакомыми с ними. Отчасти из-за этих технологических требований исследования в Соединенных Штатах, как правило, включают небольшое количество участников из этнических меньшинств и непропорционально большое количество людей с более высоким уровнем образования. Одно из решений, предлагаемых для уменьшения социальных и экономических барьеров для доступа к дистанционной помощи, - это создание клиник спутниковой теленеврологии в недостаточно обслуживаемых регионах. Врачи ссылаются на препятствия, связанные с невозможностью пройти полное неврологическое обследование, в дополнение к технологиям и вопросам компенсации.
Новые телемедицинские технологии, используемые или оцениваемые в контексте телемедицины, включают запатентованные носимые устройства, системы самочувствия и настройки с обратной связью, роботизированные технологии, интеллектуальные устройства для обнаружения движений, программы для улучшения приверженности к лечению, интеграцию умного дома и искусственный интеллект или машинное обучение. -системы.
Паллиативная помощь часто требуется на последних стадиях заболевания, часто когда дофаминергические методы лечения становятся неэффективными. Целью паллиативной помощи является достижение максимального качества жизни человека с заболеванием и его окружающих. Некоторые центральные вопросы паллиативного лечения - это уход за пациентами дома, в то время как там может быть оказана адекватная помощь, уменьшение или отмена приема дофаминергических препаратов для уменьшения побочных эффектов и осложнений, предотвращение пролежней за счет лечения зон давления у неактивных пациентов и облегчение выздоровления пациента. -жизненные решения для пациента, а также вовлеченных друзей и родственников.
Повторяющаяся транскраниальная магнитная стимуляция временно улучшает дискинезию, вызванную леводопой. Его полная полезность в PD - открытая область исследований. В качестве возможных методов лечения были предложены различные питательные вещества ; однако нет доказательств того, что витамины или пищевые добавки улучшают симптомы. Недостаточно доказательств того, что иглоукалывание и практика цигун или тай-чи оказывают какое-либо влияние на симптомы. Фава и бархатная фасоль являются естественными источниками L-DOPA, и их принимают многие люди с болезнью Паркинсона. Хотя они продемонстрировали некоторую эффективность, их прием небезопасен. Описаны опасные для жизни побочные реакции, такие как злокачественный нейролептический синдром. Пересадка фекалий может благотворно повлиять на симптомы.
 Фотография Жана-Мартена Шарко, сделанная в 1893 году, который внес важный вклад в понимание болезни, включая предложение антихолинергических средств в качестве лечения тремора.
Фотография Жана-Мартена Шарко, сделанная в 1893 году, который внес важный вклад в понимание болезни, включая предложение антихолинергических средств в качестве лечения тремора. Положительные, хотя и умеренные эффекты холинолитических алкалоидов, полученных из растения красавки, были описаны в 19 веке Шарко, Эрбом и другими. Современная хирургия тремора, заключающаяся в повреждении некоторых структур базальных ганглиев, была впервые опробована в 1939 году и была усовершенствована в течение следующих 20 лет. До этой даты операция заключалась в поражении кортикоспинального пути с параличом вместо тремора. До появления леводопы единственными средствами лечения были антихолинергические препараты и хирургическое вмешательство, что резко сократило их использование.
Леводопа была впервые синтезирована в 1911 году Казимиром Функом, но до середины 20 века ей уделялось мало внимания. Он вошел в клиническую практику в 1967 году, и первое большое исследование, в котором сообщалось об улучшении состояния людей с болезнью Паркинсона в результате лечения леводопой, было опубликовано в 1968 году. Леводопа произвела революцию в лечении БП. К концу 1980-х годов стимуляция глубокого мозга стала возможным лечением, и в 1997 году она была одобрена для клинического использования Управлением по контролю за продуктами и лекарствами.
В ближайшее время не ожидается появления новых методов лечения болезни Паркинсона, но в отношении новых методов лечения активно ведутся исследования по нескольким направлениям. К таким направлениям исследований относятся поиск новых моделей заболевания на животных, а также потенциальная полезность генной терапии, трансплантации стволовых клеток и нейропротективных агентов.
Трагедия группы наркоманов в Калифорнии в начале 1980 - х годов, которые потребляли загрязненную и незаконно произведенной партии синтетических опиатов MPPP высветили МФТП как причина паркинсонизма симптомов. Другие преобладающие модели на основе токсинов используют инсектицид ротенон, гербицид паракват и фунгицид манеб. Модели на основе токсинов чаще всего используются у приматов. Существуют также трансгенные модели грызунов.
Современные методы лечения болезни Паркинсона обеспечивают удовлетворительный контроль болезни для большинства пациентов на ранней стадии. Однако нынешнее золотое стандартное лечение БП с помощью леводопы связано с двигательными осложнениями и не предотвращает прогрессирование заболевания. Срочно необходимо более эффективное и долгосрочное лечение БП, чтобы контролировать его прогрессирование. Генная терапия in vivo - это новый подход к лечению БП. Использование переноса генов соматических клеток для изменения экспрессии генов в нейрохимических системах мозга является новым альтернативным традиционным лечением.
Генная терапия в настоящее время исследуется. Он включает использование неинфекционного вируса для переноса гена в часть мозга. Используемый ген приводит к выработке фермента, который помогает управлять симптомами болезни Паркинсона или защищает мозг от дальнейшего повреждения.
Один из подходов, основанных на генной терапии, включает доставку гена нейртурина и нейротрофического фактора глиальных клеток (GDNF) скорлупе у пациентов с запущенной болезнью Паркинсона. GDNF защищает дофаминовые нейроны in vitro и на животных моделях паркинсонизма; нейрурин является структурным и функциональным аналогом GDNF, который защищает дофаминовый нейрон в животной модели заболевания. Несмотря на открытые испытания, показывающие преимущества непрерывного вливания GDNF, результаты не были подтверждены в двойных слепых исследованиях. Это может быть связано с коэффициентом распределения; трофический фактор не распределялся по целевому месту в достаточной степени.
Другая генная терапия БП включала введение декарбоксилазы глутаминовой кислоты (GAD) в субталамическое ядро. Фермент GAD контролирует продукцию GABA. При болезни Паркинсона нарушается активность обоих эфферентов ГАМК в субталамическом ядре и его мишени в цепи базальных ганглиев. В этой стратегии использовался аденоассоциированный вирусный вектор (AAV2) для доставки GAD в субталамическое ядро. Испытание было проведено для сравнения эффекта двусторонней доставки AAV2-GAD в субталамическое ядро с двусторонней фиктивной хирургией у пациентов с запущенной болезнью Паркинсона. Исследование показало первый успех рандомизированного двойного слепого исследования генной терапии нейродегенеративного заболевания и оправдало продолжение разработки AAV2-GAD для лечения БП.
 Хотя некоторые химические соединения, такие как GNDF (химическая структура на фото) были предложены в качестве нейропротекторов при БП, ни одно из них не доказало свою эффективность.
Хотя некоторые химические соединения, такие как GNDF (химическая структура на фото) были предложены в качестве нейропротекторов при БП, ни одно из них не доказало свою эффективность. Исследования нейропротекции находятся в авангарде исследований болезни Паркинсона. В настоящее время не существует проверенных нейропротективных средств или методов лечения БП. Хотя все еще теоретически, нейрозащитная терапия основана на идее о том, что определенные нейроны, вырабатывающие дофамин и подверженные преждевременной дегенерации и гибели клеток, можно защитить с помощью введения нейрозащитных фармацевтических препаратов. Эта защита может проявляться до того, как проявятся какие-либо симптомы, в зависимости от генетического риска, а также во время ранней или поздней стадии БП, когда другие методы лечения перестают действовать из-за прогрессирования заболевания. Соответственно, нейропротекторная терапия направлена на отсрочку введения леводопы.
Несколько молекул были предложены в качестве возможных методов лечения. Тем не менее, ни один из них не был убедительно продемонстрирован в отношении уменьшения дегенерации. Агенты, которые в настоящее время исследуются, включают антиапоптотические средства ( омигапил, CEP-1347 ), антиглутаматергические средства, ингибиторы моноаминоксидазы ( селегилин, разагилин ), промитохондрии ( коэнзим Q10, креатин ), блокаторы кальциевых каналов ( исрадипин ) и факторы роста ( GDNF ). Доклинические исследования также нацелены на альфа-синуклеин.
Селегилин находится в группе препаратов, называемых моноаминов типа оксидазы В ( МАО-В ) ингибиторы. Селегилин используется для контроля симптомов болезни Паркинсона у людей, принимающих комбинацию леводопы и карбидопы (синемет). Селегилин может помочь людям с БП, останавливая действие леводопы / карбидопы и увеличивая время, в течение которого леводопа / карбидопа продолжает контролировать симптомы.
В ответ на потенциально токсичный амфетамин метаболиты, вызванных селегилиной, еще одно перспективного лечение в МАО B пропаргил амин ингибитор разагилины (N-пропаргил-1-R-аминоиндан, Azilect ((R))). Биодоступность разагилина при пероральном приеме составляет 35%, Т (макс.) Достигается через 0,5–1,0 часа, а его период полувыведения составляет 1,5–3,5 часа. Разагилин подвергается интенсивному метаболизму в печени, главным образом, за счет цитохрома P450 типа 1A2 (CYP1A2). Разагилин назначают в дозе 1 мг один раз в день в качестве монотерапии у пациентов с ранней стадией болезни Паркинсона и в дозе 0,5–1,0 мг один раз в день в качестве дополнения к леводопе у пациентов с прогрессирующей стадией болезни Паркинсона.
С начала 1980-х годов ткани плода, свиньи, сонной артерии или сетчатки использовались при трансплантации клеток пациентам с БП. Хотя изначально были доказательства эффективности трансплантации мезэнцефальных дофамин-продуцирующих клеток, наиболее точные на сегодняшний день исследования показывают, что трансплантаты клеток не имеют никакого эффекта. Дополнительной серьезной проблемой было избыточное высвобождение дофамина пересаженной тканью, что приводило к дистонии. Трансплантация стволовых клеток является основной целью недавних исследований: ими легко манипулировать, а при трансплантации в мозг грызунов и обезьян клетки выживают и улучшают поведенческие аномалии животных. Тем не менее, использование фетальных стволовых клеток вызывает споры. Некоторые предполагают, что такое противоречие можно преодолеть с помощью индуцированных плюрипотентных стволовых клеток взрослых.