 1,3-Димезитилимидазол-4,5-дигидро-2-илиден, типичный стойкий карбен
1,3-Димезитилимидазол-4,5-дигидро-2-илиден, типичный стойкий карбен A стойкий карбен (также известный как стабильный карбен ) представляет собой тип карбена, демонстрирующий особую стабильность. Наиболее известными примерами и наиболее крупной подгруппой являются N-гетероциклические карбены (NHC) (иногда называемые карбены Ардуенго ), например диаминокарбены с общей формулой (R 2N)2C:, где R обычно представляют собой алкильные и арильные группы. Группы могут быть связаны с образованием гетероциклических карбенов, таких как производные имидазола, имидазолина, тиазол или триазол.
Традиционно карбены считаются настолько реактивными, что их изучали только косвенно, например, путем улавливания. Эта ситуация резко изменилась с появлением стойких карбенов. Хотя они являются довольно реактивными веществами, т.е. подвергаясь димеризации, многие из них могут быть выделены в виде чистых веществ.
Стойкие карбены могут существовать в синглетном или триплетном состояниях с карбены в синглетном состоянии более стабильны.Относительная стабильность этих соединений лишь частично обусловлена стерическими препятствиями со стороны Bul ky группы. Некоторые синглетные карбены термодинамически стабильны в отсутствие влаги и (в большинстве случаев) кислорода, и их можно изолировать и хранить в течение неограниченного времени. Другие димеризуются медленно в течение нескольких дней. Карбены в триплетном состоянии имеют период полураспада , измеряемый в секундах, и поэтому их можно наблюдать, но нельзя хранить.
В 1957, Рональд Бреслоу предположил, что относительно стабильный нуклеофильный карбен, производное, участвует в каталитическом цикле витамина B 1 (тиамин), который дает 221>фуроин из фурфурол. В этом цикле тиазолиевое кольцо витамина обменивает атом водорода (связанный с углеродом 2 кольца) на фурфуроловый остаток. В дейтерированной воде было обнаружено, что протон C2- быстро обменивается на дейтрон в статистическом равновесии.
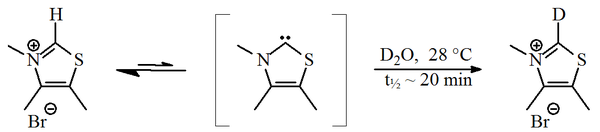 Дейтерий-обмен C2- протон тиазолиевой соли
Дейтерий-обмен C2- протон тиазолиевой соли Было предложено, чтобы этот обмен происходил через посредство тиазол-2-илидена. В 2012 году сообщалось о выделении так называемого промежуточного соединения Бреслоу.
В 1960 году Ханс-Вернер Ванзлик и его сотрудники предположили, что карбены являются производными дигидроимидазол-2-илидена. получали пиролизом в вакууме соответствующих соединений 2-трихлорметил дигидроимидазола с потерей хлороформа. Они предположили, что карбен существует в равновесии со своим димером, производным тетрааминоэтилена, так называемым равновесием Ванзлика. Это предположение было оспорено Лемалом и сотрудниками в 1964 году, которые представили доказательства того, что димер не диссоциирует; и Винбергом в 1965 году. Однако последующие эксперименты Денка, Херрманна и других подтвердили это равновесие, хотя и при определенных обстоятельствах.
В 1970 году группа Ванзлика произвела имидазол- 2-илиденкарбены депротонированием соли имидазолия. Ванзлик, а также [[Роальд Хоффманн], предположили, что эти карбены на основе имидазола должны быть более стабильными, чем их 4,5-дигидроаналоги, из-за ароматичности типа Хюккеля. Однако Ванзлик не выделил имидазол-2-илидены, а вместо этого выделил их координационные соединения с ртутью и изотиоцианатом :
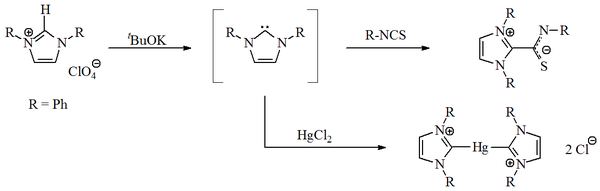 Получение и улавливание имидазол-2-илидена
Получение и улавливание имидазол-2-илидена В 1988 году Гай Бертран и другие выделили фосфинокарбен. Эти разновидности могут быть представлены либо как λ-фосфинокарбен, либо как λ- фосфацетилен. :
 Алкин- и карбеновые резонансные структуры карбена Бертрана
Алкин- и карбеновые резонансные структуры карбена Бертрана Эти соединения были названы «двухтактными карбенами» в связи с противоположным сродством к электрону атомы фосфора и кремния. Они проявляют как карбеновую, так и алкиновую реакционную способность. Рентгеновская структура этой молекулы не была получена, и на момент публикации оставались некоторые сомнения относительно их точной карбенической природы.
В 1991 г. стабильный, изолированный и кристаллический диаминокарбен, который может быть представлен в виде карбена или азот-углеродного илида, был получен Arduengo и сотрудниками путем депротонирования хлорид имидазолия с сильным основанием:
 Получение N, N'-диадамантиламидазол-2-илидена
Получение N, N'-диадамантиламидазол-2-илидена Этот карбен, предшественник большого семейства карбенов с ядром имидазол-2-илидена, оказался способным быть неопределенно стабильным при комнатной температуре (в отсутствие кислорода и влаги) и плавиться при 240–241 ° C без разложения. Другим интересным химическим свойством этого илидного соединения был характерный резонанс в спектре ЯМР C при 211 м.д. для атома карбеновой кислоты. Рентгеновская структура выявила более длинные связи N – C в кольце карбена, чем в исходном имидазолиевом соединении, что указывает на очень мало двойной связи Характер этих облигаций.
Первый стабильный на воздухе илидовый карбен, хлорированный член семейства имидазол-2-илидена, был получен в 1997 году.
В 2000 году Бертран получил дополнительные карбены фосфанильного типа, включая (фосфанил) (трифторметил) карбен, стабильный в растворе при -30 ° C, и умеренно стабильный (амино) (арил) карбен только с одним гетероатомом, примыкающим к карбеновому атому.
 Диметилимидазол-2-илиден, стабильный дикарбен с небольшими стерическими затруднениями. (внешнее средство просмотра )
Диметилимидазол-2-илиден, стабильный дикарбен с небольшими стерическими затруднениями. (внешнее средство просмотра )Стабильность карбенов Arduengo первоначально приписывалась объемистому N- адамантилу заместители, которые предотвращают димеризацию карбена из-за стерических препятствий. Замена N-адамантильных групп на метильные группы также дает стабильные NHC. Таким образом, имидазол-2-илидены составляют термодинамически стабильный.
Также предполагалось, что двойная связь между атомами углерода 4 и 5 имидазолия r Основная цепь, которая придавала этой системе ароматический характер, была важна для стабильности карбена. Это предположение было опровергнуто в 1995 году группой Ардуенго, которая получила производное дигидроимидазол-2-илидена, лишенное двойной связи. Термодинамическая стабильность в этом соединении и роль стерической защиты в предотвращении димеризации были предметом некоторых споров.
 Бис (диизопропиламино) карбен, первый ациклический стабильный карбен
Бис (диизопропиламино) карбен, первый ациклический стабильный карбен Первый ациклический стойкий карбен был описан в 1996 г., таким образом показывая, что для их стабильности не требовался циклический каркас. В отличие от циклических производных ациклические карбены гибки в отношении вращения связей с карбеновым атомом. Путем измерения барьера вращения этих связей можно было измерить степень их характера двойной связи и определить илидную природу этого карбена. Подобно циклическим диаминокарбенам, беспрепятственные варианты имеют тенденцию к димеризации.
Большинство стойких карбенов стабилизируются двумя фланкирующими центрами азота. Аминотиокарбен и аминооксикарбен - выбросы. и ан. В этих стабильных соединениях карбеновый атом находится между атомом азота и серой или атомом кислорода:
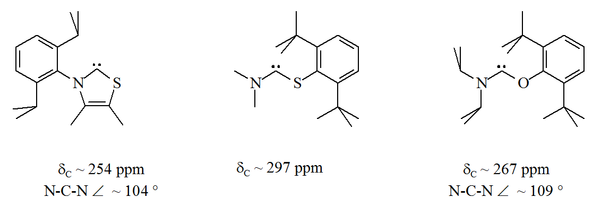 Стабильные карбены с атомами кислорода или серы, связанными с карбеновым атомом (Внешнее средство просмотра )
Стабильные карбены с атомами кислорода или серы, связанными с карбеновым атомом (Внешнее средство просмотра )В отличие от NHC, эти карбены не являются термодинамически стабильными, но имеют тенденцию к димеризации.
In, который стабилен при комнатной температуре, атом карбена связан с двумя атомами углерода в трехчленном кольце, которое сохраняет ароматичность. и геометрия кольца циклопропенилидена. Этот пример продемонстрировал, что присутствие гетероатомов рядом с карбеном также не является необходимым для стабильности.
Ниже приведены примеры классов стабильных карбенов, выделенных на сегодняшний день:
Первые выделенные стабильные карбены были основаны на имидазольном кольце, с удаленным водородом в углероде 2 кольца (между двумя атомами азота) и заменой других атомов водорода на различные наши группы. Эти имидазол-2-илидены все еще являются наиболее стабильным и наиболее хорошо изученным и понятным семейством стойких карбенов.
Был синтезирован значительный диапазон имидазол-2-илиденов, включая те, в которых 1,3-положения функционализированы алкилом, арилом, алкилокси, алкиламино, алкилфосфино и даже хиральные заместители:
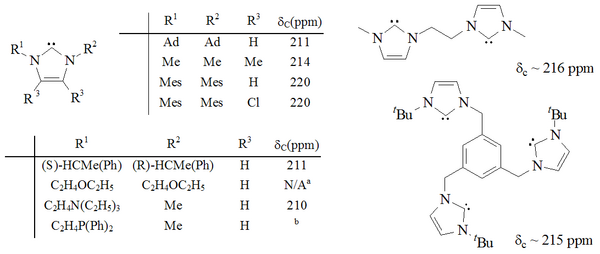 Стабильные имидазол-2-илидены
Стабильные имидазол-2-илидены  1,3-димезитил-4,5-дихлоримидазол-2-илиден, первый стабильный на воздухе карбен. (внешний просмотрщик )
1,3-димезитил-4,5-дихлоримидазол-2-илиден, первый стабильный на воздухе карбен. (внешний просмотрщик )В частности, замещение двух атомов водорода хлора на два атома водорода в положениях 4 и 5 кольца привело к получению первого стабильного на воздухе карбена. Его дополнительная стабильность, вероятно, является следствием электроноакцепторный эффект заместителей хлора, которые уменьшают электронную плотность на атоме углерода, несущем неподеленную пару, через индукция через сигма-скелет.
Были также синтезированы молекулы, содержащие две и даже три имидазол-2-илиденовые группы.
Карбены на основе имидазола термодинамически стабильны и обычно имеют диагональ Значения химического сдвига nostic ЯМР 13С между 210–230 м.д. для карбенового углерода. Обычно рентгеновские структуры этих молекул показывают валентные углы N-C-N 101–102 °.
Другое семейство стойких карбенов основано на 1,2,4-триазольном кольце с незаполненными орбиталями в углероде 5 этого кольцо. триазол-5-илидены, изображенные ниже, были впервые получены Эндерсом и сотрудниками с помощью вакуумного пиролиза посредством потери метанола из 2-метокситриазолов. Сообщалось только об ограниченном диапазоне этих молекул, при этом трифенилзамещенная молекула коммерчески доступна.
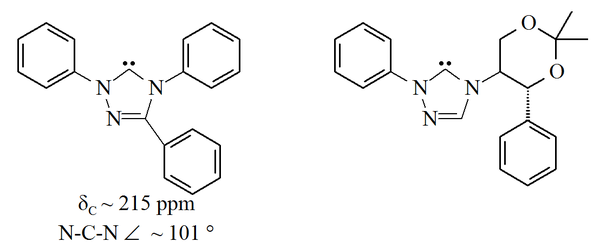 Триазол-5-илидены
Триазол-5-илидены Карбены на основе триазола термодинамически стабильны и имеют диагностические значения химического сдвига ЯМР 13С между 210–220 м.д. для карбенового углерода. Рентгеновская структура трифенилзамещенного карбена, представленного выше, показывает валентный угол N-C-N примерно 101 °. Предшественник 5-метокситриазола для этого карбена был получен обработкой соли триазолия метоксидом натрия, который атакует как нуклеофил. Это может указывать на то, что эти карбены менее ароматичны, чем имидазол-2-илидены, поскольку предшественники имидазолия не реагируют с нуклеофилами из-за потери ароматичности.
Два вышеуказанных семейства можно рассматривать как частные случаи более широкого класса соединений, в которых атом карбена соединяет два атома азота. Ряд таких диаминокарбенов был получен в основном исследовательской группой Роджера Альдера. В некоторых из этих соединений звено N-C-N является членом 5- или 6-членного неароматического кольца, включая бициклический пример. В других примерах соседние атомы азота связаны только через углеродный атом и могут быть или не быть частью отдельных колец.
 Синтезированные циклические и ациклические диаминокарбены
Синтезированные циклические и ациклические диаминокарбены В отличие от ароматических имидазол-2-илиденов или триазол-5- илидены, эти карбены, по-видимому, не являются термодинамически стабильными, как показано димеризацией некоторых беспрепятственных циклических и ациклических примеров. Исследования показывают, что эти карбены димеризуются посредством димеризации, катализируемой кислотой (как в равновесии Ванзлика ).
Диаминокарбены имеют диагностические значения химического сдвига ЯМР 13С между 230–270 м.д. для карбенового атома. Рентгеновская структура дигидроимидазол-2-илидена показывает валентный угол N-C-N примерно 106 °, в то время как угол ациклического карбена составляет 121 °, оба значения больше, чем для имидазол-2-илиденов.
Существует несколько вариантов указанных выше стабильных карбенов, в которых один из атомов азота, примыкающих к карбеновому центру (α-атомы азота), заменен альтернативным гетероатомом, таким как кислород, сера или фосфор.
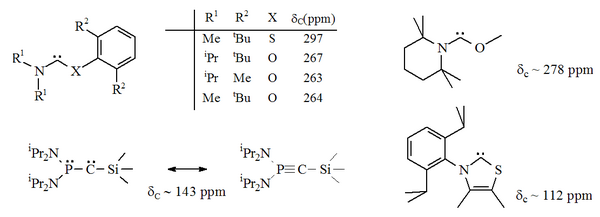 Синтезированные гетероаминокарбены (вверху и внизу справа) и карбены Бертрана (внизу слева)
Синтезированные гетероаминокарбены (вверху и внизу справа) и карбены Бертрана (внизу слева) В частности, формальное замещение серой одного из атомов азота в имидазоле даст ароматический гетероциклический соединение тиазол. Карбен на основе тиазола (аналог карбена, постулированный Бреслоу) был получен и охарактеризован методом рентгеновской кристаллографии. Были получены другие неароматические аминокарбены с атомами O, S и P, смежными (т.е. альфа) с карбеновым центром, например и карбены на их основе были охарактеризованы с помощью рентгеновской кристаллографии.
Поскольку кислород и сера двухвалентны, стерическая защита карбенового центра ограничено, особенно когда блок NCX является частью кольца. Эти ациклические карбены имеют диагностические значения химического сдвига ЯМР 13С между 250–300 ppm для карбенового углерода, более слабые, чем любые другие типы стабильного карбена. Рентгеновские структуры показали валентные углы N-C-X примерно 104 ° и 109 ° соответственно.
Ожидается, что карбены, которые формально являются производными имидазол-2-илиденов путем замещения серы, кислорода или других халькогенов на оба α-азота, будут нестабильными, так как они могут диссоциировать в алкин (RC≡CR) и углерод дихалькогенид (X=C=X).
Реакция сероуглерода (CS 2) с электронодефицитными производными ацетилена, как предполагается, дают переходные карбены (т.е. где X = X = S), которые затем димеризуются до дают производные тетратиафульвена. Таким образом, возможно, что в подобных карбенах может происходить обратный процесс.
В стойких карбенах Бертрана ненасыщенный углерод связан с фосфором и кремний. Однако эти соединения, по-видимому, обладают некоторыми алкиническими свойствами, и после публикации точная карбеновая природа этих красных масел вызвала споры.
Один стабильный N-гетероциклический карбен имеет структуру аналог боразина с одним атомом бора, замещенным метиленовой группой. В результате получается плоское 6-электронное соединение.
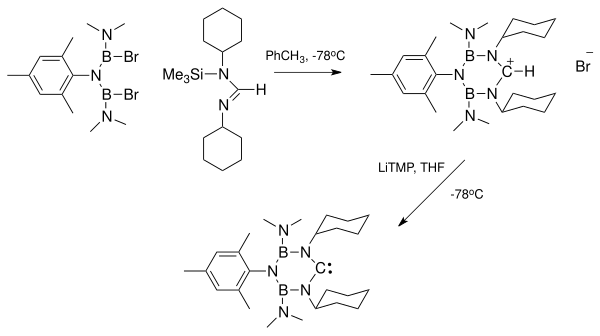 На втором этапе этой последовательности реакций протон отводится LiTMP ; две циклогексильные группы защищают карбен.
На втором этапе этой последовательности реакций протон отводится LiTMP ; две циклогексильные группы защищают карбен. Другое семейство карбенов основано на ядре циклопропенилидена, трехуглеродном кольце с двойной связью между два атома, примыкающие к карбеновому. Примером этого семейства являются.
В 2001 году и его сотрудники смогли произвести сравнительно стабильный триплетный карбен (с периодом полураспада 19 минут), принимая преимущество делокализации электронов.
 Делокализация в стабильном триплетном карбене, о котором сообщил Tomioka (2001)
Делокализация в стабильном триплетном карбене, о котором сообщил Tomioka (2001) В 2006 году та же группа сообщила о триплетном карбене с периодом полураспада 40 минут.. Этот карбен получают путем фотохимического разложения предшественника диазометана под действием света 300 нанометров в бензоле с выделением азота газ.
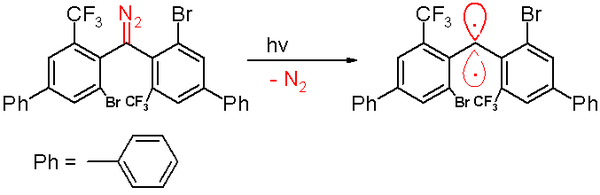 Стойкий триплетный карбен (справа), синтезированный Ито (2006)
Стойкий триплетный карбен (справа), синтезированный Ито (2006) Воздействие кислорода (триплетный бирадикал) превращает этот карбен в соответствующий бензофенон. Соединение дифенилметана образуется, когда оно улавливается циклогекса-1,4-диеном. Как и другие карбены, эта разновидность содержит большие объемные заместители, а именно бром и трифторметильные группы на фенильных кольцах, которые экранируют карбен и предотвращают или замедляют процесс димеризации до 1,1,2, 2-тетра (фенил) алкен. На основании компьютерного моделирования, расстояние двухвалентного атома углерода до его соседей составляет 138 пикометров с валентным углом 158,8 °. Плоскости фенильных групп расположены почти под прямым углом друг к другу (двугранный угол составляет 85,7 °).
Мезоионные карбены (MIC) похожи на N-гетероциклические карбены (NHC), за исключением того, что канонические резонансные структуры с изображенным карбеном невозможно нарисовать без добавления дополнительных зарядов. Мезоионные карбены также называют аномальными N-гетероциклическими карбенами (aNHC) или удаленными N-гетероциклическими карбенами (rNHC). Можно выделить множество свободных карбенов, которые стабильны при комнатной температуре. Другие свободные карбены нестабильны и подвержены межмолекулярному разложению.
Имидазол-2-илидены представляют собой сильные основания, имеющие pKa приблизительно. 24 для конъюгированной кислоты в диметилсульфоксиде (ДМСО):
 Измерение значения pKa для конъюгированной кислоты имидазол-2-илидена
Измерение значения pKa для конъюгированной кислоты имидазол-2-илидена Однако дальнейшие исследования показали, что диаминокарбены депротонируют Растворитель ДМСО, при этом образующийся анион реагирует с образующейся солью амидиния.
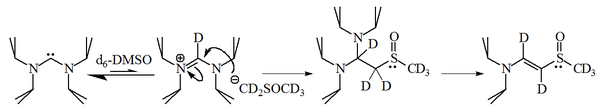 Использование D6-DMSO в качестве растворителя ЯМР может дать неожиданные результаты.
Использование D6-DMSO в качестве растворителя ЯМР может дать неожиданные результаты. Взаимодействие имидазол-2-илиденов с 1-бромгексаном дало 90% 2-замещенного аддукт, содержащий только 10% соответствующего алкена, что указывает на то, что эти молекулы также являются разумно нуклеофильными.
. Значения pKa для конъюгированных кислот нескольких семейств NHC были исследованы в водном растворе. Значения рКа ионов триазолия лежат в диапазоне 16,5-17,8, примерно на 3 единицы рКа более кислые, чем соответствующие ионы имидазолия.
Когда-то считалось, что стабильные карбены обратимо dimerise через так называемое равновесие Ванзлика. Однако имидазол-2-илидены и триазол-5-илидены термодинамически стабильны и не димеризуются, и их хранят в растворе в отсутствие воды и воздуха в течение многих лет. Предположительно это связано с ароматической природой этих карбенов, которая теряется при димеризации. Фактически имидазол-2-илидены настолько термодинамически стабильны, что только в очень ограниченных условиях эти карбены могут димеризоваться.
Чен и Татон получили диимидазол-2-илиден с двойной связью путем депротонирования соответствующей соли диимидазолия. Только депротонирование дважды связанной соли диимидазолия более коротким метиленовым мостиком (-CH 2 -) привело к димеру дикарбена:
 Димеризация связанных диимидазол-2-илиденов
Димеризация связанных диимидазол-2-илиденов Если бы этот димер существовал как дикарбен, электронные неподеленные пары на карбеновом углероде были бы вынуждены находиться в непосредственной близости. Предположительно возникающие отталкивающие электростатические взаимодействия будут иметь значительный дестабилизирующий эффект. Чтобы избежать этого электронного взаимодействия, димеризуются звенья карбена.
С другой стороны, гетероаминокарбены (например, R 2 NC: -OR или R 2 NC: -SR) и неароматические карбены, такие как диаминокарбены ( например, R 2 NC: -NR 2), как было показано, димеризуются, хотя и довольно медленно. Предполагается, что это связано с высоким барьером для синглетного состояния димеризации:
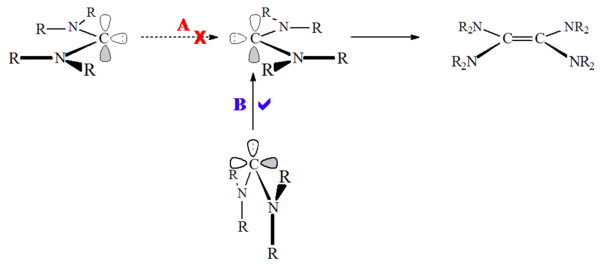 «наименьшее движение» (путь A - не разрешено) и «не наименьшее движение» (путь B) пути карбена. димеризация
«наименьшее движение» (путь A - не разрешено) и «не наименьшее движение» (путь B) пути карбена. димеризация Диаминокарбены на самом деле не димеризуются, а скорее образуют димер в результате реакции через соли формамидиния, протонированные соединения-предшественники. Соответственно, эту реакцию можно катализировать кислотой. Эта реакция происходит потому, что, в отличие от карбенов на основе имидазолия, при протонировании карбена не происходит потери ароматичности.
В отличие от димеризации карбенов в триплетном состоянии, эти карбены в синглетном состоянии не подходят друг к другу ("наименьшее движение"), а скорее карбен неподеленная пара атакует пустой углерод p-орбитали ("не наименьшее движение"). Димеризация карбена может катализироваться как кислотами, так и металлами.
Химический состав стабильных карбенов полностью не изучен. Однако Enders et al. выполнили ряд органических реакций с участием триазол-5-илидена. Эти реакции описаны ниже и могут рассматриваться как модель для других карбенов.

| a | 3,6-дифенил-1,2,4,5-тетразин, толуол | 92% | e | 2 экв., PhNCO, толуол, кипячение с обратным холодильником | 92% | |
|---|---|---|---|---|---|---|
| b | RXH, RT | 95–97% | f | CS2, толуол или PhNCS, THF, RT | 71–90% | |
| c | O2, S 8, или Se, толуол, кипячение с обратным холодильником | 54–68% | g | Малеимид, THF, RT | 47–84% | |
| d | R1CH = CHR, THF, RT | 25–68% | h | Диметилацетилендикарбоксилат, THF, кипячение с обратным холодильником | 21% |
Эти карбены имеют тенденцию вести себя нуклеофильно (e и f ), выполнение реакций вставки (b), реакций присоединения (c), [2 + 1] циклоприсоединений (d, gи h ), [4 + 1] циклоприсоединения (a ), а также простые депротонирования. Реакции вставки (b ), вероятно, протекают посредством депротонирования, что приводит к образованию нуклеофила (XR), который может атаковать образовавшуюся соль, создавая впечатление вставки H-X.
Был опрошен зарегистрированный стабильный изотиазол карбен (2 ), полученный из перхлората изотиазолия (1 ), которые смогли выделить только 2 -имино-2H-тиет (4 ). Промежуточное соединение 3 было предложено посредством реакции перегруппировки. Этот карбен больше не считается стабильным.

Было показано, что имидазол-2-илидены, триазол-5-илидены (и в меньшей степени диаминокарбены) связаны с множеством элементов, из щелочных металлов, элементов основной группы, переходных металлов и даже лантаноидов и актинидов. Периодическая таблица элементов дает некоторое представление о комплексах, которые были получены, и во многих случаях они были идентифицированы с помощью монокристалла рентгеновской кристаллографии. Считается, что стабильные карбены ведут себя аналогично органофосфинам по своим свойствам координации с металлами. Эти лиганды считаются хорошими σ-донорами через карбеновую неподеленную пару, но плохими π-акцепторами из-за внутреннего лиганда обратного донорства от атомов азота, соседних с карбеновым центром, и, таким образом, способны координировать свои действия даже с металлами с относительно дефицитом электронов. Эндерс и Херманн показали, что эти карбены являются подходящими заменами для фосфиновых лигандов в нескольких каталитических циклах. Хотя они обнаружили, что эти лиганды не активируют металлический катализатор в такой степени, как фосфиновые лиганды, они часто приводят к более надежным катализаторам. Несколько каталитических систем были изучены Германом и Эндерсом с использованием катализаторов, содержащих имидазольные и триазол-карбеновые лиганды, с умеренным успехом. Граббс сообщил о замене фосфинового лиганда (PCy 3) на имидазол-2-илиден в катализаторе метатезиса олефинов RuCl 2 (PCy 3)2CHPh, и отметили повышенный метатезис с замыканием цикла, а также проявление «замечательной устойчивости к воздуху и воде».Молекулы, содержащие два и три карбеновых фрагмента, были получены в качестве потенциальных бидентатных и тридентатных карбеновых лигандов. 593>Периодическая таблица (стойкий карбен)
Карбены могут быть стабилизированы как металлоорганические разновидности Эти карбеновые комплексы переходных металлов делятся на две категории:
Стойкие карбены в триплетном состоянии, вероятно, будут иметь очень такую же реакционную способность, как и другие нестойкие триплетные состояния карбены.

Карбены, которые были выделены на сегодняшний день, обычно представляют собой бесцветные твердые вещества с низкими температурами плавления. Эти карбены имеют тенденцию к сублимации при низких температурах в высоком вакууме.
Одним из наиболее полезных физических свойств является диагностический химический сдвиг карбенового атома углерода в спектре C- ЯМР. Обычно этот пик находится в диапазоне от 200 до 300 м.д., где несколько других пиков появляются в спектре C- ЯМР. Слева показан пример циклического диаминокарбена, пик карбеновой кислоты которого составляет 238 частей на миллион.
При координации с металлическими центрами резонанс C-карбена обычно смещается в сильное поле в зависимости от кислотности Льюиса сложного фрагмента. Основываясь на этом наблюдении, Huynh et al. разработали новую методологию для определения силы донора лиганда с помощью анализа C ЯМР комплексов транс-палладий (II) -карбен. Использование C-меченного N-гетероциклического карбенового лиганда также позволяет изучать смешанные карбен-фосфиновые комплексы, которые подвергаются транс-цис-изомеризации из-за транс-эффекта.
 Граббса второго поколения Катализатор.
Граббса второго поколения Катализатор. NHC широко используются в качестве вспомогательного лиганда в металлоорганической химии. Одним из практических приложений является основанный на рутении катализатор Граббса и комплексы NHC-палладий для реакций кросс-сочетания. Комплексы NHC-металл, в частности комплексы Ag (I) -NHC, широко тестировались для их биологических применений.
NHC часто бывают сильно основными (<Значение 557>pKa конъюгированной кислоты имидазол-2-илидена измеряли приблизительно при 24) и реагировали с кислородом. Очевидно, что эти реакции проводят с использованием безвоздушных методов, избегая соединений даже с умеренной кислотностью. Хотя соли имидазолия устойчивы к нуклеофильному присоединению, другие неароматические соли - нет (например, формамидиний соли).
В этих случаях следует избегать сильных беспрепятственных нуклеофилов, если они образуются на месте или присутствуют в качестве примеси в других реагентах (например, LiOH в BuLi).
Несколько подходов были разработаны для получения стабильных карбенов, они описаны ниже.
Депротонирование солей-предшественников карбена с помощью сильных оснований оказалось надежным путем практически ко всем стабильным карбенам:
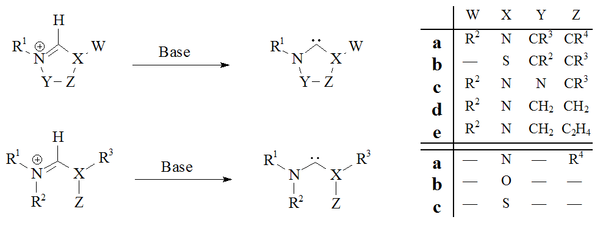 Депротонирование солей-предшественников с образованием стабильных карбенов.
Депротонирование солей-предшественников с образованием стабильных карбенов. Имидазол-2 -илидены и дигидроимидазол-2-илидены, например IM, были получены депротонированием соответствующего имидазолия и солей. Ациклические карбены и карбены на основе тетрагидропиримидинил получали депротонированием с использованием сильных гомогенных оснований.
Несколько оснований и условий реакции использовали с переменным успехом. Степень успеха главным образом зависит от природы депротонируемого предшественника . Основным недостатком этого способа получения является проблема отделения свободного карбена от ионов металлов, используемых при их получении.
Можно было бы подумать, что натрий или гидрид калия был бы идеальным основанием для депротонирования этих солей-предшественников. Гидрид должен необратимо реагировать с потерей водорода с образованием желаемого карбена с неорганическими побочными продуктами и избыточным гидридом, удаляемыми фильтрацией. На практике эта реакция часто протекает слишком медленно и требует добавления ДМСО или трет-BuOH. Эти реагенты генерируют растворимые катализаторы, которые увеличивают скорость реакции этой гетерогенной системы за счет образования трет-бутоксида или димсил-аниона. Однако эти катализаторы оказались неэффективными для получения неимидазолиевых аддуктов, поскольку они имеют тенденцию действовать как нуклеофилы по отношению к солям-предшественникам и при этом разрушаются. Присутствие ионов гидроксида в качестве примеси в гидриде металла также может разрушать неароматические соли.
Депротонирование с помощью натрия или калия гидрида в смеси жидкого аммиака / ТГФ при –40 ° C было зарегистрировано для основанных на имидазоле карбены. Ардуенго и его коллегам удалось получить дигидроимидазол-2-илиден, используя NaH. Однако этот метод не применялся для получения диаминокарбенов. В некоторых случаях трет-бутоксид калия можно использовать без добавления гидрида металла.
Использование алкиллитий в качестве сильнодействующего оснований не было широко изучено и было ненадежным для депротонирования солей-предшественников. С неароматическими солями n-BuLi и PhLi могут действовать как нуклеофилы, в то время как t-BuLi может иногда действовать как источник гидрида, восстанавливая соль с образованием изобутена :
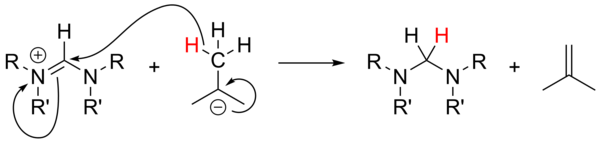 Восстановление формамидиния соли трет-бутиллития
Восстановление формамидиния соли трет-бутиллития Амиды лития, такие как диизопропиламид (LDA) и (тетраметилпиперидид (LiTMP) ), как правило, хорошо подходят для депротонирование всех типов солей при условии, что не слишком много LiOH присутствует в н-бутиллитии, используемом для получения амида лития. Титрование амида лития можно использовать для определения количества гидроксида в растворе. Депротонирование солей-предшественников с помощью гексаметилдисилазидов металлов очень чисто работает для депротонирования всех типов солей, за исключением беспрепятственных солей формамидиния, где это основание может действовать как нуклеофил, давая аддукт триаминометана.

Стремление к получению стабильных карбенов, свободных от катионов металлов, является предметом пристального внимания, чтобы позволить дальнейшее изучение карбеновых разновидностей отдельно от этих металлов. Отделение карбена от комплекса карбен-металл может быть проблематичным из-за стабильности комплекса. Соответственно, предпочтительно, чтобы карбен в первую очередь не содержал этих металлов. В самом деле, некоторые ионы металлов, а не стабилизация карбена, участвовали в каталитической димеризации беспрепятственных примеров.
Справа показана рентгеновская структура, показывающая комплекс между диаминокарбеном и калием HMDS. Этот комплекс был образован, когда избыток KHMDS использовали в качестве сильного основания для депротонирования соли формамидиния. Удаление ионов лития в результате депротонирования с помощью таких реагентов, как диизопропиламид лития (LDA), может быть особенно проблематичным. Побочные продукты соли калия и натрия имеют тенденцию осаждаться из раствора и могут быть удалены. Ионы лития могут быть химически удалены путем связывания с такими видами, как криптанды или краун-эфиры.
Безметалловые карбены были получены несколькими способами, как указано ниже:
Другой подход к получению карбенов основан на десульфурации тиомочевин с калием в ТГФ. Фактором, способствующим успеху этой реакции, является то, что побочный продукт, сульфид калия, нерастворим в растворителе. Повышенные температуры свидетельствуют о том, что этот метод не подходит для получения нестабильных димеризующихся карбенов. Также сообщалось об единственном примере деоксигенации мочевины карбеном, производным флуорена с образованием тетраметилдиаминокарбена и флуоренона:
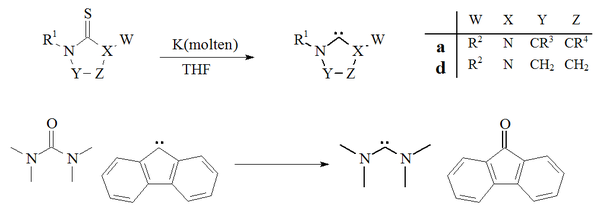 Получение карбенов с помощью дехалькогенизация
Получение карбенов с помощью дехалькогенизация десульфурация тиомочевин расплавленным калием с получением имидазол-2-илиденов или диаминокарбенов не получила широкого распространения. Этот метод был использован для получения карбенов дигидроимидазола.
Вакуумный пиролиз с удалением нейтральных летучих побочных продуктов (CH 3 OH, CHCl 3), использовался для получения карбенов на основе дигидроимидазола и триазола:
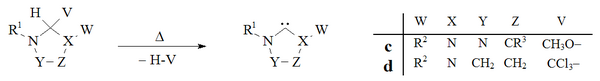 Получение карбенов посредством вакуумного пиролиза
Получение карбенов посредством вакуумного пиролиза Исторически сложилось так, что удаление хлороформа вакуумным пиролизом d Аддукты использовались Ванзликом в его ранних попытках получить дигидроимидазол-2-илидены, но этот метод не получил широкого распространения. Лаборатория Эндерса использовала вакуумный пиролиз аддукта c для получения триазолий-5-илидена c.
бис (триметилсилил) ртути (CH 3)3Si -Hg-Si (CH 3)3реагирует с солями хлор- иминия и хлор- амидиния с образованием безметаллового карбена и элементарной ртути. Например,, (CH 3)3Si-Hg-Si (CH 3)3+ R 2 N = C (Cl) -NR 2 Cl → R 2 NC: -NR 2 + Hg (l) + (CH 3)3Si-Cl
Стойкие карбены в триплетном состоянии имеют был получен фотохимическим разложением диазометанового продукта путем вытеснения газообразного азота при длине волны 300 нм в бензоле.
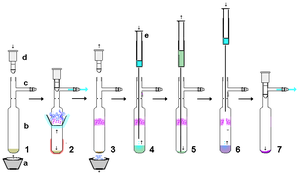
Стабильные карбены представляют собой очень реакционноспособен, поэтому при использовании безвоздушных технологий желательно минимальное количество операций. Однако при условии использования строго сухих, относительно некислотных и безвоздушных материалов стабильные карбены достаточно устойчивы к обработка как таковая. Например, стабильный карбен, полученный из гидрида калия, может быть отфильтрован через сухую подушку из целита для удалить из реакции избыток KH (и образующиеся соли). В относительно небольших масштабах суспензии, содержащей стабильный карбен в растворе, можно дать возможность осесть, а надосадочный раствор протолкнуть через высушенную мембрану шприцевой фильтр. Стабильные карбены легко растворимы в неполярных растворителях, таких как гексан, и поэтому обычно перекристаллизация стабильных карбенов может быть затруднена из-за отсутствия подходящих некислотных полярных растворителей. Безвоздушная сублимация, как показано справа, может быть эффективным методом очистки, хотя предпочтительны температуры ниже 60 ° C в высоком вакууме, поскольку эти карбены относительно летучие и также могут начать разлагаться при этих более высоких температурах. Действительно, сублимация в некоторых случаях может давать монокристаллы, пригодные для рентгеноструктурного анализа. Однако сильное комплексообразование с ионами металлов, таких как литий, в большинстве случаев предотвращает сублимацию.
Обзоры стойких карбенов:
За обзор физико-химических свойств (электроника, стерика,...) N-гетероциклических карбенов: