 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1, 3,5,2,4,6-Триазатриборинан (только предварительно выбран) | |||
| Другие названия Циклотриборазанборазол | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.169.303 | ||
| PubChem CID | |||
| UNII | |||
| Панель управления CompTox (EPA ) | |||
InChI
| |||
УЛЫБКИ
| |||
| Свойства | |||
| Химические формула | B3H6N3 | ||
| Молярная масса | 80,50 г / моль | ||
| Внешний вид | Бесцветная жидкость | ||
| Плотность | 0,81 г / см | ||
| Температура плавления | -58 ° C (-72 ° F; 215 K) | ||
| Температура кипения | 53 ° C (127 ° F; 326 K) (55 ° C при 105 Па) | ||
| Магнитная восприимчивость (χ) | -49,6 · 10 см / моль | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) |  2 2 1 2 2 1 | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в информационном окне | |||
Боразин, также известный как боразол, является полярным неорганическое соединение с химической формулой B3H6N3. В этом циклическом соединении три звена BH и три звена NH чередуются. Соединение изоэлектронно и изоструктурно с бензолом. По этой причине боразин иногда называют «неорганическим бензолом». Как и бензол, боразин представляет собой бесцветную жидкость.
О соединении сообщили в 1926 году химики Альфред Сток и Эрих Поланд при реакции диборана с аммиаком.
Боразин синтезируется из диборана. и аммиак в соотношении 1: 2 при 250–300 ° C с конверсией 50%.
Альтернативный более эффективный путь начинается с боргидрида лития и аммония хлорид :
В двухстадийном процессе до боразина Трихлорид бора сначала превращается в трихлорборазин:
Связи B-Cl впоследствии превращаются в связи BH:
Боразин - бесцветная жидкость с ароматным запахом. В воде он гидролизует до борной кислоты, аммиака и водорода. Боразин с стандартным изменением энтальпии образования ΔHf, составляющим -531 кДж / моль, термически очень стабилен.
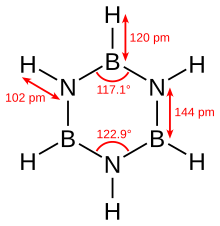
Боразин изоэлектронен с бензолом и имеет аналогичную связность, поэтому его иногда называют «неорганическим бензолом». Это сравнение не является строго достоверным из-за разницы в электроотрицательности между бором и азотом. Рентгеноструктурные структурные определения показывают, что все длины связей в боразиновом кольце эквивалентны при 1,429 Å, что характерно для бензола. Однако кольцо из боразина не образует идеального шестиугольника. Валентный угол составляет 117,1 ° у атомов бора и 122,9 ° у атомов азота, что придает молекуле отчетливую симметрию.
электроотрицательность бора (2,04 по шкале Полинга ) по сравнению с азотом (3,04), а также дефицит электронов на атом бора и неподеленная пара у азота благоприятствуют альтернативным структурам мезомера для боразина.
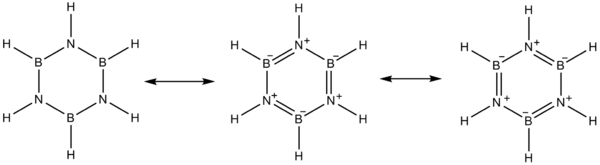
Бор ведет себя как кислота Льюиса, а азот ведет себя как основание Льюиса.
Из-за его сходства с бензолом был проведен ряд расчетов и экспериментальный анализ ароматичности боразина. Число пи-электронов в боразине подчиняется правилу 4n + 2, а длины связей B-N равны, что предполагает, что соединение может быть ароматическим. Разница в электроотрицательности между бором и азотом, однако, создает неравное распределение заряда, что приводит к связям с более сильным ионным характером, и, таким образом, ожидается, что он будет иметь более слабую делокализацию электронов, чем полностью углеродный аналог.
Natural Bond Orbital (NBO) анализ показывает слабую ароматичность боразина. В модели NBO связи B-N в кольце немного смещены от ядерных осей, а B и N имеют большие различия в заряде. (NCS) анализ предоставляет некоторые дополнительные доказательства ароматичности, основанные на вкладе π-связи B-N в магнитное экранирование. Расчеты, основанные на орбиталях NBO, показывают, что эта π-связь допускает слабый кольцевой ток, который несколько противодействует магнитному полю, моделируемому в центре боразинового кольца. Небольшой кольцевой ток предполагает некоторую делокализацию.
Топологический анализ связывания в боразине с помощью функции локализации электронов (ELF) показывает, что боразин может быть описан как π ароматическое соединение. Однако связь в боразине менее делокализована, чем в бензоле, из-за разницы в значениях бифуркации электронных бассейнов. Большие значения бифуркации указывают на лучшую делокализацию электронов, и утверждается, что, когда это значение бифуркации больше, чем 0,70, делокализации достаточно для обозначения соединения ароматического соединения. Для бензола это значение составляет 0,91, но π-система боразина разветвляется при значении ELF 0,682. Это вызвано разницей в электроотрицательности между B и N, которая вызывает более слабое взаимодействие связей, чем взаимодействие C-C в бензоле, что приводит к повышенной локализации электронов на звеньях B-H и N-H. Значение бифуркации немного ниже предела 0,70, что предполагает умеренную ароматичность.
Хотя боразин часто сравнивают с бензолом, он намного более активен. С хлористым водородом он образует аддукт, тогда как бензол не реагирует с HCl.
 Полиборазилен
Полиборазилен Реакция присоединения с бромом не требует катализатора. Боразины подвергаются нуклеофильной атаке бором и электрофильной атаке при азоте. Нагревание боразина при 70 ° C вытесняет водород с образованием боразинил полимера или полиборазилена, в котором мономерные звенья парафином связаны новыми связями бор-азот. Нитрид бора может быть получен нагреванием полиборазилена до 1000 ° C.Боразины также являются исходными материалами для других потенциальных керамик, таких как карбонитриды бора. Боразин также может быть использован в качестве прекурсора для выращивания гаксагонального нитрида бора (h-BN) тонкие пленки и отдельные слои на каталитических поверхностях, таких как медь, платина, никель, железо и многие другие, с помощью химического осаждения из паровой фазы (CVD).

Предложен полиборазилен d в качестве переработанной среды для хранения водорода для водородных топливных элементов транспортных средств, с использованием процесса «одного котла» для разложения и восстановления для воссоздания борана аммиака.
Среди прочего Соединения типа BN, смешанные с амино-нитрозамещенными боразинами, будут превосходить взрывчатые вещества на основе углерода, такие как CL-20.
(C. 2H. 2B. 2N. 2) представляют собой шестичленное ароматическое кольцо с двумя атомами углерода, двумя атомами азота, и два атома бора в противоположных парах.
1,2-дигидро-1,2-азаборин (C. 4BNH. 6) представляет собой шестичленное кольцо с четырьмя атомами углерода, одним атомом азота и одним атомом бора.
![]() СМИ, связанные с боразином на Wikimedia Commons
СМИ, связанные с боразином на Wikimedia Commons