 | |||
| |||
| Названия | |||
|---|---|---|---|
| Название IUPAC Фосфан | |||
| Другое названия Фосфамин. Тригидрид фосфора. Фосфорированный водород | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.328 | ||
| Номер ЕС |
| ||
| Справочник Гмелина | 287 | ||
| PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2199 | ||
| Панель управления CompTox (EPA ) | |||
InChI
| |||
УЛЫБКИ
| |||
| Свойства | |||
| Химическая формула | PH3 | ||
| Молярная масса | 33,99758 г / моль | ||
| Внешний вид | Бесцветный газ | ||
| Запах | рыба- подобный или похожий на чеснок | ||
| Плотность | 1,379 г / л, газ (25 ° C) | ||
| Температура плавления | -132,8 ° C (-207,0 ° F; 140,3 K) | ||
| Температура кипения | -87,7 ° C (-125,9 ° F; 185,5 K) | ||
| Растворимость в воде | 31,2 мг / 100 мл (17 ° C) | ||
| Растворимость | Растворим в спирте, эфир, CS2. слабо растворим в бензоле, хлороформе, этаноле | ||
| Конъюгированная кислота | Фосфоний (химическая формула PH. 4) | ||
| Показатель преломления (nD) | 2,144 | ||
| Вязкость | 1,1 × 10 Па⋅с | ||
| Структура | |||
| Молекулярная форма | Тригонально-пирамидальная | ||
| Дипольный момент | 0,58 D | ||
| Термохимия | |||
| Тепло емкость (C) | 37 Дж / моль⋅K | ||
| Стандартная молярная. энтропия (S 298) | 210 Дж / моль⋅K | ||
| Стандартная энтальпия. образование (ΔfH298) | 5 кДж / моль | ||
| свободная энергия Гиббса (ΔfG˚) | 13 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | ICSC 0694 | ||
| Пиктограммы GHS |     | ||
| NFPA 704 (огненный алмаз) |  4 4 2 4 4 2 | ||
| Температура вспышки | Горючий газ | ||
| Самовоспламенение. Температура | 38 ° C (100 ° F; 311 K) (см. текст) | ||
| Пределы взрываемости | 1,79–98% | ||
| Смертельная доза или концентрация (LD, LC): | |||
| LD50(средняя доза ) | 3,03 мг / кг (крыса, перорально) | ||
| LC50(м концентрация эдиана ) | 11 частей на миллион (крыса, 4 часа) | ||
| LCLo(самая низкая опубликованная ) | 1000 частей на миллион (млекопитающее, 5 минут). 270 частей на миллион (мышь, 2 часа). 100 частей на миллион (морская свинка, 4 ч). 50 частей на миллион (кошка, 2 часа). 2500 частей на миллион (кролик, 20 минут). 1000 частей на миллион (человек, 5 минут) | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
| PEL (допустимое) | TWA 0,3 ppm (0,4 мг / м) | ||
| REL (рекомендуется) | TWA 0,3 ppm (0,4 мг / м), ST 1 ppm (1 мг / м) | ||
| IDLH (Непосредственная опасность) | 50 ppm | ||
| Родственные соединения | |||
| Другие катионы | |||
| Родственные соединения | |||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа | |||
| Ссылки в информационном окне | |||
Фосфин (ИЮПАК название: фосфан ) - бесцветный, легковоспламеняющееся, очень токсичное газовое соединение с химической формулой PH3, классифицируемое как гидрид пниктогена. Чистый фосфин не имеет запаха, но образцы технической степени имеют очень неприятный запах, как у гниющей рыбы, из-за присутствия замещенного фосфина и дифосфана (P2H4). При наличии следов P 2H4PH 3 самовоспламеняется на воздухе (пирофорный ), горит светящимся пламенем.
Фосфин также является общим названием класса фосфорорганических соединений замещенных фосфанов - класса фосфанов, в которых атомы водорода заменены органическими производными, имеющую общую формулу PR 3. Органофосфины важны в катализаторах, где они образуют комплекс (сцепляются) с ионами различных металлов; комплексы, полученные из хирального фосфина, могут катализировать реакции с образованием хиральных, энантиообогащенных продуктов.
Philippe Gengembre (1764–1838), a ученик Лавуазье впервые получил фосфин в 1783 году путем нагревания белого фосфора в водном растворе поташа (карбонат калия).
Возможно, потому что из-за его сильной связи с элементарным фосфором, фосфин когда-то считался газообразной формой элемента, но Лавуазье (1789) распознал его как комбинацию фосфора с водородом и описал его как фосфор ure d'hydrogène (фосфид водорода).
В 1844 году Поль Тенар, сын французского химика Луи Жака Тенара, использовал холодную ловушку для отделения дифосфина из фосфина, который был образован из фосфида кальция, тем самым демонстрируя, что P 2H4отвечает за спонтанное воспламенение, связанное с PH 3, а также за характерный оранжевый / коричневый цвет, который может образуются на поверхностях, что является продуктом полимеризации. Он считал формулу дифосфина PH 2 и, таким образом, промежуточным звеном между элементарным фосфором, высшими полимерами и фосфином. Фосфид кальция (номинально Ca 3P2) производит больше P 2H4, чем другие фосфиды, из-за преобладания связей P-P в исходном материале.
Название «фосфин» впервые было использовано для фосфорорганических соединений в 1857 году, будучи аналогом органических аминов (NR 3). PH 3 газа был назван "фосфином" в 1865 г. (или ранее).
PH3представляет собой тригонально-пирамидальную молекулу с C 3vмолекулярная симметрия. длина связи P-H составляет 1,42 Å, валентные углы H-P-H составляют 93,5 °. дипольный момент равен 0,58 D, который увеличивается при замещении метильных групп в ряду: CH 3PH2, 1,10 D; (CH 3)2PH, 1,23 D; (CH 3)3P, 1,19 D. Напротив, дипольные моменты аминов уменьшаются при замещении, начиная с аммиака, который имеет дипольный момент 1,47 D. Низкий дипольный момент и почти ортогональные валентные углы приводят к выводу, что в PH 3 связи P − H почти полностью являются pσ (P) - sσ (H), а 3s-орбиталь фосфора вносит небольшой вклад в связывание между фосфором и водородом в этой молекуле. По этой причине неподеленную пару на фосфоре можно рассматривать как преимущественно образованную 3s-орбиталью фосфора. Сверхпольный химический сдвиг атома фосфора в спектре ЯМР P соответствует с выводом о том, что электроны неподеленной пары занимают 3s-орбиталь (Fluck, 1973). Эта электронная структура приводит к отсутствию нуклеофильности в целом и отсутствию основности в частности (pK aH = –14), а также способность образовывать только слабые водородные связи.
Водная растворимость PH 3 мала; 0,22 см газа растворяется в 1 см воды. Фосфин легче растворяется в неполярных растворителях, чем в воде, из-за неполярных связей P-H. Технически он амфотерный в воде, но его кислотная и основная активность низкая. Протонный обмен происходит через ион фосфония (PH. 4) в кислых растворах и через (PH. 2) при высоком pH с константами равновесия K b = 4 × 10 и K a = 41,6 × 10.
Ожоги фосфина с образованием плотного белого облака фосфорной кислоты :
Можно получить фосфин разными способами. Промышленно он может быть получен реакцией белого фосфора с гидроксидом натрия или калия с получением или гипофосфита натрия в качестве побочного продукта..
В качестве альтернативы, катализируемое кислотой диспропорционирование белый фосфор дает фосфорную кислоту и фосфин. Оба маршрута имеют промышленное значение; кислотный путь является предпочтительным методом, если необходима дальнейшая реакция фосфина на замещенные фосфины. Кислотный путь требует очистки и повышения давления. Его также можно получить (как описано выше) гидролизом фосфида металла, такого как фосфид алюминия или фосфид кальция. Чистые образцы фосфина, не содержащие P 2H4, могут быть получены с использованием действия гидроксида калия на иодид фосфония (PH 4 I).
Его получают в лаборатории путем диспропорционирования фосфористой кислоты
Выделение фосфина происходит при температуре около 200 ° C. Альтернативные методы включают гидролиз фосфида алюминия, фосфида кальция и трис (триметилсилил) фосфина.
Фосфин является составной частью Земли. атмосфера при очень низких и очень изменчивых концентрациях. Он может вносить значительный вклад в глобальный биохимический цикл фосфора. Наиболее вероятным источником является уменьшение фосфата в разлагающемся органическом веществе, возможно, за счет частичного восстановления и диспропорционирования, поскольку экологические системы не имеют известных восстанавливающих агентов достаточной силы. для прямого преобразования фосфата в фосфин.
Он также находится в турбулентной атмосфере Юпитера, где он образуется в горячих недрах планеты и вступает в реакцию с другими соединениями в верхних слоях атмосферы. Абиотический синтез фосфина требует огромного количества энергии, например, в конвективных штормах газовых гигантов размером с планету.
Фосфин также был обнаружен в умеренной зоне атмосфера Венеры (высота примерно 50 км (31 миль)) при 20 ppb, концентрация, которая невозможна с помощью известных химических процессов. На Венере не хватает высоких температур и давления для образования фосфина, как это делают газовые гиганты, такие как Юпитер; таким образом, требуется другое объяснение его присутствия. Не ожидается, что фосфин будет оставаться в атмосфере Венеры, поскольку, подвергаясь ультрафиолетовому излучению, он в конечном итоге будет потребляться водой и двуокисью углерода; таким образом, его нужно будет пополнить. В документе, объявляющем об открытии, предполагается, что фосфин «мог происходить из неизвестной фотохимии или геохимии, или, по аналогии с биологическим производством PH 3 на Земле, из-за наличия жизни». По этой причине было предложено использовать фосфин в качестве биосигнатуры для астробиологии. PH 3 связан с анаэробными экосистемами на Земле, что может указывать на существование жизни на бескислородных экзопланетах. По состоянию на 2020 год ни один известный абиотический процесс не генерирует фосфиновый газ на планетах земной группы в заметных количествах, поэтому обнаруживаемые количества фосфина могут указывать на наличие жизни. В частности, согласно оригинальному исследованию: «Фосфин является многообещающим биосигнатурным газом, поскольку он не имеет известных абиотических ложных срабатываний на планетах земной группы из любого источника, который мог бы генерировать высокие потоки, необходимые для обнаружения».
Органофосфины представляют собой соединения формулы PR nH3-n. Эти соединения часто классифицируются по значению n: первичные фосфины (n = 1), вторичные фосфины (n = 2), третичные фосфины (n = 3). Все имеют пирамидальную структуру. Их реакционная способность также аналогична - они могут окисляться до уровня фосфора (V), они могут быть протонированы и алкилированы по фосфору с образованием солей фосфония, а для первичных и вторичных производных они могут быть депротонированы сильные основания с образованием органо фосфидных производных.
Первичные фосфины обычно получают алкилированием фосфина. Простые алкильные производные, такие как метилфосфин (CH 3PH2), получают путем алкилирования производных щелочного металла MPH 2 (M равно Li, Na или K ). Другой путь синтеза включает обработку соответствующих хлорфосфинов гидридными реагентами. Например, восстановление дихлорфенилфосфина с помощью алюмогидрида лития дает фенилфосфин (PhPH 2).
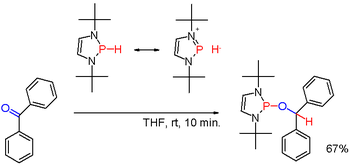
Вторичные фосфины получают аналогично первичным фосфинам. Их также получают восстановительным расщеплением триарилфосфинов щелочным металлом с последующим гидролизом образующейся фосфидной соли. Последний путь используют для получения дифенилфосфина (Ph 2 PH). Диорганофосфиновые кислоты, R 2 P (O) OH, также могут быть восстановлены с помощью диизобутилалюминийгидрида. Вторичные фосфины обычно имеют протонный характер. Но при модификации подходящими заместителями, как в некоторых (редких) диазафосфоленах (схема 3), полярность связи PH может быть инвертирована (см.: umpolung ) и образовавшийся фосфин гидрид может восстанавливать карбонильную группу, как в примере бензофенона, еще одним способом.
Третичные фосфины обычно получают обработкой трихлоридом фосфора или трифенилфосфит с литийорганическими реагентами или реактивами Гриньяра. Они обычно используются в качестве лигандов в координационной химии. Третичные фосфины типа PRR'R ″ являются «P-хиральными » и оптически стабильны.
Вторичные и третичные фосфины встречаются в циклических формах. Трехчленные кольца представляют собой фосфираны (ненасыщенные: фосфирены ), пятичленные кольца представляют собой фосфоланы (ненасыщенные: фосфол ) и шесть -членные кольца представляют собой фосфинаны.
Фосфин является предшественником многих фосфорорганических соединений. Он реагирует с формальдегидом в присутствии хлористого водорода с образованием хлорида тетракис (гидроксиметил) фосфония, который используется в текстильных изделиях. гидрофосфинирование алкенов представляет собой универсальный путь к множеству фосфинов. Например, в присутствии основных катализаторов PH 3 добавляет акцепторов Михаэля, таких как акрилонитрил :
Кислотный катализ применим к гидрофосфинированию с помощью изобутилена и родственных аналогов:
Фосфин используется в качестве легирующей примеси в полупроводниковой промышленности и в качестве прекурсора для осаждения сложных полупроводников.. К коммерчески значимым продуктам относятся фосфид галлия и фосфид индия.
Для сельскохозяйственного использования гранулы фосфида алюминия, фосфид кальция или фосфид цинка выделяют фосфин при контакте с атмосферной водой или кислотой желудка грызунов. Эти гранулы также содержат вещества, снижающие вероятность возгорания или взрыв выпусков эд фосфин. Более свежей альтернативой является использование самого газообразного фосфина, который требует разбавления либо CO 2, либо N 2, или даже воздухом, чтобы довести его до температуры ниже точки воспламеняемости. Использование газа позволяет избежать проблем, связанных с твердыми остатками фосфида металла, и приводит к более быстрой и эффективной борьбе с целевыми вредителями.
Поскольку ранее популярный фумигант бромистый метил был прекращен в некоторых странах в соответствии с Монреальским протоколом, фосфин является единственным широко используемым, экономичный, быстродействующий фумигант, не оставляющий следов на хранящемся продукте. Вредители с высоким уровнем устойчивости к фосфину стали обычным явлением в Азии, Австралии и Бразилии. Высокий уровень резистентности также может возникать в других регионах, но это не так тщательно отслеживается. Генетические варианты, которые способствуют высокому уровню устойчивости к фосфину, были идентифицированы в гене дигидролипоамиддегидрогеназы. Идентификация этого гена теперь позволяет быстро идентифицировать устойчивых насекомых на молекулярном уровне.
Газообразный фосфин плотнее воздуха и, следовательно, может накапливаться в низинных областях. Он может образовывать взрывоопасные смеси с воздухом, а также может самовоспламеняться.
Фосфин может всасываться в организм при вдыхании. Прямой контакт с жидкостью фосфина - хотя и маловероятен - может вызвать обморожение, как и другие криогенные жидкости. Основным органом-мишенью газообразного фосфина являются дыхательные пути. В соответствии с карманным справочником Национального института охраны труда (NIOSH) США 2009 г. и правилами Управления по охране труда (OSHA) США , среднее 8-часовое воздействие на органы дыхания не должно превышает 0,3 промилле. NIOSH рекомендует, чтобы кратковременное воздействие на дыхательные пути газообразного фосфина не превышало 1 ppm. Уровень Немедленная опасность для жизни или здоровья составляет 50 частей на миллион. Чрезмерное воздействие газообразного фосфина вызывает тошноту, рвоту, боль в животе, диарею, жажду, стеснение в груди, одышку (затрудненное дыхание), боль в мышцах, озноб, ступор или обморок, а также отек легких. Сообщалось, что фосфин имеет запах гниющей рыбы или чеснока при концентрациях ниже 0,3 ppm. Запах обычно ограничен лабораторными помещениями или производством фосфина, поскольку запах исходит от способа извлечения фосфина из окружающей среды. Однако это может произойти и в другом месте, например, на свалках промышленных отходов. Воздействие более высоких концентраций может вызвать обонятельную усталость.
Смерть наступила в результате случайного воздействия фумигационных материалов, содержащих фосфид алюминия или фосфин. Он может всасываться либо при ингаляции, либо трансдермально. Как респираторный яд, он влияет на транспорт кислорода или препятствует его использованию различными клетками организма. Воздействие приводит к отеку легких (легкие наполняются жидкостью). Газообразный фосфин тяжелее воздуха, поэтому остается ближе к полу.
Фосфин, по-видимому, в основном является редокс-токсином, вызывающим повреждение клеток, вызывая окислительный стресс и митохондриальную дисфункцию. Устойчивость насекомых вызвана мутацией в митохондриальном метаболическом гене.
| Викискладе есть материалы, связанные с фосфином. |