A циклоприсоединение представляет собой химическую реакцию, в которой «две или несколько ненасыщенных молекул (или частей одной и той же молекулы) объединяются с образованием циклического аддукта, в котором происходит чистое уменьшение кратности связи». Получающаяся в результате реакция представляет собой реакцию циклизации. Многие, но не все циклоприсоединения являются согласованными и, следовательно, перициклическими. Неконцентрированные циклоприсоединения не являются перициклическими. Как класс реакции присоединения, циклоприсоединения допускают образование углерод-углеродной связи без использования нуклеофила или электрофила.
Циклоприсоединения могут быть описаны с использованием двух систем обозначений. Старые, но все еще распространенные обозначения основаны на размере линейного расположения атомов в реагентах. Он использует круглые скобки : (i + j +...), где переменные - это количество линейных атомов в каждом реагенте. Товар представляет собой цикл размера (i + j +...). В этой системе стандартная реакция Дильса-Альдера представляет собой (4 + 2) -циклоприсоединение, 1,3-диполярное циклоприсоединение представляет собой (3 + 2) -циклоприсоединение и циклопропанирование карбена с алкеном a (2 + 1) -циклоприсоединение.
Более недавнее, предпочтительное обозначение IUPAC, впервые введенное Woodward и Хоффманн использует квадратные скобки для обозначения количества электронов, а не атомов углерода, участвующих в образовании продукта. В обозначении [i + j +...] стандартная реакция Дильса-Альдера представляет собой [4 + 2] -циклоприсоединение, в то время как 1,3-диполярное циклоприсоединение также является [4 + 2] -циклоприсоединением.
Термические циклоприсоединения те циклоприсоединения, в которых реагенты находятся в основном электронном состоянии. У них обычно есть (4n + 2) π-электронов, участвующих в исходном материале, для некоторого целого числа n. Эти реакции возникают по причинам орбитальной симметрии в супрафациальном -супрафациальном или антарафациальном -антарафациальном способе (редко). Есть несколько примеров термического циклоприсоединения, которые имеют 4n π-электронов (например, [2 + 2] -циклоприсоединение). Они протекают в супрафациально-антарафациальном смысле, например, димеризация кетена, в которой ортогональный набор p-орбиталей позволяет реакции протекать через скрещенные переходное состояние.
Циклоприсоединения, в которых участвуют 4n π-электронов, также могут происходить посредством фотохимической активации. Здесь один компонент имеет электрон, продвинутый из HOMO (π-связь) в LUMO (π * антисвязывание ). Таким образом, орбитальная симметрия такова, что реакция может протекать супрафациально-надфасциальным образом. Примером может служить реакция ДеМайо. Другой пример показан ниже, фотохимическая димеризация коричной кислоты. Два транс алкена взаимодействуют голова к хвосту, и изолированные изомеры называются труксилловыми кислотами.

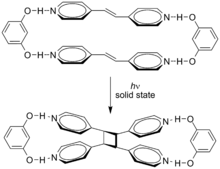 циклоприсоединением транс-1,2-бис (4-пиридил) этен
циклоприсоединением транс-1,2-бис (4-пиридил) этен Супрамолекулярные эффекты могут влиять на эти циклоприсоединения. Циклоприсоединение транс-1,2-бис (4-пиридил) этена направляется резорцином в твердом состоянии с выходом 100% .
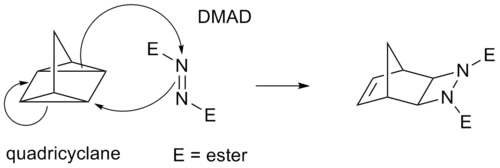
Вместо этого некоторые циклоприсоединения π-связей действуют через напряженные кольца циклопропана, поскольку они имеют значительный π-характер. Например, аналогом реакции Дильса-Альдера является реакция квадрициклана - DMAD :
В обозначениях (i + j +...) циклоприсоединения i и j относятся к число атомов, участвующих в циклоприсоединении. В этих обозначениях реакция Дильса-Альдера представляет собой (4 + 2) циклоприсоединение, а 1,3-диполярное присоединение, такое как первая стадия в озонолизе, представляет собой (3 + 2) циклоприсоединение. Однако предпочтительное обозначение IUPAC с [i + j +...] учитывает электроны, а не атомы. В этих обозначениях реакция DA и диполярная реакция становятся [4 + 2] циклоприсоединением. Реакция между норборнадиеном и активированным алкином представляет собой [2 + 2 + 2] циклоприсоединение.
Реакция Дильса-Альдера, пожалуй, наиболее важная и широко распространенная реакция циклоприсоединения. Формально это реакция [4 + 2] циклоприсоединения, которая существует в огромном диапазоне форм, включая обратную реакцию Дильса-Альдера с требованием электронов, гексадегидро реакцию Дильса-Альдера и связанная тримеризация алкинов. Реакция также может протекать в обратном направлении в реакции ретро-Дильса – Альдера.

Известны реакции с участием гетероатомов; включая аза-Дильса-Альдера и реакция Имина-Дильса-Альдера.
Реакция циклоприсоединения Хуйсгена представляет собой (2 + 3) циклоприсоединение.
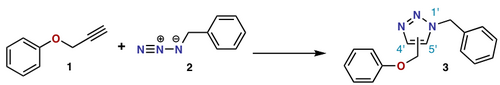
циклоприсоединение нитрон-олефин представляет собой (3 + 2) циклоприсоединение.

Железо [пиридин (диимин)] катализаторы содержат окислительно-восстановительный лиганд, в котором центральный атом железа может координироваться с двумя простыми нефункционализированными двойными связями олефина. Катализатор может быть записан как резонанс между структурой, содержащей неспаренные электроны с центральным атомом железа в степени окисления II, и структурой, в которой железо находится в степени окисления 0. Это дает ему гибкость для связывания двойных связей, когда они подвергаются реакции циклизации, генерируя циклобутановую структуру посредством C-C восстановительного отщепления; в качестве альтернативы циклобутеновую структуру можно получить отщеплением бета-водорода. Эффективность реакции существенно различается в зависимости от используемых алкенов, но рациональный дизайн лиганда может позволить расширить диапазон реакций, которые могут быть катализированы.
Хелетропные реакции являются подклассом циклоприсоединений. Ключевой отличительной чертой хелетропных реакций является то, что на одном из реагентов обе новые связи образуются с одним и тем же атомом. Классическим примером является реакция диоксида серы с диеном.

Существуют и другие реакции циклоприсоединения: [4 + 3] циклоприсоединения, [6 + 4] циклоприсоединения, [2 + 2] фотоциклоприсоединения и [4 + 4] фотоциклоприсоединения
Циклоприсоединения часто содержат металл -катализируемые и ступенчатые радикальные аналоги, однако это, строго говоря, не перициклические реакции. Когда в циклоприсоединении участвуют заряженные или радикальные промежуточные соединения, или когда результат циклоприсоединения достигается в серии стадий реакции, их иногда называют формальными циклоприсоединениями, чтобы отличить их от истинных перициклических циклоприсоединений.
Одним из примеров формального [3 + 3] циклоприсоединения между циклическим еноном и енамином, катализируемого н-бутиллитием, является Аист енамин / 1,2- добавление каскадная реакция :
![Межмолекулярная формальная [3 + 3] Реакция циклоприсоединения](http://upload.wikimedia.org/wikipedia/commons/thumb/2/26/3%2B3-cycloaddition.svg/600px-3%2B3-cycloaddition.svg.png)