 Общая формула кетена.
Общая формула кетена. A кетен - это органическое соединение в форме R'R ″ C = C = O, где R и R 'представляют собой две произвольные одновалентные химические группы (или два отдельных замещения сайтов в той же молекуле). Название может также относиться к конкретному соединению этенон H. 2C = C = O, простейшему кетену.
Хотя они очень полезны, большинство кетенов нестабильны. При использовании в качестве реагентов в химической процедуре они обычно генерируются по мере необходимости и расходуются, как только (или во время) их производства.
Кетены сначала изучались как класс Автор Герман Штаудингер до 1905 года.
Кетены систематически исследовались Германом Штаудингером в 1905 году в форме дифенилкетена (преобразование 
этенон, простейший кетен может быть образован пиролизом (термическим крекингом) ацетона :
Эта реакция называется синтезом кетена Шмидлина.
Другие кетены могут быть получены из ацилхлоридов с помощью реакции элиминирования, в которой HCl теряется:

В этой реакции основание, обычно триэтиламин, отщепляет кислотный протон альфа до карбонильной группы., вызывая образование двойной связи углерод-углерод и потерю иона хлорида :

Кетены также могут быть образованы из α- с помощью перегруппировки Вольфа.
Другой способ образования кетенов происходит через мгновенный вакуумный термолиз (FVT) с 2-. В 1997 году Плюг и Вентруп разработали метод, который улучшил реакции FVT для получения кетенов со стабильным FVT, нечувствительным к влаге, в мягких условиях (480 ° C). N-пиридиламины получают конденсацией с R- малонатами с N-амино () и DCC в качестве растворителя.
Более надежный способ получения кетенов представляет собой карбонилирование металл-карбенов, и реакция in situ полученных таким образом высокореакционноспособных кетенов с подходящими реагентами, такими как имины, амины или спирты. Этот метод представляет собой эффективный тандемный протокол one-pot карбонилирования α-диазокарбонильных соединений и различных N-тозилгидразонов, катализируемый металлорадикалами Co (II) - порфирин, приводящий к образованию кетенов, которые впоследствии реагируют с различными нуклеофилами и иминами с образованием сложных эфиров, амидов и β-лактамов. Эта система имеет широкий диапазон субстратов и может применяться к различным комбинациям предшественников карбена, нуклеофилов и иминов.
Из-за их кумулятивной двойной связи, кетены очень реакционноспособны.
При взаимодействии с спиртами образуются сложные эфиры карбоновой кислоты :

Кетены реагируют с карбоновыми кислотами с образованием ангидридов карбоновых кислот :

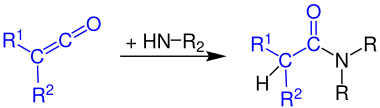
Кетены реагируют с аммиаком в первичные амиды :

Взаимодействие кетенов с первичными аминами дает вторичные амиды :

Кетены реагируют с вторичными аминами с образованием третичных амидов:
В результате реакции с водой карбоновые кислоты образуются из кетенов

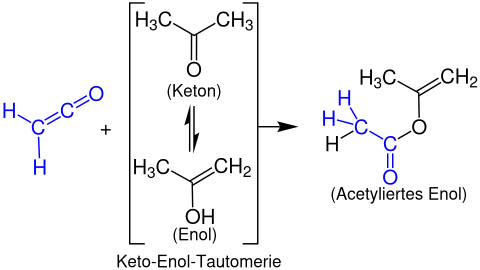
Энолацетаты образуются из кетенов с энолизируемыми карбонильными соединениями. В следующем примере показана реакция этенона с ацетоном с образованием пропен-2-илацетата:
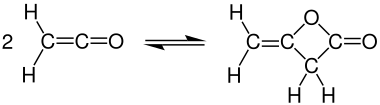
При комнатной температуре кетен быстро димеризуется до дикетен, но кетен можно выделить путем нагревания:
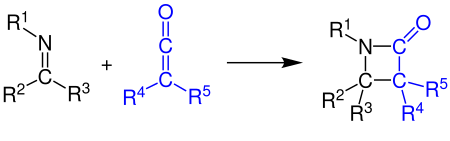
Кетены могут реагировать с алкенами, карбонильными соединениями, карбодиимиды и имины в [2 + 2] циклоприсоединении. Пример показывает синтез β-лактама реакцией кетена с имином (см. синтез Штаудингера ):
Кетены обычно очень реакционноспособны и участвуют в в различных циклоприсоединениях. Одним из важных процессов является димеризация с образованием пропиолактонов. Конкретным примером является димеризация кетена стеариновой кислоты с получением алкила димеры кетена, которые широко используются в бумажной промышленности. AKD реагируют с гидроксильными группами целлюлозы посредством реакции этерификации.
Они также будут подвергаться [2 + 2] циклоприсоединению реакции с богатыми электронами алкинами с образованием или карбонильными группами с образованием бета-лактонов. С иминами образуются бета-лактамы. Это синтез Штаудингера, простой путь к этому важному классу соединений. С ацетоном кетен реагирует с образованием изопропенилацетата.
различных гидроксильных групп. соединения можно добавлять как n нуклеофилы, образующие продукты енола или сложного эфира. Например, молекула воды легко присоединяется к кетену, давая 1,1-дигидроксиэтен, и уксусный ангидрид получают реакцией уксусной кислоты с кетеном. Реакции между диолами (HO-R-OH) и бис-кетенами (O = C = CH-R'-CH = C = O) дают полиэфиры с повторяющейся единицей ( −O − R − O − CO − R′ − CO).
Этилацетоацетат, важный исходный материал в органическом синтезе, может быть получен с использованием дикетена в реакции с этанолом. Они непосредственно образуют этилацетоацетат, и выход является высоким при проведении в контролируемых условиях; поэтому этот метод используется в промышленности.