В термодинамике свободная энергия Гиббса представляет собой термодинамический потенциал, который можно использовать для расчета максимальной обратимой работы, которая может быть выполнена термодинамической системой при постоянной температуре и давление. Свободная энергия Гиббса (
Энергия Гиббса (символ 

Свободная энергия Гиббса, первоначально называемая доступной энергией, была разработана в 1870-х годах американским ученым Джозайей Уиллардом Гиббсом. В 1873 году Гиббс описал эту «доступную энергию» как
наибольшее количество механической работы, которое может быть получено от данного количества определенного вещества в данном исходном состоянии без увеличения его общего объема или позволяя теплу проходить к внешним телам или от них, за исключением случаев, когда при завершении процессов они остаются в исходном состоянии.
Начальное состояние тела, согласно Гиббсу, должно быть таким, что «тело может переходить от него к состояниям рассеянной энергии посредством обратимых процессов ". В его 1876 magnum opus On the Equilibrium of Heterogenous Substance, графическом анализе многофазных химических систем, он полностью погрузился в свои мысли о химической свободной энергии.
Если все реагенты и продукты находятся в их термодинамических стандартных состояниях, то определяющее уравнение записывается как 
 Реакция C (s) → C (s) имеет отрицательное изменение свободной энергии Гиббса и поэтому термодинамически выгодно при 25 ° C и 1 атм. Однако реакция слишком медленная, чтобы ее можно было наблюдать из-за очень высокой энергии активации. Является ли реакция термодинамически благоприятной, не определяет ее скорость.
Реакция C (s) → C (s) имеет отрицательное изменение свободной энергии Гиббса и поэтому термодинамически выгодно при 25 ° C и 1 атм. Однако реакция слишком медленная, чтобы ее можно было наблюдать из-за очень высокой энергии активации. Является ли реакция термодинамически благоприятной, не определяет ее скорость. Согласно второму закону термодинамики, для систем, реагирующих при стандартных условиях для температуры и давления (или любых других фиксированных температура и давление), существует общая естественная тенденция к достижению минимума свободной энергии Гиббса.
Количественным показателем благоприятности данной реакции при постоянной температуре и давлении является изменение ΔG (иногда обозначаемое как «дельта G» или «dG») свободной энергии Гиббса, которое вызвано (или могло бы быть) вызвано Реакция. В качестве необходимого условия для протекания реакции при постоянной температуре и давлении, ΔG должен быть меньше, чем объем без давления (не-PV, например, электрический) работа, который часто равен нулю (следовательно, ΔG должно быть отрицательным). ΔG равно максимальному количеству работы, не связанной с фотоэлектрической системой, которая может быть выполнена в результате химической реакции в случае обратимого процесса. Если анализ показывает положительное ΔG для реакции, тогда в реагирующую систему необходимо добавить энергию - в виде электрической или другой не-фотоэлектрической работы, чтобы ΔG было меньше, чем не-фотоэлектрическая работа, и чтобы сделать возможным реакция, которая должна произойти.
Можно думать о ∆G как о количестве «свободной» или «полезной» энергии, доступной для выполнения работы. Уравнение также можно увидеть с точки зрения системы вместе с ее окружением (остальной Вселенной). Во-первых, предполагается, что данная реакция при постоянной температуре и давлении является единственной, которая происходит. Тогда энтропия, высвобождаемая или поглощаемая системой, равна энтропии, которую окружающая среда должна поглощать или выделять соответственно. Реакция будет разрешена только в том случае, если полное изменение энтропии Вселенной равно нулю или положительно. Это отражается в отрицательном ΔG, и реакция называется экзергоническим процессом.
Если две химические реакции связаны, то в противном случае может быть проведена эндергоническая реакция (одна с положительным ΔG) случиться. Подвод тепла в изначально эндергоническую реакцию, такую как элиминирование циклогексанола в циклогексен, можно рассматривать как сочетание неблагоприятной реакции (элиминирования) с благоприятный (сжигание угля или другое обеспечение тепла), при котором полное изменение энтропии Вселенной больше или равно нулю, что делает полную разность свободной энергии Гиббса связанных реакций отрицательной.
В традиционном использовании термин «свободная» был включен в «свободную энергию Гиббса», чтобы обозначать «доступную в форме полезной работы». Характеристика станет более точной, если мы добавим уточнение, что это энергия, доступная для работы без давления и объема. (Аналогичное, но немного иное значение слова «свободная» применяется в сочетании со свободной энергией Гельмгольца для систем с постоянной температурой). Тем не менее, все большее количество книг и журнальных статей не содержат вложения «бесплатно», где G обозначается просто «энергией Гиббса». Это результат встречи IUPAC 1988 г., целью которой было установить единую терминологию для международного научного сообщества, на которой было рекомендовано исключить прилагательное «свободный». Однако этот стандарт еще не получил широкого распространения.
Величина, называемая «свободная энергия», является более продвинутой и точной заменой устаревшего термина «сродство», который использовался химиками в первые годы физической химии для описания силы, которая вызвало химические реакции.
В 1873 году Уиллард Гиббс опубликовал «Метод геометрического представления термодинамических свойств веществ с помощью поверхностей», в котором он обрисовал принципы своего нового уравнения, которое позволило предсказывать или оценивать тенденции различных естественных процессов, возникающих при контакте тел или систем. Путем изучения взаимодействий контактирующих однородных веществ, т. Е. Тел, состоящих из части твердого тела, части жидкости и части пара, и с помощью трехмерного объема - энтропии - график внутренней энергии, Гиббс смог определить три состояния равновесия, т. е. «обязательно стабильное», «нейтральное» и «нестабильное», а также определить, последуют ли изменения. Далее Гиббс заявил:
В этом описании, используемом Гиббсом, ε относится к внутренней энергии тела, η относится к энтропии тела, а ν - к объем корпуса.
После этого, в 1882 году, немецкий ученый Герман фон Гельмгольц охарактеризовал сродство как наибольшее количество работы, которое может быть достигнуто, если реакция осуществляется обратимым образом, например с помощью электрического работают в обратимой ячейке. Таким образом, максимальная работа рассматривается как уменьшение свободной или доступной энергии системы (свободная энергия Гиббса G при T = постоянная, P = постоянная или свободная энергия Гельмгольца F при T = постоянная, V = постоянная), в то время как Выдаваемое тепло обычно является мерой уменьшения общей энергии системы (внутренняя энергия ). Таким образом, G или F - это количество энергии, «свободное» для работы в данных условиях.
До этого момента общее мнение было таким, что «все химические реакции приводят систему в состояние равновесия, при котором сходство реакций исчезает». В течение следующих 60 лет термин «аффинити» был заменен термином «свободная энергия». По словам историка химии Генри Лестера, влиятельный учебник «Термодинамика и свободная энергия химических веществ» 1923 года, составленный Гилбертом Н. Льюисом и Мерлом Рэндаллом, привел к замене термина «сродство» на термин «свободная энергия» в большей части англоязычного мира.
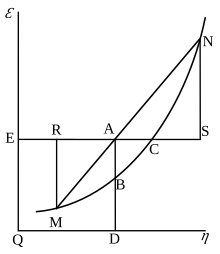 Уиллард Гиббс '1873 доступная энергия (свободная энергия) график, который показывает плоскость перпендикулярно оси v (объем ) и проходит через точку A, которая представляет начальное состояние тела. MN - это сечение поверхности рассеянной энергии. Qε и Qη являются сечениями плоскостей η = 0 и ε = 0 и, следовательно, параллельны осям ε (внутренняя энергия ) и η (энтропия ), соответственно. AD и AE - это энергия и энтропия тела в его начальном состоянии, AB и AC - его доступная энергия (свободная энергия Гиббса) и его способность к энтропии (величина, на которую энтропия тела может быть увеличена без изменения энергии тела. тело или увеличивая его объем) соответственно.
Уиллард Гиббс '1873 доступная энергия (свободная энергия) график, который показывает плоскость перпендикулярно оси v (объем ) и проходит через точку A, которая представляет начальное состояние тела. MN - это сечение поверхности рассеянной энергии. Qε и Qη являются сечениями плоскостей η = 0 и ε = 0 и, следовательно, параллельны осям ε (внутренняя энергия ) и η (энтропия ), соответственно. AD и AE - это энергия и энтропия тела в его начальном состоянии, AB и AC - его доступная энергия (свободная энергия Гиббса) и его способность к энтропии (величина, на которую энтропия тела может быть увеличена без изменения энергии тела. тело или увеличивая его объем) соответственно. Свободная энергия Гиббса определяется как

, что то же самое, что и

где:
Выражение для бесконечно малого обратимого изменения свободной энергии Гиббса как функции ее «естественных переменных» p и T, для открытой системы, подвергшейся действию действие внешних сил (например, электрических или магнитных) X i, которые вызывают изменение внешних параметров системы a i на величину da i, можно получить из первого закона для обратимых процессов:

где:
Это одна из форм Основное уравнение Гиббса . В бесконечно малом выражении термин, включающий химический потенциал, учитывает изменения в свободной энергии Гиббса в результате притока или оттока частиц. Другими словами, это справедливо для открытой системы или для закрытой, химически реагирующей системы, в которой N i изменяются. Для закрытой, не реагирующей системы этот термин можно опустить.
Может быть добавлено любое количество дополнительных терминов, в зависимости от конкретной рассматриваемой системы. Помимо механической работы, система может, кроме того, выполнять множество других типов работы. Например, в бесконечно малом выражении энергия сократительной работы, связанная с термодинамической системой, которая представляет собой сокращающееся волокно, укорачивающееся на величину -dl под действием силы f, приведет к добавлению члена f dl. Если количество заряда −de приобретается системой при электрическом потенциале, электрическая работа, связанная с этим, равна −Ψ de, что должно быть включено в бесконечно малое выражение. Другие рабочие условия добавляются в соответствии с требованиями системы.
Каждая величина в приведенных выше уравнениях может быть разделена на количество вещества, измеренное в молях, для образования молярной свободной энергии Гиббса. Свободная энергия Гиббса - одна из наиболее важных термодинамических функций для характеристики системы. Это фактор при определении результатов, таких как напряжение электрохимической ячейки и константа равновесия для обратимой реакции. В изотермических, изобарных системах свободную энергию Гиббса можно рассматривать как «динамическую» величину, поскольку она представляет собой репрезентативную меру конкурирующих эффектов энтальпии и энтропии движущих сил, участвующих в термодинамическом процессе.
 Связь с другими соответствующими параметрами
Связь с другими соответствующими параметрами Температурная зависимость энергии Гиббса для идеального газа дается уравнением Гиббса – Гельмгольца, а ее зависимость от давления определяется как

Если известен объем, а не давление, то оно принимает вид

или, что более удобно, его химический потенциал :

Не -идеальные системы, летучесть вступает в игру.
Свободная энергия Гиббса полный дифференциал естественные переменные могут быть получены с помощью преобразований Лежандра из внутренняя энергия.

Определение G сверху:
 .
.Взяв полный дифференциал, мы имеем

Замена dU результатом из первого закона дает

Естественные переменные группы G равны p, T и {N i }.
Поскольку S, V и N i являются обширными переменными, интеграл Эйлера позволяет легко интегрировать из dU:

Поскольку некоторые естественные переменные G являются интенсивными, dG нельзя интегрировать с использованием интегралов Эйлера как есть корпус с внутренней энергией. Однако простая подстановка указанного выше интегрированного результата для U в определение G дает стандартное выражение для G:

Этот результат применим к однородным макроскопическим системам, но не ко всем термодинамическим системам.
Рассматриваемая система поддерживается при постоянных температуре и давлении и является замкнутой (независимо от того, может войти или выйти). Энергия Гиббса любой системы равна 

Согласно первому закону термодинамики, изменение внутренней энергии U задается на

где δQ - энергия, добавленная в виде тепла, а δW - энергия, добавленная в виде работы. Работа, проделанная в системе, может быть записана как δW = −PdV + δW x, где −PdV - это механическая работа сжатия / расширения, совершаемая в системе, а δW x - все другие формы работы, которые могут включать электрическую, магнитную и т. д. Предполагая, что выполняется только механическая работа,

и бесконечно малое изменение в G:

второй закон термодинамики утверждает, что для закрытой системы, 

Это означает, что для системы, которая не находится в равновесии, ее энергия Гиббса всегда будет уменьшаться, а когда она находится в равновесии (т. Е. Больше не изменяется), бесконечно малое изменение dG будет равно нулю. В частности, это будет верно, если система претерпевает любое количество внутренних химических реакций на своем пути к равновесию.
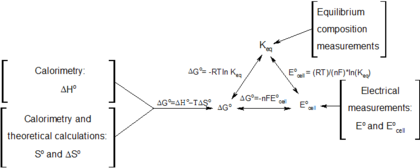
Когда электрический заряженный dQ проходит в электрохимической ячейке, ЭДС ℰ дает термодинамический рабочий член, который появляется в выражении для изменения энергии Гиббса :

где G - свободная энергия Гибба, S - энтропия, V - объем системы, P - ее давление, а T - ее абсолютная температура.
Комбинация (ℰ, Q) представляет собой пример сопряженной пары переменных. При постоянном давлении указанное выше соотношение создает соотношение Максвелла, которое связывает изменение напряжения открытого элемента с температурой T (измеряемая величина) с изменением энтропии S при прохождении заряда изотермически и изобарически. Последнее тесно связано с реакцией энтропией электрохимической реакции, которая придает батарее ее мощность. Это соотношение Максвелла:

Если моль ионов переходит в раствор (например, в ячейку Даниэля, как обсуждается ниже) заряд через внешнюю цепь составляет:

где n 0 - количество электронов / ион, а F 0 - постоянная Фарадея, а знак минус указывает разряд элемента. Предполагая постоянное давление и объем, термодинамические свойства ячейки строго связаны с поведением ее ЭДС следующим образом:

где ΔH энтальпия реакции. Все величины справа можно измерить напрямую.
Во время обратимой электрохимической реакции при постоянных температуре и давлении выполняются следующие уравнения, включающие свободную энергию Гиббса:
 (см. химическое равновесие ),
(см. химическое равновесие ), (для системы, находящейся в химическом равновесии),
(для системы, находящейся в химическом равновесии), (для обратимого электрохимического процесса при постоянных температуре и давлении),
(для обратимого электрохимического процесса при постоянных температуре и давлении), (определение E °),
(определение E °),и перестановка дает

, который связывает потенциал клетки, полученный в результате реакции, с константой равновесия и коэффициентом реакции для этой реакции (уравнение Нернста ),
где
Кроме того, мы также иметь:

, который связывает константу равновесия со свободной энергией Гиббса. Это означает, что в состоянии равновесия
 и
и 
| Вещество. (состояние) | ΔfG ° | |
|---|---|---|
| (kJ /моль ) | (ккал / моль ) | |
| NO (г) | 87,6 | 20,9 |
| NO2(г) | 51,3 | 12,3 |
| N2O (г) | 103,7 | 24,78 |
| H2O (г) | -228,6 | -54,64 |
| H2O (l) | -237,1 | -56,67 |
| CO2(г) | -394,4 | -94,26 |
| CO (г) | -137,2 | -32,79 |
| CH4(г) | -50,5 | -12,1 |
| C2H6(г) | - 32,0 | -7,65 |
| C3H8(г) | -23,4 | -5,59 |
| C6H6(г) | 129,7 | 29,76 |
| C6H6(1) | 124,5 | 31,00 |
Стандартная свободная энергия Гиббса образования соединения представляет собой изменение свободной энергии Гиббса, которое сопровождает образование 1 моля этого вещества из составляющего его элемента nts, в их стандартных состояниях (наиболее стабильная форма элемента при 25 ° C и 100 кПа ). Его символ - Δ f G˚.
Все элементы в их стандартных состояниях (двухатомный кислород газ, графит и т. Д.) Имеют стандартное изменение свободной энергии Гиббса образования, равное нулю, так как нет изменение вовлечено.
, где Q f - коэффициент реакции.
В состоянии равновесия Δ f G = 0 и Q f = K, поэтому уравнение принимает вид
, где K - константа равновесия.
Первоначально свободная энергия Гиббса была определена графически. В 1873 году американский ученый Уиллард Гиббс опубликовал свою первую термодинамическую статью «Графические методы в термодинамике жидкостей», в которой Гиббс использовал две координаты энтропии и объема для представления состояния тела. В своей второй последующей статье «Метод геометрического представления термодинамических свойств веществ с помощью поверхностей», опубликованной позже в том же году, Гиббс добавил третью координату энергии тела, определенную на трех фигурах. В 1874 году шотландский физик Джеймс Клерк Максвелл использовал фигуры Гиббса для создания трехмерной термодинамической поверхности энергии-энтропии вымышленного водоподобного вещества. Таким образом, чтобы понять концепцию свободной энергии Гиббса, может помочь понять ее интерпретация Гиббсом как сечение AB на его рисунке 3, и как Максвелл вылепил этот срез на своей трехмерной поверхностной фигуре.
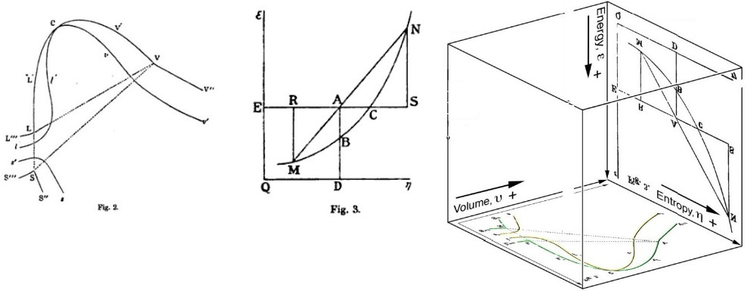 Американский ученый Уиллард Гиббс '1873 г. цифры два и три (вверху слева и посередине), использованные шотландским физиком Джеймсом Клерком Максвеллом в 1874 году для создания трехмерной энтропии, объем, энергия диаграмма термодинамической поверхности для фиктивного водоподобного вещества, две фигуры Гиббса (вверху справа) перенесены в координаты объем-энтропия (перенесены на нижнюю куба) и координаты энергии-энтропии (перевернутые вверх ногами и перенесенные на заднюю часть куба) соответственно трехмерных декартовых координат ; область AB - первое в истории трехмерное представление свободной энергии Гиббса, или то, что Гиббс назвал «доступной энергией»; область AC является его способностью к энтропии, что Гиббс определил как «количество, на которое энтропия тела может быть увеличена без изменения энергии тела или увеличения его объема.
Американский ученый Уиллард Гиббс '1873 г. цифры два и три (вверху слева и посередине), использованные шотландским физиком Джеймсом Клерком Максвеллом в 1874 году для создания трехмерной энтропии, объем, энергия диаграмма термодинамической поверхности для фиктивного водоподобного вещества, две фигуры Гиббса (вверху справа) перенесены в координаты объем-энтропия (перенесены на нижнюю куба) и координаты энергии-энтропии (перевернутые вверх ногами и перенесенные на заднюю часть куба) соответственно трехмерных декартовых координат ; область AB - первое в истории трехмерное представление свободной энергии Гиббса, или то, что Гиббс назвал «доступной энергией»; область AC является его способностью к энтропии, что Гиббс определил как «количество, на которое энтропия тела может быть увеличена без изменения энергии тела или увеличения его объема.