 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Этил-3-оксобутаноат | |
Другие названия
| |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.005.015 |
| Номер EC |
|
| KEGG | |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| номер ООН | 1993 |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C6H10O3 |
| Молярная масса | 130,14 г / моль |
| Внешний вид | Бесцветная жидкость |
| Запах | Фрукты или ром |
| Плотность | 1,021 г / см, жидкость |
| Температура плавления | -45 ° C (-49 ° F; 228 K) |
| Температура кипения | 180,8 ° C (357,4 ° F; 453,9 K) |
| Растворимость в воде | 2,86 г / 100 мл (20 ° C) |
| Кислотность (pK a) |
|
| Магнитная восприимчивость (χ) | -71,67 × 10 см / моль |
| Опасности | |
| Классификация ЕС (DSD) (устаревший) | Не указан |
| NFPA 704 (огненный алмаз) |  2 2 2 2 |
| Температура вспышки | 70 ° C (158 ° F; 343 K) |
| Родственные соединения | |
| Родственные сложные эфиры | |
| Родственные соединения | |
| Кроме если указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
органическое соединение этилацетоацетат (EAA ) представляет собой этиловый сложный эфир ацетоуксусная кислота. В основном она используется в качестве промежуточного химического соединения при производстве широкого спектра соединений, таких как аминокислоты, анальгетики, антибиотики, противомалярийные средства, антипирин и аминопирин и витамин B 1 ; а также производство красителей, чернил, лаков, духов, пластмасс и желтая краска пигменты. Сам по себе он используется как ароматизатор для еды.
Этилацетоацетат получают в промышленных масштабах путем обработки дикетена этанолом.
Получение этилацетоацетата является классической лабораторной процедурой. Его получают путем конденсации Клайзена этилацетата. Два моля этилацетата конденсируются с образованием по одному моль этилацетоацетата и этанола.

Этилацетоацетат подвержен кето-енольной таутомерии. В чистой жидкости при 33 ° C енол составляет 15% от общего количества.
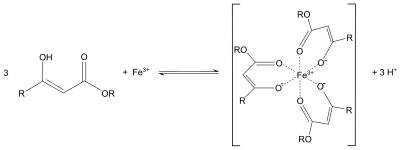
. Этилацетоацетат часто используется в синтезе ацетоуксусного эфира аналогично диэтилмалонату в синтезе синтез эфира малоновой кислоты или конденсация Кневенагеля. Протоны от альфа до карбонильных групп являются кислотными, и полученный карбанион может подвергаться нуклеофильному замещению. Возможно также последующее термическое декарбоксилирование. Подобно поведению ацетилацетона, енолят этилацетоацетата также может служить бидентатным лигандом. Например, он образует пурпурные координационные комплексы с солями железа (III):
Этилацетоацетат также может быть восстановлен до этил-3-гидроксибутирата.
Этилацетоацетат при нагревании отдельно (без катализатора) с бензиловым спиртом образует синтетически полезный бензилацетоацетат (бензильные группы легко удаляются позже каталитическим гидрогенолизом на Pd / C в нейтральных условиях) по механизму с участием ацетилкетена. Этил (и другие) ацетоацетатнитрозат легко с эквимолярным нитритом натрия в уксусной кислоте с получением соответствующих эфиров оксиминоацетоацетата. Восстановление их растворением цинком в уксусной кислоте в присутствии кетоэфиров или бета-дикетонов составляет синтез пирролов по Кнорру, полезных для синтеза порфиринов.