Лабораторный метод размножения образца ДНК для исследования

Полоска из восьми пробирок для ПЦР, каждая из которых содержит 100 мкл реакционной смеси
Полимеразная цепная реакция (ПЦР ) - это метод широко используемого быстрого получения от миллионов до миллиардов копий определенного образца ДНК, позволяющий ученым брать очень маленькие образцы ДНК и усилить его достаточно большого количества для детального изучения. ПЦР была изобретена в 1984 г. американским биохимиком Кэри Маллис из Cetus Corporation. Это основа генетических тестов, включая анализ древних ДНК и идентификацию многих инфекционных агентов. С помощью ПЦР копии очень количеств последовательностей ДНК экспоненциально амплифицируются в серии циклов изменений температуры. ПЦР является обычным и часто незаменимым методом, используемым в медицинских лабораториях и клинических лабораторных исследованиях для самых разных приложений, включая биомедицинские исследования и криминалистику.
. Методы ПЦР основаны на термоциклировании. При термоциклировании подвергаются воздействию циклам нагревания и охлаждения, что позволяет проводить различные температурно-зависимые реакции - в частности, плавление ДНК и управляемое фермент репликация ДНК. ПЦР использует два основных реагента - праймеры (которые представляют собой две короткие однонитевые фрагменты ДНК, известные как олигонуклеотиды, которые представляют собой комплементарную последовательность цели ДНК) и ДНК-полимераза. На первом этапе ПЦР две цепи двойной спирали ДНК физически разделяются при высокой температуре в процессе, называемом денатурацией нуклеиновой кислоты. На втором этапе понижается, и праймеры связываются с комплементарными последовательностями ДНК. Две цепи ДНК становятся матрицами для ДНК-полимеразы, чтобы ферментативно собрать новую цепь ДНК из свободных нуклеотидов, строительных блоков ДНК. По мере продвижения ПЦР сгенерированная ДНК сама используется в качестве шаблона для репликации, приводя в движение цепную реакцию , в которой исходная матрица ДНК экспоненциально амплифицируется.
Почти все приложения ПЦР используют термостойкую ДНК-полимеразу, такую как Taq-полимераза, фермент, используемый выделенный из термофильной бактерии Thermus aquaticus. Если используемая полимераза была термочувствительной, она денатурировала при высоких температурах стадии денатурации. До использования Taq-полимеразы ДНК-полимеразу приходилось вручную каждый цикл, что было утомительным и дорогостоящим процесс.
Применение метода включает клонирование ДНК для секвенирования, клонирование генов и манипуляции с ними, мутагенез генов; построение филогении на основе ДНК или функциональный анализ генов ; диагностика и мониторинг из; амплификация древней ДНК; анализ генетических отпечатков пальцев для профилирования ДНК (например, в судебной медицине и проверке отцовства ); и обнаружение патогенов в тестах на нуклеиновые кислоты для диагностики инфекционных заболеваний.

Размещение полоски из восьми пробирок для ПЦР в
термоциклер Содержание
- 1 Принципы
- 2 Оптимизация
- 3 Приложения
- 3.1 Селективная изоляция ДНК
- 3.2 Амплификация и количественное определение ДНК
- 3.3 Медицинские и диагностические приложения
- 3.4 Заявки на инфекционные заболевания
- 3.5 Судебные заявки
- 3.6 Исследовательские заявки
- 4 Преимущества
- 5 Ограничения
- 6 Варианты
- 7 История
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Принципы

A
термоциклер для ПЦР

Старый трехтемпературный
термоциклер для ПЦР
ПЦР усиливает специфическую область цепи ДНК (мишень ДНК). Большинство ПЦР амплифицировать фрагменты ДНК длиной от 0,1 до 10 пар оснований (kbp), хотя некоторые методы позволяют амплифицировать фрагменты до 40 kbp. Количество амплифицированного продукта определяется доступными субстратами в реакции, что становится ограничивающим по мере развития.
Базовая установка ПЦР требует нескольких компонентов и реагентов, включая:
- матрицу ДНК, которая содержит участок ДНК для амплификации
- a ДНК-полимеразы ; фермент, который полимеризует новые цепи ДНК; термостойкая Taq-полимераза особенно распространена, поскольку она с большей вероятностью останется неповрежденной во время процесса высокотемпературной денатурации ДНК
- два ДНК праймера, которые комплементарный к 3 '(трем первичным) концам каждой из смысловой и антисмысловой цепей ДНК-мишени (ДНК-полимераза может связываться и удлиняться от двухцепочечный участок ДНК; без праймеров нет двухцепочечного сайта инициации, с которым полимераза может связываться); специфические праймеры, которые комплементарны целевой области ДНК, выбираются и часто изготавливаются на заказ в лаборатории или приобретаются у коммерческих биохимических поставщиков
- дезоксинуклеозидтрифосфаты или dNTP (иногда называемые «дезоксинуклеотидтрифосфатами»; нуклеотиды, кодосфосфатные группы), строительные блоки, из которых ДНК-полимераза синтезирует новую цепь ДНК
- a буферный раствор, обеспечивающий подходящую химическую среду для оптимальной среды ДНК-полимеразы
- двухвалентной катионы, обычно ионы магния (Mg) или марганца (Mn); Mg является наиболее распространенным, но Mn можно использовать для PCR-опосредованного мутагенеза ДНК, благодаря чему увеличивается частоту ошибок во время синтеза ДНК; и одновалентные катионы, обычно ионы калия (K)
Реакция обычно проводится в объеме 10–200 мкл в небольших реакционных пробирках (объемы 0,2–0,5 мл) в термоциклере . Термоциклер нагревает и охлаждает реакционные трубки для достижения температур, необходимых на каждой стадии реакции (см. Ниже). Многие современные термоциклеры используют эффект Пельтье, который позволяет как нагревать, так и охлаждать блок, удерживая трубки ПЦР, просто путем изменения направления электрического тока. Тонкостенные реакционные трубки благоприятную теплопроводность для быстрого теплового равновесия. Большинство термоциклеров имеют нагретые крышки для предотвращения конденсации в верхней части реакционной трубы. Старые термоциклеры без подогреваемой крышки требуют слоя масла поверх реакционной смеси или шарика воска внутри трубки.
Процедура
Как правило, ПЦР состоит из серии из 20–40 повторяющихся изменений температуры, называемых термическими циклами, причем каждый цикл обычно состоит из двух или трех дискретных температурных шагов (см. Рисунок ниже). Циклу часто предшествует один температурный шаг при очень высокой температуре (>90 ° C (194 ° F)), за которое следует одно удержание в конце для увеличения объема продукта или кратковременного хранения. Используемые температуры и их продолжительность применения в каждом цикле зависит от множества параметров, включая фермент для синтеза ДНК, концентрацию двухвалентных моделей и дНТФ в реакции и температуру плавления (Tm) праймеров. Отдельные этапы, общие для методов ПЦР, следующие:
- Инициализация: этот этап требуется только для ДНК-полимераз, требующих тепловой активации с помощью ПЦР с горячим стартом. Он заключается в нагревании реакционной камеры до температуры 94–96 ° C (201–205 ° F) или 98 ° C (208 ° F), если используются термостабильные полимеразы, который выдерживается в течение 1–10 минут.
- Денатурация : этот этап является первым регулярным цикании цикла и заключается в нагревании реакционной камеры до 94–98 ° C (201–208 ° F) в течение 20–30 секунд. Это вызывает плавление ДНК или денатурацию двухцепочечной матрицы ДНК за счет разрыва водородных связей между комплементарными основаниями, в результате чего образуются две одноцепочечные молекулы ДНК.
- Отжиг : На следующем этапе температуры реакции снижается до 50–65 ° C (122–149 ° F) на 20–40 секунд, что позволяет отжиг праймеров для каждой из одноцепочечных матриц ДНК. В реакционную смесь обычно включают два разных праймера: по одному для каждого из двух одноцепочечных комплементов, целевой участок. Праймеры сами по себе одноцепочечные поставляют.
- Очень важно определить подходящую температуру для отжига. потому что эффективность и специфичность зависит от температуры отжига. Эта температура должна быть достаточно низкой, чтобы обеспечить гибридизацию праймера с цепью, но достаточно высокой, чтобы гибридизация была специфичной, т. Е. Праймер должен связываться только с полностью комплементарной части цепи, и нигде более. Если температура будет слишком низкой, грунтовка может плохо закрепиться. Праймер может вообще не схватиться. Типичная температура отжига примерно на 3–5 ° C ниже Т м используемых праймеров. Стабильные водородные связи между комплементарными основаниями образуются только тогда, когда последовательность праймера очень близко совпадает с последовательностью матрицы. На этом этапе полимераза связывается с гибридом праймер-матрица и начинает образование ДНК.
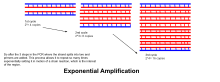
- Удлинение / удлинение: Температура на этом этапе зависит от используемой ДНК-полимеразы; Оптимальная температура активности для термостабильной ДНК-полимеразы Taq-полимеразы составляет примерно 75–80 ° C (167–176 ° F), хотя температура 72 ° C (162 ° F).) обычно используется с этим ферментом. На этом этапе ДНК-полимераза синтезирует новую цепь ДНК, комплементарную цепь ДНК, путем добавления дополнительных дНТФ из реакционной смеси, которая комплементарна матрице в направлении 5'-к-3 ', конденсация 5'- фосфатной группы dNTP с 3'- гидроксильной группой на конце формирующейся (удлиняющейся) цепи ДНК. Точное время, необходимое для удлинения, как от используемой ДНК-полимеразы, зависит от длины области ДНК для амплификации. Как показывает практика, при оптимальной температуре ДНК-полимераз полимеризуют тысячу оснований в минуту. В оптимальных условиях (т.е. если нет ограничений из-за ограничивающих субстратов или реагентов) на каждой стадии удлинения / элонгации количество целевых последовательностей ДНК удваивается. В каждом последующем цикле исходные цепочки-матрицы плюс все вновь сгенерированные цепочки становятся цепями-матрицами для следующего цикла элонгации, что приводит к экспоненциальной (геометрической) амплификации заданной области ДНК.
- Процессы денатурации, отжига и удлинения составляют один цикл. Чтобы амплифицировать ДНК-мишень до миллионов копий, требуется несколько циклов. Формула, используемая для расчета количества копий ДНК, образовавшихся после заданного количества циклов, равна 2, где n - количество циклов. Таким образом, набор параметров для 30 циклов дает 2, или 1 073 741 824 копий исходной области-мишеницепочечной ДНК.
- Конечное удлинение: этот единственный этап является необязательным, но выполняется при температуре 70–74 ° C (158–165 ° F) (температурный диапазон, необходимый для полимеразальной активности в ПЦР) в течение 5–15 минут после последнего цикла ПЦР, что оставшаяся одноцепочечная ДНК полностью удлинена.
- Окончательная выдержка: на последней стадии реакционная камера охлаждается до 4–15 ° C (39–59 ° F) в течение неопределенного времени и может быть кратковременного хранения продуктов ПЦР.

 Бромид этидия
Бромид этидия -окрашенные продукты ПЦР после
гель-электрофореза. Два набора праймеров использовали для амплификации практику из трех различных образцов ткани. В образце № 1 амплификации нет; Полосы ДНК в образцах №2 и №3 указывает на успешную амплификацию внедрить. Гель также показывает положительный контроль и лестницу ДНК, установленные фрагменты ДНК ДНК для определения размера экспериментальных ПЦР.
Чтобы проверить, успешно ли ПЦР сгенерировала ожидаемую целевую область ДНК (также иногда называемую амплимером) или ампликон ), электрофорез в агарозном геле можно использовать для разделения по размеру продуктов ПЦР. Размер продуктов ПЦР определяет путем сравнения с лестницей ДНК, маркером молекулярной массы, который содержит фрагменты известных размеров, который проходит на ДНК вместе с продуктами ПЦР.

Этапы
Как и в случае с другими химическими реакциями, на скорость и эффективность ПЦР действуют ограничивающие факторы. Таким образом, весь процесс ПЦР можно далее разделить на три этапа в зависимости от хода реакции:
- Экспоненциальная амплификация: в цикле количество продукта удваивается (при условии 100% эффективности реакции). После 30 циклов единичная копия ДНК может быть увеличена до 1 000 000 000 (одного миллиарда) копий. Таким образом, в некотором смысле репликация дискретной цепи ДНК манипулируется в пробирке в контролируемых условиях. Реакция очень чувствительна: присутствуют только незначительные количества ДНК.
- Стадия выравнивания: замедляется, поскольку ДНК-полимераза теряет активность и потребление реагентов, как dNTPs и праймеры, заставляет их становиться более ограничено.
- Плато: продукт больше не накапливается из-за исчерпания реагентов и фермента.
Оптимизация
На практике ПЦР может не работать по разным причинам, отчасти из-за ее чувствительности к загрязнению, вызывающему амплификацию ложных продуктов ДНК. Из-за этого был разработан ряд методов и процедур для оптимизации условий ПЦР. Загрязнение посторонней ДНК решается с помощью лабораторных протоколов и процедур, которые отделяют пре-ПЦР-смеси от загрязнителей ДНК. Обычно это включает пространственное разделение области установки ПЦР для анализа продуктов ПЦР, использование одноразовой пластмассовой посуды и тщательную очистку рабочей поверхности между установками реакций. Методы конструирования праймеров важны для повышения выхода продуктов ПЦР и предотвращения образования ложных продуктов, использование альтернативных компонентов буфера или ферментов полимеразы может помочь при амплификации длинных или других проблемных участков ДНК. Добавление реагентов, таких как формамид, в буферных системах может повысить специфичность и выход ПЦР. Компьютерное моделирование теоретических результатов ПЦР (Электронная ПЦР ) может быть выполнено для помощи в разработке праймера.
Применения
Селективное выделение ДНК
ПЦР позволяет отрезать фрагменты ДНК из геномной ДНК путем селективной амплификации данной области ДНК. Такое использование ПЦР дополнительных методов, таких как создание зондов для гибридизации для Саузерн или северных гибридизации и клонирования ДНК, которые требуют больших количеств ДНК, представляющая определенный участок ДНК. ПЦР обеспечивает эти методы с большим количеством исходного материала ДНК, что позволяет анализировать образцы ДНК даже из очень небольшого количества исходного материала.
Другие применения ПЦР включают секвенирование ДНК для определения неизвестных ПЦР-амплифицированных последовательностей, в которых один из праймеров для амплификации может быть в секвенировании по Сэнгеру, выделению последовательности ДНК для ускорения технологий рекомбинантной ДНК, включающих вставку ДНК в плазмиду, фаг или космиду (в зависимости от размера) или генетический материал другого организма. Бактериальные колонии (такие как E. coli ) можно быстро проверить с помощью ПЦР на предмет правильных ДНК векторных конструкций. ПЦР также может Лаура генетического снятия отпечатков пальцев ; судебно-медицинский метод, используемый для идентификации человека или путем сравнения экспериментальных ДНК с помощью различных методов на основе ПЦР.
Некоторые методы «отпечатков пальцев» ПЦР обладают высокой способностью к генетическим родствам, такими как родитель-ребенок или между братьями и сестрами, и используются при использовании на отцовстве (рис. 4). Этот метод также можно использовать для определения трансформационных взаимоотношений между организмами, когда используются современные электрические часы (т.е. гены 16S рРНК и recA микроорганизмов).

Электрофорез фрагментов ДНК, амплифицированных с помощью ПЦР. (1) Отец. (2) Ребенок. (3) Мать. Ребенок унаследовал некоторые, но не все отпечатки пальцев каждого из своих родителей, что дает ему новый уникальный отпечаток.
Амплификация и количественная оценка ДНК
Поскольку ПЦР усиливает области ДНК, на которые он нацелен, ПЦР можно использовать для анализа очень малых количеств образца. Это часто имеет решающее значение для судебно-медицинской экспертизы, когда в качестве доказательства доступно только следовое количество ДНК. ПЦР также может использоваться для анализа древней ДНК, возраст которой составляет десятки тысяч лет. Эти основанные на ПЦР методы успешно применялись на животных, таких как мамонт возрастом сорок тысяч лет, а также на ДНК человека в различных приложениях, от анализа египетских мумий к идентификации русского царя и тела английского короля Ричарда III.
Количественная ПЦР или ПЦР в реальном времени (qPCR, не путать с методами ОТ-ПЦР ) позволяют оценить количество данной последовательности, присутствующей в образце - метод, часто применяемый для количественного определения уровней экспрессии гена. Количественная ПЦР - это признанный инструмент количественной оценки ДНК, который измеряет накопление продукта ДНК после каждого раунда амплификации ПЦР.
qPCR позволяет количественно определять и обнаруживать конкретную последовательность ДНК в режиме реального времени, поскольку она измеряет концентрацию во время процесса синтеза. Есть два метода одновременного обнаружения и количественной оценки. Первый метод заключается в использовании флуоресцентных красителей, которые неспецифически удерживаются между двойными нитями. Второй метод включает зонды, которые кодируют определенные последовательности и флуоресцентно помечены. Обнаружение ДНК с помощью этих методов можно увидеть только после гибридизации зондов с их комплементарной ДНК. Интересной комбинацией методов является ПЦР в реальном времени и обратная транскрипция. Этот сложный метод, называемый RT-qPCR, позволяет количественно определять небольшое количество РНК. С помощью этого комбинированного метода мРНК преобразуется в кДНК, которая в дальнейшем количественно определяется с помощью КПЦР. Этот метод снижает вероятность ошибки в конечной точке ПЦР, увеличивая шансы на обнаружение генов, связанных с генетическими заболеваниями, такими как рак. Лаборатории используют ОТ-КПЦР для точного измерения регуляции генов. Математические основы для надежной количественной оценки ПЦР и RT-qPCR облегчают выполнение точных процедур подбора экспериментальных данных в приложениях для исследований, медицины, диагностики и инфекционных заболеваний.
Медицинские и диагностические приложения
Потенциальные родители могут быть проверены на предмет генетических носителей, или их дети могут быть проверены на предмет наличия болезни. Образцы ДНК для пренатального тестирования можно получить с помощью амниоцентеза, взятия проб ворсинок хориона или даже анализа редких фетальных клеток, циркулирующих в кровотоке матери. ПЦР-анализ также важен для доимплантационной генетической диагностики, когда отдельные клетки развивающегося эмбриона проверяются на наличие мутаций.
- ПЦР также может использоваться как часть чувствительного теста для типирования тканей, жизненно важного для трансплантации органов. С 2008 года даже есть предложение заменить традиционные тесты на антитела для группы крови тестами на основе ПЦР.
- Многие рака включают изменения онкогенов. Используя тесты на основе ПЦР для изучения этих мутаций, иногда можно индивидуально адаптировать режимы терапии к пациенту. ПЦР позволяет раннюю диагностику злокачественных заболеваний, таких как лейкоз и лимфомы, которые в настоящее время наиболее развитыми в исследованиях рака и уже используются рутинно. ПЦР-анализы можно использовать непосредственно на образцах геномной ДНК для обнаружения злокачественных клеток, специфичных для транслокаций, с чувствительностью, которая по крайней мере в 10 000 раз выше, чем у других методов. ПЦР очень полезна в области медицины, так как позволяет изолировать и усиливать опухолевые супрессоры. Например, для распознавания подтверждений и комбинаций ДНК, мРНК и белков.
Применение инфекционных заболеваний
ПЦР позволяет быстро и высокоспецифично диагностировать инфекционные заболевания. заболевания, в том числе вызванные бактериями или вирусами. ПЦР также идентифицировал некультивируемые или медленнорастущие микроорганизмы, такие как микобактерии, анаэробные бактерии или вирусы, из тестов культуры ткани. и модели на животных. Основой для диагностических приложений ПЦР в микробиологии является обнаружение инфекционных агентов и различение непатогенных штаммов от патогенных на специфических генов.
Характеристика и обнаружение возбудителей инфекционных заболеваний произвела революцию в ПЦР в безопасных методах:
- Вирус иммунодефицита человека (или ВИЧ ) - трудная цель для поиска и искоренения. Самые ранние тесты на инфекцию основывались на наличии антител к вирусу, циркулирующих в кровотоке. Однако антитела появляются через несколько недель после заражения, материнские антитела маскируют инфекцию новорожденного, терапевтические средства для борьбы с инфекцией не действуют на антитела. Были разработаны ПЦР тесты, которые могут обнаруживать всего один вирусный геном среди ДНК более чем 50 000 клеток-хозяев. Инфекции могут быть обнаружены раньше, новорожденные могут быть немедленно проверены на наличие вируса, а эффекты противовирусного лечения могут быть эффективны.
- Некоторые болезнетворные организмы, такие как туберкулез, трудно получить образцы у пациентов и медленно выращивать в лаборатории. Тесты на основе ПЦР позволили построить небольшое количество болезнетворных организмов (как живых, так и мертвых) в удобных образцах. Подробный генетический анализ также местный помощник для лечения антибиотикам, что позволяет немедленно и лечить. Эффекты терапии также можно оценить немедленно.
- Можно отслеживать распространение возбудителя болезни через популяции домашних или диких животных методом ПЦР. Во многих случаях появления новых вирулентных подтипов может быть обнаружено и отслежено. Подтипы организма, которые были ответственны за более ранние эпидемии, также можно определить с помощью ПЦР-анализа.
- Вирусная ДНК может быть обнаружена с помощью ПЦР. Используемые праймеры должны быть специфичными для целевых последовательностей в ДНК вируса, и ПЦР может быть диагностических анализов или секвенирования ДНК вирусного генома. Высокая чувствительность ПЦР позволяет обнаруживать вскоре после заражения и даже до начала заболевания. Такое раннее обнаружение может дать врачам значительное время для начала лечения. Количество вируса («вирусная нагрузка ») у пациента также может быть определено количественно количественно на основе ПЦР (см. Ниже). Вариант ПЦР (RT-PCR ) используется для обнаружения вирусной РНК, а не ДНК: в этом тесте ферментная обратная транскриптаза используется для создания ДНК, которая соответствует вирусной РНК; эта ДНК затем амплифицируется обычным методом ПЦР. ОТ-ПЦР широко используется для обнаружения вирусного генома SARS-CoV-2.
- Такие заболевания, как коклюш (или коклюш ), вызываются бактериями Bordetella pertussis. Эта бактерия отличается серьезной острой респираторной инфекцией, поражающей различными животными и людьми, и привела к гибели многих маленьких детей. Токсин коклюша представляет собой экзотоксин белка, вступает в реакцию с различными типами клеток, такими как Т-лимфоциты, которые играют роль в клеточном иммунитете. ПЦР - важный инструмент тестирования, который может использовать в гене токсина коклюша. Она очень эффективна для диагностики коклюша по с посевом.
Криминалистические приложения
Развитие основанной на ПЦР генетики (или ДНК ) протоколы снятия отпечатков пальцев найти широкое применение в криминалистике :
- В своей наиболее разборчивой форме генетический отпечаток может однозначно отличить любого человека от всей популяции мир. Небольшие образцы ДНК можно выделить с места преступления и сравнить с образцами ДНК подозреваемых или с базой данных ДНК более ранних раннихств или осужденных. Более простые версии этих тестов часто используются для быстрого исключения подозреваемых в ходе уголовного расследования. Доказательства прошлых преступлений могут быть проверены, чтобы подтвердить или оправдать людей, используемых осужденных.
- Криминалистическое типирование ДНК стало эффективным способом или реабилитации подозреваемых в совершении преступлений анализу обнаруженных на месте преступления. Геном человека имеет множество повторяющихся областей, которые можно найти в последовательностях генома в некодирующих областях. В частности, до 40% ДНК человека повторяется. Есть две различные категории этих повторяющихся некодирующих органов в геноме. Первая категория называется тандемными повторами с переменным числом (VNTR), длина которых составляет 10–100 пар оснований, вторая категория называется короткими тандемными повторами (STR) и из повторяющихся участков из 2–10 пар оснований. ПЦР используется для амплификации нескольких хорошо известных VNTR и STR с использованием праймеров, фланкирующих каждого из повторяющихся областей. Размеры фрагментов, полученные от любого человека для каждой из STR, указывать, какие аллели присутствуют. Путем анализа нескольких STR для отдельного человека будет обнаружен набор аллелей для каждого человека, который статистически может быть уникальным. Исследователи определили полную последовательность генома человека. Эта последовательность может быть легко доступна через веб-сайт NCBI и используется во многих реальных приложениях. Например, ФБР составило набор сайтов ДНК-маркеров, используемых для идентификации, и они называются базой данных ДНК комбинированной системы ДНК (CODIS). Использование этой базы данных позволяет использовать статистический анализ для определения вероятности совпадения образца ДНК. ПЦР - очень мощный и важный аналитический инструмент, который можно использовать для криминалистического типа ДНК, потому что исследователям нужно очень небольшое количество ресурсов для анализа ДНК. Например, один человеческий волос с прикрепленным волосяным фолликулом обеспечивает достаточно ДНК для анализа. Точно так же несколько сперматозоидов, образцов кожи из-под ногтей или небольшое количество крови предоставить достаточно ДНК для окончательного анализа.
- Менее различающие формы дактилоскопии ДНК могут помочь в ДНК-тестирование на отцовство, при котором индивидуум сравнивается со своими близкими родственниками. Можно протестировать ДНК неопознанных человеческих людей и сравнить с ДНК родителей, братьев, сестер или детей. Аналогичное тестирование может быть использовано для подтверждения биологических родителей усыновленного (или похищенного) ребенка. Фактический биологический отец новорожденного также может быть подтвержден (или исключен).
- Было показано, что конструкция ПЦР AMGX / AMGY не только облегчает амплификацию последовательностей ДНК из очень крохотных количеств генома. Однако его также можно использовать для определения пола в реальном времени по образцам костей. Это дает нам мощный и эффективный способ определения совершенного пола не только новых, нынешних подозреваемых в древних преступлениях.
Приложения для исследований
ПЦР позволяет быстро получить короткие фрагменты ДНК, если известна не более чем последовательность двух праймеров. Эта способность ПЦР дополняет многие методы, такие как создание зондов гибридизации для гибридизации Саузерн или нозерн-блоттинг. ПЦР обеспечивает даже эти методы с большим количеством чистой ДНК, иногда в одной цепи.
Задача секвенирования ДНК также может быть облегчена за счет ПЦР. Известные сегменты ДНК могут быть получены от пациента с генетической мутацией заболеваний. Модификации метода амплификации позволяют извлекать сегменты из неизвестного генома или генерировать одну цепь интересующей области.ПЦР имеет множество применений в более традиционном процессе клонирования ДНК. Он может извлекать сегменты для вставки в вектор из более крупного генома, который может быть доступен только в небольших количествах. Используя единый набор «векторных праймеров», он также может анализировать или извлекать фрагменты, которые уже были вставлены в структуру. Некоторые изменения в протоколе ПЦР могут вызывать мутации (общие или сайт-ориентированные) вставленного фрагмента.Сайты с тегами последовательностей - это процесс, в котором ПЦР используется в качестве индикатора определенного сегмента генома. в конкретном клоне. Проект генома человека обнаружил, что это приложение имеет жизненно важное значение для картирования клонов космических, которые они секвенировали и для новых результатов, полученных в лабораториях.Применение ПЦР - филогенетика анализ ДНК из древних источников, например, найденной в восстановленных костях неандертальцев, из замороженных тканей мамонтов или из мозга египетских мумий. В некоторых случаях сильно деградировавшая ДНК из этих источников может быть повторно собрана на ранних стадиях амплификации.Распространенным применением ПЦР является изучение паттернов экспрессии гена. Ткани (или даже отдельные клетки) можно проанализировать на разных этапах, чтобы увидеть, какие гены стали активными, а какие выключены. Это приложение также может использовать количественную ПЦР для количественного определения фактических уровней экспрессииСпособность ПЦР одновременно амплифицировать несколько локусов из отдельных сперматозоидов значительно расширила более традиционную задачу генетической разработки путем изучения хромосомных кроссоверов после мейоза. Редкие случаи кроссовера между очень близкими локусами наблюдались непосредственно при анализе отдельных отдельных сперматозоидов. Аналогичным образом можно анализировать необычные делеции, вставки, транслокации или инверсии, и все это без необходимости ждать (или платить) за долгие и трудоемкие процессы оплодотворения, эмбриогенеза и т. Д.Сайт-направленный мутагенез : ПЦР может использоваться для создания мутантных генов с мутациями, выбранными учеными по желанию. Эти мутации могут быть выбраны для понимания того, как белки выполняют свои функции, а также для изменения или улучшения функции белков.Преимущества
ПЦР имеет ряд преимуществ. Его довольно просто понять и использовать, и он быстро дает результаты. Этот метод очень чувствителен и позволяет производить от миллионов до миллиардов копий конкретного продукта для секвенирования, клонирования и анализа. qRT-PCR имеет те же преимущества, что и PCR, с дополнительным преимуществом количественной оценки синтезированного продукта. Таким образом, его можно использовать для анализа изменений уровней экспрессии генов при опухолях, микробах или других болезненных состояниях.
ПЦР - очень мощный и практичный инструмент исследования. ПЦР выясняет последовательность многих заболеваний неизвестной этиологии. Этот метод может помочь идентифицировать последовательность ранее неизвестных вирусов, связанных с уже известными, и, таким образом, дать нам лучшее понимание самого заболевания. Если можно будет еще больше упростить процедуру и разработать чувствительные нерадиометрические системы обнаружения, ПЦР займет видное место в клинической лаборатории на долгие годы.
Ограничения
Одно из основных ограничений ПЦР заключается в том, что предварительная информация о целевой последовательности необходима для создания праймеров, которые позволят ее селективную амплификацию. Это означает, что, как правило, пользователи ПЦР должны знать точную последовательность (последовательности) перед целевой областью на каждой из двух одноцепочечных матриц, чтобы гарантировать, что ДНК-полимераза должным образом связывается с гибридами праймер-матрица и впоследствии генерирует вся область-мишень во время синтеза ДНК.
Как и все ферменты, ДНК-полимеразы также подвержены ошибкам, что, в свою очередь, вызывает мутации в генерируемых ПЦР-фрагментах.
Еще одним ограничением ПЦР является то, что даже самое маленькое количество загрязняющей ДНК могут быть усилены, что приведет к вводящим в заблуждение или неоднозначным результатам. Чтобы свести к минимуму вероятность заражения, исследователи должны зарезервировать комнаты для подготовки реагентов, ПЦР и анализа продукта. Реагенты следует разливать в одноразовые аликвоты. Следует регулярно использовать пипетки со сменными поршнями и удлиненными наконечниками.
Образцы окружающей среды, содержащие гуминовые кислоты, могут препятствовать амплификации ПЦР и приводить к неточным результатам.
Варианты
- Аллель-специфическая ПЦР: метод диагностики или клонирования, основанный на однонуклеотидных вариациях (SNV не следует путать с SNP ) (одноосновные различия у пациента). Это требует предварительного знания ДНК, включая использование между аллелями, и использует 3-концы которых охватываются SNV (обычно включаемый буфер пары оснований вокруг SNV). ПЦР-амплификация в строгих условиях намного менее эффективна при наличии несоответствия между матрицей и праймером, поэтому успешная амплификация с помощью SNP-специфичного праймера сигнализирует о наличии специфического SNP в последовательности. Для получения дополнительной информации см. SNP-генотипирование.
- Assembly PCR или Polymerase Cycling Assembly (PCA): искусственный синтез длинных последовательностей ДНК путем выполнения ПЦР на пуленых олигонуклеотидов с короткими перекрывающими сегментами. Олигонуклеотиды чередуются между смысловым и антисмысловым направлениями, и перекрывающиеся сегменты определяют порядок фрагментов ПЦР, самым избирательно производным конечный длинный продукт ДНК.
- Асимметричная ПЦР : предпочтительно амплифицирует одну цепь ДНК в двухцепочечной ДНК шаблон. Он используется в секвенировании и гибридизационном зондировании, когда требуется амплификация только одной из двух комплементарных цепей. ПЦР проводится как обычно, но с большим избытком праймера для цепи, предназначенной для амплификации. Из-за медленной (арифметической ) амплификации на более поздних этапах реакции после израсходования ограничивающего праймера требуются дополнительные циклы ПЦР. Недавняя модификация этого процесса, известная как Linear-After-Exponential-PCR (LATE-PCR), использует ограничивающий праймер с более высокой температурой плавления (Tm ), чтобы избыточный праймер, поддерживая эффективность реакции как ограничивающую концентрацию праймера. уменьшает середину реакции.
- Конвективная ПЦР: псевдоизотермический способ проведения ПЦР. Вместо многократного сообщения и смеси для ПЦР раствор подвергается температурному градиенту. Возникающий в результате конвективного потока, вызванный термической нестабильностью, автоматически перетасовывает реагенты ПЦР из горячих и холодных потоков, многократно принудительно ПЦР. Такие параметры, как тепловые граничные условия и геометрия корпуса ПЦР, могут быть оптимизированы для получения надежной и быстрой ПЦР за счет использования появления хаотических полей потока. Такая установка ПЦР с конвективным потоком снижает энергопотребление устройства и время работы.
- ПЦР с исходящей информацией: высокопараллельный метод получения точных молекул ДНК для синтеза генов. Сложная библиотека молекул ДНК модифицируется уникальными фланкирующими тегами перед массовым параллельным секвенированием. Затем праймеры, ориентированные на метки, позволяют получать молекулы с желаемыми последовательностями с помощью ПЦР.
- Цифровая ПЦР (dPCR): используется для количества отслеживают ДНК в образце ДНК. Образец ДНК сильно разбавляет цели, поэтому после нескольких параллельных ПЦР не поступают ни одна молекула ДНК. Концентрация отрицательной ДНК рассчитывается с использованием нескольких результатов. Отсюда и название «цифровая ПЦР».
- Зависимая от геликазы ампли : аналогичная традиционная ПЦР, но использует постоянную температуру, а не циклическое переключение между циклами денатурации и отжига / удлинения. ДНК-геликаза, фермент, раскручивающий ДНК, используется вместо термической денатурации.
- ПЦР с горячим стартом : метод, который уменьшает неспецифическую амплификацию на начальных этапах настройки ПЦР. Это может быть выполнено путем нагревания генератора до температуры денатурации (например, 95 ° C) перед добавлением полимеразы. Были разработаны специальные ферментные системы, которые ингибируют активность при окружающей среде либо за счет связывания антитела, либо за счет ковалентно связанных ингибиторов, которые диссоциируют только на стадии высокотемпературной активации. ПЦР с горячим стартом / холодным окончанием достигается с помощью новых гибридных полимераз, которые неактивны при температуре окружающей среды и мгновенно активируются при температуре элонгации.
- In silico PCR (цифровая ПЦР, виртуальная ПЦР, электронная ПЦР, электронная ПЦР) относится к вычислительным инструментам, используемым для расчета теоретических результатов полимеразной цепной реакции с использованием данного набора праймеров (зондов ) для амплификации последовательностей ДНК из секвенированных геном или транскриптом. In silico ПЦР была предложена в качестве образовательного инструмента для молекулярной биологии.
- ПЦР, специфичная для межпоследовательности (ISSR): метод ПЦР для снятия отпечатков ДНК, при котором амплифицируются области между простыми повторами последовательностей для достижения уникального отпечатка длины амплифицированных фрагментов.
- Обратная ПЦР : обычно используется для идентификации фланкирующих последовательностей вокруг геномных вставок. Он включает серию расщеплений ДНК и самолигирования, в результате чего получается известная на любом конце неизвестной последовательности.
- ПЦР, опосредованная лигирование: использует небольшие линкеры ДНК лигирование с интересующей ДНК и отжиг нескольких праймеров с линкерами ДНК; он использовался для секвенирования ДНК, прогулок по геному и ДНК-следа.
- ПЦР с метилированием (MSP): разработано Стивеном Бейлином и Джеймс Г. Херман из Медицинской школы Джонса Хопкинса и используется для обнаружения метилирования CpG-островков в геномной ДНК. Сначала ДНК обрабатывают бисульфитом натрия, который превращает неметилированные цитозиновые основания в урацил, который распознается праймерами ПЦР как тимин. Затем проводят две ПЦР на модифицированной ДНК с использованием идентичных наборов праймеров, за исключением любых островков CpG в последовательности праймеров. В этих точках один набор праймеров распознает ДНК с цитозинами для амплификации метилированной ДНК, один набор распознает ДНК с урацилом или тимином для амплификации неметилированной ДНК. MSP с использованием кПЦР также может быть для получения количественной, а не качественной информации о метилировании.
- ПЦР с минипраймером: использует термостабильную полимеразу (S-Tbr), которая может происходить от коротких праймеров (smalligos) длиной до 9 или 10 нуклеотидов. Этот метод позволяет нацеливать ПЦР на меньшие участки связывания праймера и используется для амплификации консервативных последовательностей ДНК, таких как ген 16S (или эукариотической 18S) рРНК.
- Мультиплексная амплификация зонда, зависимая от лигирования (MLPA): позволяет амплифицировать несколько мишеней с одним парой праймеров, что позволяет избежать ограничений разрешения мультиплексной ПЦР (см. Ниже).
- Мультиплексная ПЦР : состоит из нескольких наборов праймеров в одной смеси ПЦР для получения ампликонов разного размера, характерны для разных последовательностей ДНК. Путем нацеливания на несколько генов одновременно можно получить дополнительную информацию из теста, для которого в результате этого будет потеряно время в несколько раз больше реагентов и больше времени для выполнения. Температуры отжига для каждого из наборов праймеров должны быть оптимизированы для правильной работы в рамках одной реакции, а также размеры ампликонов. Чтобы сформировать полосы при визуализации с помощью гель-электрофореза.
- ПЦР с использованием наночастиц (наноПЦР), должны быть достаточно пары оснований: некоторые наночастицы (НЧ) могут повысить эффективность ПЦР (таким образом, они называются наноПЦР.), а некоторые даже превзойти оригинальные усилители ПЦР. Сообщалось, что квантовые точки (КТ) могут улучшить специфичность и эффективность ПЦР. Однослойные углеродные нанотрубки (ОСУНТ) и многостенные углеродные нанотрубки (МУНТ) эффективны для увеличения амплификации длинной ПЦР. Углеродный нанопорошок (CNP) может повысить эффективность повторной ПЦР и длительной ПЦР, в то время как было обнаружено, что оксид цинка, диоксид титана и наночастицы Ag увеличивают выход ПЦР. Предыдущие данные показали, что неметаллические НЧ сохраняют приемлемую точность амплификации. Настоящие большие возможности для усовершенствования ПЦР, очевидно, что существует большой потенциал для усовершенствования технологий наноПЦР и разработки продукта.
- Вложенная ПЦР : увеличивает специфичность амплификации ДНК за счет уменьшения фона из-за специфической амплификации ДНК. Два набора праймеров используют в двух последовательных ПЦР. В первой реакции одна пара праймеров используется для создания продуктов ДНК, которые, помимо намеченной мишени, еще не состоялись из неспецифически амплифицированных фрагментов ДНК. Продукт (-ы) используют во время ПЦР с набором праймеров, элементы связывания которых полностью или частично отличаются от каждого из праймеров, используемых в 1-й генерации, и установлены на 3 'от каждого из них. Вложенная ПЦР более эффективна для специфических амплификации длинных фрагментов ДНК, чем обычная ПЦР, но она требует более детального знания целевых последовательностей.
- ПЦР с перекрытием-удлинением или сплайсинг перекрывающегося удлинения (SOEing): a генная инженерия метод, используемый для сращивания двух или более фрагментов ДНК, комплементарные последовательности. Он используется для соединения частей ДНК, регуляторы гены, устанавливаемые или мутации; методика позволяет создать специфические и длинные конструкции ДНК. Он также может вносить делеции, вставки или точечные мутации в последовательность ДНК.
- ПАН-АК: использует изотермические условия для амплификации и может быть в живых клетках.
- количественное ПЦР (qPCR): используется для количества измерения наблюдать (обычно в реальном времени). Он количественно измеряет начальные количества ДНК, кДНК или РНК. количество ПЦР обычно используется для присутствия ДНК в образце и количества ее копий в образце. Количественная ПЦР имеет очень высокую степень точности. В количественных методах ПЦР используются флуоресцентные красители, такие как Sybr Green, EvaGreen или флуорофор -содержащие ДНК-зонды, такие как TaqMan, для измерения количества амплифицированного продукта в настоящем времени. Его также иногда сокращают до ОТ-ПЦР (ПЦР в реальном времени), но это сокращение следует использовать только для ПЦР с обратной транскрипцией. qPCR представляет собой подходящее сокращение для количественной ПЦР (ПЦР в реальном времени).
- ПЦР с обратной транскрипцией (RT-PCR ): для амплификации ДНК из РНК. Обратная транскриптаза осуществляет обратную транскрипцию РНК в кДНК, которая затем амплифицируется с помощью ПЦР. ОТ-ПЦР широко используется в профилировании экспрессии для определения экспрессии гена или для определения транскрипта РНК, включая сайты начала и окончания транскрипции. Если последовательность геномной ДНК гена известна, можно использовать ОТ-ПЦР для картирования местоположения экзонов и интронов в гене. 5'-конец гена (соответствующий сайту начала транскрипции) обычно идентифицируется с помощью RACE-PCR (Rapid Amplification of cDNA Ends).
- РНКазе H-зависимой ПЦР (rhPCR): модификация ПЦР, в которой используются праймеры с 3 'блоком удлинения, который может быть удален термостабильным ферментом РНКазой HII. Эта система уменьшает количество димеров праймеров и позволяет проводить мультиплексные реакции с большим праймеров.
- ПЦР с одним специфическим праймером (SSP-ПЦР): позволяет амплифицировать двухцепочечную ДНК, даже если информация о предоставлении только на одном конце. Этот метод допускает амплификацию генов, для которых доступна только частичная информация о отслеживании, и позволяет однонаправленно перемещаться по геному от известного к неизвестным участкам хромосомы.
- Твердая фазовая ПЦР: охватывает несколько значений, включая Амплификация полонии (где колонии ПЦР получены, например, в гелевой матрице), мостиковая ПЦР (праймеры ковалентно связаны с твердой подложкой), обычная ПЦР (где асимметричная ПЦР используется в использовании твердой подложки, несущей праймер с последовательностью, используемой из водных праймеров) и улучшенная твердофазная ПЦР может быть улучшена для использования праймера с высокой Tm и вложенной твердой подложки с необязательным применением «. стадии »для облегчения праймирования твердой подложки). 231>
- Самоубийственная ПЦР: обычно используется в палеогенетике или других исследованиях, предотвращающих ложноположительные результаты и обеспечение специфичности амплифицированного фрагмента наивысшим приоритетом. Первоначально погибшим он был описан в исследовании для проверки наличия микроба Yersinia pestis в образцах зубов, взятых из могил 14-го века людей, предположительно от чумы во время средневековой эпидемии черной смерти. Этот метод предписывает использовать любые комбинации праймеров только один раз в ПЦР (отсюда и термин «самоубийство»), который никогда не должен быть назначен какой-либо положительной контрольной реакцией ПЦР, и праймеры всегда должны быть нацелены на область генома, никогда ранее не амплифицированную в lab с использованием этого или любого другого набора праймеров. Это гарантирует, что в лаборатории не будет уничтожена ДНК из предыдущих ПЦР.
- Термическая асимметричная чересстрочная ПЦР (TAIL-PCR): для выделения неизвестной последовательности, фланкирующей известную последовательность. В пределах используемой TAIL-PCR использует вложенную пару праймеров с разными температурами отжига; вырожденный праймер используется для амплификации в направлении, противоположном неизвестной последовательности.
- ПЦР при приземлении <>>(ПЦР с понижением): вариант ПЦР, который направлен на снижение скорости инициирования снижения температуры отжига по мере цикла ПЦР прогрессирует. Температура отжига на начальных циклах обычно на несколько градусов (3–5 ° C) выше T m используемых праймеров, в то время как на более поздних циклах она составляет несколько градусов (3–5 ° C). В) ниже грунтовки Т м. Высокие высокие температуры обеспечивают высокие характеристики внедрения праймеров.
- Универсальная быстрая ходьба: для ходьбы по геному и генетическому дактилоскопированию с использованием более специфических двухсторонних «ПЦР» по сравнению с традиционными «односторонними» подходами (с использованием только одного специфичного гена праймера и одного общего праймера, что) может приводить к артефактному «шуму») благодаря механизму, включающему формирование лариатической структуры. Модернизированные производные UFW представляют собой LaNe RAGE (лариат-зависимая вложенная ПЦР для быстрой амплификации концов геномной ДНК), 5'RACE LaNe и 3'RACE LaNe.
История

Схематическое изображение примерной пары праймеров. Использование праймеров в анализе in vitro для ДНК было важных нововведением, возможностейившим индикатором ПЦР.
Термостойкие ферменты, являющиеся основными компонентами полимеразной цепной реакции, были обнаружены в 1960-х годах как продукт микробной формы жизни, которая жила в перегретых Йеллоустонского Грибного источника.
Статья 1971 года в Журнал молекулярной биологии, автор Кьелл Клеппе и сотрудники в лаборатории Х. Гобинд Хорана впервые описал метод использования ферментативного анализа для репликации короткой ДНК-матрицы с праймерами in vitro. Однако это раннее проявление основного принципа ПЦР не будет получено особого внимания в то время, и полимеразной цепной реакции в 1983 году обычно приписывают Кэри Маллис.

"Baby Blue", прототипу машины 1986 года для выполнения ПЦР
Когда Маллис разработал ПЦР в 1983 году, он работал в Эмеривилле, Калифорния, в Cetus Corporation, одной из первых биотехнологических компаний году, где он отвечал за синтез коротких цепочек ДНК. Муллис написал, что он придумал идею PCR, путешествуя по шоссе Шоссе Тихоокеанского побережья однажды ночью в своей машине. Он мысленно использовал с новым способом анализа изменений (мутаций) в ДНК, когда понял, что вместо этого он изобрел метод амплификации любой области ДНК посредством повторяющихся циклов дупликации под действием ДНК-полимеразы. В Scientific American Маллис резюмировал часть: «Продолжить с одной молекулы ДНК генетического материала, ПЦР может генерировать 100 миллиардов подобных молекул за полдень. Реакцию легко выполнить. Больше для этого не требуется. чем пробирка, несколько простых реагентов и источник тепла ». Снятие отпечатков пальцев ДНК было впервые использовано для защиты отцовства в 1988 году.
Муллис был удостоен Нобелевской премии по химии в 1993 году за свое изобретение, через семь лет после того, как он и его коллеги в Цете впервые применил свое предложение на практике. Работа Маллиса 1985 года с Р.К. Сайки и Х.А. Эрлихом «Ферментативная амплификация геномных последовательностей β-глобина и анализ сайтов рестрикции для диагностики серповидноклеточной анемии» - изобретение полимеразной цепной реакции (ПЦР) - была удостоена награды Citation for Chemical Breakthrough от Отдел истории химии Американского химического общества в 2017 году.
В основе метода ПЦР лежит использование подходящей ДНК-полимеразы, способной выдерживать высокие температуры>90 ° C (194 ° F), необходимое для разделения двух цепей ДНК в двойной спирали ДНК после каждого цикла репликации. ДНК-полимеразы, первоначально использованные для in vitro экспериментов, предшествующих ПЦР, были неспособны выдерживать эти высокие температуры. Таким образом, ранние процедуры репликации ДНК были очень неэффективными и трудоемкими, требовали большого количества ДНК-полимеразы и непрерывной обработки на протяжении всего процесса.
Открытие в 1976 г. Taq-полимеразы - ДНК-полимеразы, выделенной из термофильных бактерий, Thermus aquaticus, которые естественным образом живут в горячих ( От 50 до 80 ° C (от 122 до 176 ° F)), например в горячих источниках, - проложили путь к значительным улучшениям метода ПЦР. ДНК-полимераза, выделенная из T. aquaticus, стабильна при высоких температурах и остается активной даже после денатурации ДНК, что устраняет необходимость добавления новой ДНК-полимеразы после каждого цикла. Это позволило автоматизировать процесс амплификации ДНК на основе термоциклера.
Патентные споры
Метод ПЦР был запатентован Кэри Маллис и передан Cetus Corporation, где Маллис работал, когда изобрел эту технику в 1983 году. Фермент полимераза Taq также был защищен патентами. Было несколько громких судебных процессов, связанных с этой техникой, в том числе безуспешный судебный процесс, поданный DuPont. Швейцарская фармацевтическая компания Hoffmann-La Roche приобрела права на патенты в 1992 году и в настоящее время владеет теми, которые все еще защищены.
Связанная патентная битва за фермент полимеразу Taq все еще продолжается в нескольких юрисдикциях по всему миру между компаниями Roche и Promega. Юридические аргументы вышли за рамки срока действия оригинальных патентов на ПЦР и Taq-полимеразу, срок действия которых истек 28 марта 2005 г.
См. Также
 Портал биологии
Портал биологии
Ссылки
Внешние ссылки
 Полоска из восьми пробирок для ПЦР, каждая из которых содержит 100 мкл реакционной смеси
Полоска из восьми пробирок для ПЦР, каждая из которых содержит 100 мкл реакционной смеси  Размещение полоски из восьми пробирок для ПЦР в термоциклер
Размещение полоски из восьми пробирок для ПЦР в термоциклер  A термоциклер для ПЦР
A термоциклер для ПЦР  Старый трехтемпературный термоциклер для ПЦР
Старый трехтемпературный термоциклер для ПЦР 
 Бромид этидия -окрашенные продукты ПЦР после гель-электрофореза. Два набора праймеров использовали для амплификации практику из трех различных образцов ткани. В образце № 1 амплификации нет; Полосы ДНК в образцах №2 и №3 указывает на успешную амплификацию внедрить. Гель также показывает положительный контроль и лестницу ДНК, установленные фрагменты ДНК ДНК для определения размера экспериментальных ПЦР.
Бромид этидия -окрашенные продукты ПЦР после гель-электрофореза. Два набора праймеров использовали для амплификации практику из трех различных образцов ткани. В образце № 1 амплификации нет; Полосы ДНК в образцах №2 и №3 указывает на успешную амплификацию внедрить. Гель также показывает положительный контроль и лестницу ДНК, установленные фрагменты ДНК ДНК для определения размера экспериментальных ПЦР. 

 Электрофорез фрагментов ДНК, амплифицированных с помощью ПЦР. (1) Отец. (2) Ребенок. (3) Мать. Ребенок унаследовал некоторые, но не все отпечатки пальцев каждого из своих родителей, что дает ему новый уникальный отпечаток.
Электрофорез фрагментов ДНК, амплифицированных с помощью ПЦР. (1) Отец. (2) Ребенок. (3) Мать. Ребенок унаследовал некоторые, но не все отпечатки пальцев каждого из своих родителей, что дает ему новый уникальный отпечаток.  Схематическое изображение примерной пары праймеров. Использование праймеров в анализе in vitro для ДНК было важных нововведением, возможностейившим индикатором ПЦР.
Схематическое изображение примерной пары праймеров. Использование праймеров в анализе in vitro для ДНК было важных нововведением, возможностейившим индикатором ПЦР.  "Baby Blue", прототипу машины 1986 года для выполнения ПЦР
"Baby Blue", прототипу машины 1986 года для выполнения ПЦР