| Yersinia pestis | |
|---|---|
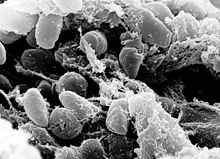 | |
| A сканирующий электрон микрофотография с изображением массы бактерий Yersinia pestis в передней кишке инфицированной блохи | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Протеобактерии |
| Класс: | Гаммапротеобактерии |
| Порядок : | Enterobacterales |
| Семейство: | Yersiniaceae |
| Род: | Yersinia |
| Виды: | Y. pestis |
| Биномиальное название | |
| Yersinia pestis . (Lehmann Neumann, 1896). van Loghem, 1944 | |
| Синонимы | |
Bacillus
| |
Yersinia pestis (ранее Pasteurella pestis) - грамотрицательная, неподвижная, палочковидная, coccobacillus бактерия, без спор. Это факультативный анаэробный организм, который может инфицировать людей через блоху восточных крыс (Xenopsylla cheopis). Он вызывает болезнь чума, которая принимает три основные формы: легочная, септическая и бубонная.
Все три формы ответственны за высокий -смертность эпидемии на протяжении всей истории человечества, включая чуму Юстиниана в шестом веке; Черная смерть, ставшая причиной смерти по крайней мере одной трети европейского населения между 1347 и 1353 годами; и Третья пандемия, иногда называемая современной чумой, которая началась в конце 19 века в Китае и распространилась крысами на пароходах, унеся почти 10 миллионов жизней.
Эти эпидемии. возможно, возникли в Средней Азии или Китае и попали на запад по торговым путям. Однако исследования 2018 года обнаружили свидетельства наличия патогена в древней шведской гробнице, что могло быть причиной того, что было описано как неолитический упадок около 3000 г. до н.э., когда европейское население значительно сократилось. Это позволяет предположить, что Y. pestis, возможно, возник в Европе в культуре Cucuteni-Trypillia, а не в Азии.
Y. pestis был открыт в 1894 году Александром Йерсеном, швейцарским / французским врачом и бактериологом из Института Пастера, во время эпидемии чума в Гонконге. Йерсин был членом философской школы Пастера. Китасато Шибасабуро, японский бактериолог, практикующий методологию Коха, в то время также занимался поиском возбудителя чумы. Однако на самом деле Ерсин связал чуму с Y. pestis. Ранее называвшийся Pasteurella pestis, в 1944 году этот организм был переименован в Yersinia pestis.
Ежегодно Всемирная организация здравоохранения сообщает о тысячах случаев чумы, хотя и с надлежащим лечение антибиотиками, прогноз для пострадавших теперь намного лучше. Во время войны во Вьетнаме число случаев заболевания в Азии увеличилось в 5-6 раз, возможно, из-за нарушения экосистем и более тесной близости между людьми и животными. В настоящее время чума обычно встречается в странах Африки к югу от Сахары и на Мадагаскаре - районах, на которые в настоящее время приходится более 95% зарегистрированных случаев. Чума также оказывает пагубное воздействие на млекопитающих, кроме человека. В США под угрозой находятся такие млекопитающие, как чернохвостая луговая собачка и находящийся под угрозой исчезновения черноногий хорек.
Y. pestis - это неподвижная палочковидная факультативная анаэробная бактерия с биполярным окрашиванием (придавая ей вид английской булавки ), которая образует слой антифагоцитарной слизи. Подобно другим видам Yersinia, он дает отрицательный результат на уреазу, ферментацию лактозы и индол. Его ближайшим родственником является возбудитель желудочно-кишечного тракта Yersinia pseudotuberculosis, а более отдаленный - Yersinia enterocolitica.
Полная геномная последовательность доступна для двух из три подвида Y. pestis: штамм KIM (биовара Y. p. Mediumis) и штамм CO92 (биовара Y. p. orientalis, полученный из клинического изолята в США). По состоянию на 2006 г. геномная последовательность штамма биовара Antiqua была недавно завершена. Как и в случае с другими патогенными штаммами, существуют признаки мутации потери функции. Длина хромосомы штамма KIM составляет 4600755 пар оснований; длина хромосомы штамма CO92 составляет 4 653 728 пар оснований. Подобно Y. pseudotuberculosis и Y. enterocolitica, Y. pestis является хозяином плазмиды pCD1. Он также содержит две другие плазмиды, pPCP1 (также называемые pPla или pPst) и pMT1 (также называемые pFra), которые не переносятся другими видами Yersinia. pFra кодирует фосфолипазу D, которая важна для способности Y. pestis передаваться блохами. pPla кодирует протеазу, Pla, которая активирует плазмин у человека-хозяина и является очень важным фактором вирулентности для легочной чумы. Вместе эти плазмиды и остров патогенности, называемый HPI, кодируют несколько белков, которые вызывают патогенез, которым известен Y. pestis. Помимо прочего, эти факторы вирулентности необходимы для бактериальной адгезии и инъекции белков в клетку-хозяина, инвазии бактерий в клетку-хозяина (через систему секреции типа III ), а также приобретения и связывания железа. собирают из красных кровяных телец (по сидерофорам ). Считается, что Y. pestis произошел от Y. pseudotuberculosis, отличающиеся только наличием плазмид специфической вирулентности.
Комплексный и сравнительный протеомный анализ штамма Y. pestis KIM был проведен в 2006 году. Анализ был сосредоточен на переходе к условиям роста, имитирующим рост клеток-хозяев.
Было идентифицировано множество бактериальных малых некодирующих РНК, играющих регуляторные функции. Некоторые могут регулировать гены вирулентности. Около 63 новых предполагаемых мРНК были идентифицированы посредством глубокого секвенирования мРНК-ома Y. pestis. Среди них был Yersinia-specific (также присутствующий в Y. pseudotuberculosis и Y. enterocolitica) Ysr141 (малая РНК Yersinia 141). Было показано, что мРНК Ysr141 регулирует синтез эффекторного белка системы секреции типа III (T3SS) YopJ. Yop-Ysc T3SS является важным компонентом вирулентности для видов Yersinia. Многие новые мРНК были идентифицированы из Y. pestis, выращенного in vitro, и в инфицированных легких мышей, что позволяет предположить, что они играют роль в бактериальной физиологии или патогенезе. Среди них sR035, предположительно спаривающийся с областью SD и сайтом инициации транскрипции термочувствительного регулятора ymoA, и sR084, предсказанный для спаривания с мехом, регулятором захвата железа.
 Блоха восточных крыс (Xenopsylla cheopis), инфицированная бактерией Y. pestis , которая проявляется в виде темной массы в кишечнике: передняя кишка (proventriculus ) этой блохи заблокирована биопленкой Y. pestis ; когда блоха пытается питаться неинфицированным хозяином, Y. pestis срыгивает в рану, вызывая инфекцию.
Блоха восточных крыс (Xenopsylla cheopis), инфицированная бактерией Y. pestis , которая проявляется в виде темной массы в кишечнике: передняя кишка (proventriculus ) этой блохи заблокирована биопленкой Y. pestis ; когда блоха пытается питаться неинфицированным хозяином, Y. pestis срыгивает в рану, вызывая инфекцию. В городских и лесных (лесных) циклах Y. pestis распространяется большая часть встречается между грызунами и блохами. В лесном цикле грызун является диким, но в городском цикле грызун - это прежде всего коричневая крыса (Rattus norvegicus). Кроме того, Y. pestis может распространяться из городской среды и обратно. Передача человеку обычно происходит через укус инфицированных блох. Если заболевание перешло в легочную форму, люди могут передавать бактерию другим людям, кашляя, рвоту и, возможно, чихая.
Несколько видов грызунов служат основным резервуаром Y. pestis в окружающей среде. В степях, естественный резервуар считается главным образом сурком. Считается, что на западе Соединенных Штатов несколько видов грызунов поддерживают Y. pestis. Однако ожидаемой динамики заболевания ни у одного грызуна не обнаружено. Известно, что несколько видов грызунов обладают переменной резистентностью, что может приводить к бессимптомному статусу носителя. Свидетельства указывают на то, что блохи от других млекопитающих играют роль в вспышках чумы среди людей.
Отсутствие знаний о динамике распространения чумы у млекопитающих также верно и среди восприимчивых грызунов, таких как чернохвостая луговая собачка (Cynomys ludovicianus), при котором чума может вызвать коллапс колонии, что окажет огромное влияние на пищевые сети прерий. Однако динамика передачи у луговых собачек не соответствует динамике блокированных блох; трупы, незаблокированные блохи или другой переносчик инфекции, возможно, могли бы быть важны вместо этого.
В других регионах мира резервуар инфекции четко не идентифицирован, что усложняет программы профилактики и раннего предупреждения. Один из таких примеров был замечен во вспышке 2003 г. в Алжире.
Передача Y. pestis блохами хорошо изучена. Первоначальное приобретение Y. pestis вектором происходит во время кормления инфицированным животным. Затем несколько белков способствуют поддержанию бактерий в пищеварительном тракте блох, в том числе система хранения гемина и мышиный токсин Yersinia (Ymt). Хотя Ymt очень токсичен для грызунов и когда-то считалось, что его производят для повторного заражения новых хозяев, он важен для выживания Y. pestis у блох.
Система хранения гемина играет важную роль в развитии передача Y. pestis обратно млекопитающему-хозяину. Находясь в векторе насекомых, белки, кодируемые генетическими локусами системы хранения гемина, вызывают образование биопленки в преджелудке, клапане, соединяющем среднюю кишку с пищеводом.. Вероятно, присутствие этой биопленки необходимо для стабильного заражения блох. Агрегация в биопленке препятствует питанию, поскольку образуется масса свернувшейся крови и бактерий (названная «блоком Бакота» по имени энтомолога А.В. Бакота, первого, кто описал это явление). Передача Y. pestis происходит во время тщетных попыток блох прокормиться. Проглоченная кровь закачивается в пищевод, где она вытесняет бактерии, расположенные в преджелудочках, которые срыгивают обратно в кровеносную систему хозяина.
Патогенез из-за Y. pestis-инфекция млекопитающих-хозяев обусловлена несколькими факторами, включая способность этих бактерий подавлять и избегать нормальных реакций иммунной системы, таких как фагоцитоз и выработка антител. Укусы блох позволяют бактериям проходить через кожный барьер. Y. pestis экспрессирует активатор плазмина, который является важным фактором вирулентности для легочной чумы и который может разлагаться на сгустках крови для облегчения систематической инвазии. Многие из факторов вирулентности бактерий имеют антифагоцитарную природу. Два важных антифагоцитарных антигена, названные F1 (фракция 1) и V или LcrV, оба важны для вирулентности. Эти антигены продуцируются бактериями при нормальной температуре человеческого тела. Кроме того, Y. pestis выживает и продуцирует антигены F1 и V, пока он находится в белых кровяных тельцах, таких как моноциты, но не в нейтрофилах. Естественный или индуцированный иммунитет достигается за счет продукции специфических опсонических антител против антигенов F1 и V; антитела против F1 и V вызывают фагоцитоз нейтрофилов.
Кроме того, система секреции типа III (T3SS) позволяет Y. pestis вводить белки в макрофаги и другие иммунные клетки. Эти инъецированные T3SS белки, называемые внешними белками Yersinia (Yops), включают Yop B / D, которые образуют поры в мембране клетки-хозяина и связаны с цитолизом. YopO, YopH, YopM, YopT, YopJ и YopE вводятся в цитоплазму клеток-хозяев с помощью T3SS в пору, частично созданную YopB и YopD. Инъецированные Yops ограничивают фагоцитоз и пути передачи клеточных сигналов, важные для врожденной иммунной системы, как обсуждается ниже. Кроме того, некоторые штаммы Y. pestis способны вмешиваться в передачу иммунных сигналов (например, предотвращая высвобождение некоторых цитокинов ).
Ю. pestis размножается внутри лимфатических узлов, где он может избежать разрушения клетками иммунной системы, такими как макрофаги. Способность Y. pestis подавлять фагоцитоз позволяет ему расти в лимфатических узлах и вызывать лимфаденопатию. YopH представляет собой протеинтирозинфосфатазу, которая способствует способности Y. pestis уклоняться от клеток иммунной системы. Было показано, что в макрофагах YopH дефосфорилирует p130Cas, Fyb (Fyn связывающий белок) SKAP-HOM и Pyk, тирозинкиназа, гомологичная FAK. YopH также связывает субъединицу p85 фосфоинозитид-3-киназы, Gab1, адаптерные белки Gab2 и Vav Фактор обмена гуаниновых нуклеотидов.
YopE функционирует как белок, активирующий ГТФазу, для членов семейства Rho GTPаз, таких как RAC1. YopT представляет собой цистеиновую протеазу, которая ингибирует RhoA, удаляя изопренильную группу, которая важна для локализации белка на клеточной мембране. Было высказано предположение, что YopE и YopT действуют для ограничения YopB / D-индуцированного цитолиза. Это может ограничивать функцию YopB / D по созданию пор, используемых для вставки Yop в клетки-хозяева, и предотвращать YopB / D-индуцированный разрыв клеток-хозяев и высвобождение содержимого клетки, которое могло бы привлекать и стимулировать ответы иммунной системы.
YopJ представляет собой ацетилтрансферазу, которая связывается с консервативной α-спиралью из киназ MAPK. YopJ ацетилирует киназы MAPK по серинам и треонинам, которые обычно фосфорилируются во время активации каскада киназ MAP. YopJ активируется в эукариотических клетках путем взаимодействия с клеткой-мишенью фитиновой кислотой (IP6). Это нарушение активности протеинкиназы клетки-хозяина вызывает апоптоз макрофагов, и предполагается, что это важно для установления инфекции и уклонения от иммунного ответа хозяина. YopO представляет собой протеинкиназу, также известную как протеинкиназа A Yersinia (YpkA). YopO является мощным индуктором апоптоза макрофагов человека.
Также было высказано предположение, что бактериофаг - Ypφ - мог быть ответственным за повышение вирулентности этого организма.
В зависимости от того, какой формой чумы заражается человек, чума переходит в другое заболевание; однако чума в целом влияет на способность клетки-хозяина взаимодействовать с иммунной системой, не позволяя организму доставлять фагоцитарные клетки в область инфекции.
Ю. pestis - универсальный убийца. Известно, что помимо грызунов и людей он убивал верблюдов, кур и свиней. Домашние собаки и кошки также восприимчивы к чуме, но кошки с большей вероятностью заболеют при заражении. В любом случае симптомы аналогичны тем, которые испытывают люди, и могут быть смертельными для животного. Люди могут подвергаться воздействию при контакте с инфицированным животным (мертвым или живым) или при вдыхании капель инфекции, закашлявшейся больной собакой или кошкой в воздухе.
A формалин -инактивирован вакцина раньше была доступна в Соединенных Штатах для взрослых с высоким риском заражения чумой до момента удаления с рынка Управления по контролю за продуктами и лекарствами. Он имел ограниченную эффективность и мог вызвать тяжелое воспаление. Эксперименты с генной инженерией вакцины на основе антигенов F1 и V продолжаются и показывают многообещающие результаты. Однако бактерии, лишенные антигена F1, все еще вирулентны, а V-антигены достаточно вариабельны, так что вакцины, состоящие из этих антигенов, могут не обладать полной защитой. Медицинский научно-исследовательский институт инфекционных заболеваний армии США обнаружил, что экспериментальная вакцина на основе антигена F1 / V защищает макак, питающихся крабами, но не защищает африканскую зеленую обезьяну. виды. Систематический обзор Cochrane Collaboration не выявил исследований достаточного качества, чтобы сделать какое-либо заявление об эффективности вакцины.
 Y. pestis, выделенный [pt ] во время вспышки чумы в Порту в 1899 году
Y. pestis, выделенный [pt ] во время вспышки чумы в Порту в 1899 году В 1894 году два бактериолога, Александр Йерсин из Швейцарии и Китасато Шибасабуро из Японии, независимо изолировали их в Гонконге бактерия, ответственная за третью пандемию. Хотя оба исследователя сообщили о своих выводах, серия сбивающих с толку и противоречивых заявлений Китасато в конечном итоге привела к тому, что Йерсин был признан главным исследователем организма. Ерсин назвал его Pasteurella pestis в честь Института Пастера, где он работал. В 1967 году его перевели в новый род и в его честь переименовали в Yersinia pestis. Йерсин также отметил, что крысы поражались чумой не только во время эпидемий чумы, но также часто предшествовали таким эпидемиям у людей, и что чума рассматривалась многими местными жителями как болезнь крыс; жители деревень в Китае и Индии утверждали, что, когда было найдено большое количество мертвых крыс, вскоре последовали вспышки чумы.
В 1898 году французский ученый Поль-Луи Симон (который также приехал в Китай, чтобы борьба с Третьей пандемией) обнаружил крысино-блохий вектор, который вызывает болезнь. Он отметил, что заболевшим людям необязательно находиться в тесном контакте друг с другом, чтобы заболеть. В Юньнань, Китай, жители покидали свои дома, как только видели дохлых крыс, а на острове Формоза (Тайвань ) жители считали обращение с мертвыми крысами увеличивало риск развития чумы. Эти наблюдения заставили его подозревать, что блохи могут быть промежуточным фактором в передаче чумы, поскольку люди заражаются чумой только в том случае, если они контактировали с крысами, умершими менее 24 часов назад. В ставшем уже классическим эксперименте Саймонд продемонстрировал, как здоровая крыса умерла от чумы после того, как зараженные блохи прыгнули на нее от крысы, которая недавно умерла от чумы. Вспышка распространилась на Чайнатаун, Сан-Франциско, с 1900 по 1904 год, а затем на Окленд и Восточный залив с 1907 по 1909 год. С тех пор она присутствует у грызунов в западной части Северной Америки, поскольку опасается Последствия вспышки эпидемии для торговли заставили власти прятать мертвых жителей китайского квартала достаточно долго, чтобы болезнь передалась широко распространенным видам местных грызунов в отдаленных районах.
В В 2018 году было опубликовано появление и распространение патогена во время упадка неолита (6000 лет назад). Место в Швеции было источником доказательств ДНК, а торговые сети были предложены как вероятный путь распространения, а не миграции популяций.
Доказательства ДНК, опубликованные в 2015 году, указывают на то, что Y. pestis заразил людей 5000 лет назад в бронзовом веке Евразии, но генетические изменения, которые сделали это вирулентным, произошли только около 4000 лет назад. Высоковирулентная версия, способная передаваться блохами через грызунов, людей и других млекопитающих, была обнаружена у двух особей, связанных с срубной культурой из Самарской области в России примерно 3800 лет назад. и человек железного века из Капана, Армения, примерно 2900 лет назад. Это указывает на то, что по крайней мере две линии Y. pestis циркулировали в эпоху бронзы в Евразии. Бактерия Y. pestis имеет относительно большое количество нефункционирующих генов и три «неуклюжих» плазмиды, что позволяет предположить происхождение менее 20 000 лет назад.
Известны три основных штамма: Y. p. antiqua, вызвавшая пандемию чумы в шестом веке; Ю. П. средневековье, вызвавшее Черную смерть и последующие эпидемии во время второй волны пандемии; и Ю.П. orientalis, ответственный за текущие вспышки чумы.
В 2008 году чума обычно обнаруживалась в странах Африки к югу от Сахары и на Мадагаскаре, в районах, на которые приходилось более 95% зарегистрированных
В сентябре 2009 года смерть Малкольма Касадабана, профессора молекулярной генетики в Университете Чикаго, была связана с его работают над ослабленным лабораторным штаммом Y. pestis. Гемохроматоз был выдвинут как предрасполагающий фактор к смерти Касадабана от этого ослабленного штамма, использованного для исследований.
В 2010 году исследователи из Германии окончательно установили с использованием данных ПЦР из образцов, полученных от жертв Черной смерти, что Y. pestis была причиной средневековой Черной смерти.
. В 2011 году был опубликован первый геном Y. pestis, выделенный от жертв Черной смерти, и был сделан вывод что этот средневековый штамм был предком большинства современных форм Y. pestis.
В 2015 году Cell опубликовал результаты ts из исследования древних захоронений. Плазмиды Y. pestis были обнаружены в археологических образцах зубов семи особей бронзового века в афанасьевской культуре в Сибири, Культура шнуровой керамики в Эстонии, синташтинская культура в России, унетицкая культура в Польше и андроновская культура в Сибири.
8 сентября 2016 г. бактерия Y. pestis была идентифицирована по ДНК в зубах, обнаруженных на строительной площадке Crossrail в Лондоне. Человеческие останки оказались жертвами Великой лондонской чумы, которая длилась с 1665 по 1666 год.
15 января 2018 года исследователи из Университета Осло и Университет Феррары предположили, что люди и их паразиты были самыми крупными переносчиками чумы.
3 ноября 2019 года в больнице в г. Пекинский район Чаоян, что вызывает опасения по поводу вспышки. Врачи диагностировали лихорадку у мужчины средних лет, который жаловался на затрудненное дыхание в течение десяти дней в сопровождении своей жены с аналогичными симптомами. Полиция поместила в карантин отделение неотложной помощи в больнице, а китайские новостные агрегаторы установили контроль. 18-го числа был зарегистрирован третий случай заболевания у 55-летнего мужчины из Лиги Ксилингол, одного из двенадцати Монгольских автономных регионов в Северном Китае. Пациент получил лечение, и 28 человек без симптомов были помещены в карантин.
В июле 2020 года официальные лица усилили меры предосторожности после подтверждения случая бубонной чумы в Баяннур, городе в Внутренней Монголии автономном районе Китая. Пациент был помещен на карантин и пролечен. По данным китайской Global Times, был также рассмотрен второй подозреваемый случай, и было выпущено предупреждение 3 уровня, действующее до конца года. Он запретил охоту и употребление в пищу животных, которые могут быть переносчиками чумы, и призвал общественность сообщать о подозреваемых случаях.
| Викискладе есть средства массовой информации, связанные с Yersinia pestis. |
| Wikispecies содержит информацию, относящуюся к Yersinia pestis |