 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC Адамантан | |
| Систематическое название IUPAC Трицикло [3.3.1.1] декан | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Ссылка Beilstein | 1901173 |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank |
|
| ECHA InfoCard | 100.005.457 |
| Номер EC |
|
| Ссылка Gmelin | 26963 |
| PubChem CID | |
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
| Химическая формула | C10H16 |
| Молярная масса | 136,238 г · моль |
| Внешний вид | Порошок от белого до грязно-белого |
| Плотность | 1,08 г / см (20 ° C), твердое вещество |
| Точка плавления | 270 ° C (518 ° F; 543 K) герметичная трубка |
| Точка кипения | Сублимации |
| Растворимость в воде | Слабо растворим |
| Растворимость в других растворителях | Растворим в углеводородах |
| Показатель преломления (nD) | 1,568 |
| Структура | |
| Кристаллическая структура | кубическая, пространственная группа Fm3m |
| Координационная геометрия | 4 |
| Дипольный момент | 0 D |
| Опасности | |
| Основная опасности | Легковоспламеняющийся |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| Формулировки опасности GHS | H319 , H400 |
| Меры предосторожности GHS | P264 , P273 , P280 , P305 + 351 + 338 , P337 + 313 , P391 , P501 |
| Родственные соединения | |
| Родственные соединения: | Мемантин. Римантадин. Амантадин |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Адамантан представляет собой органическое соединение с формулой C 10H16или, более описательно, (CH) 4 (CH 2)6. Молекулы адамантана можно описать как слияние трех циклогексановых колец. Молекула одновременно жесткая и практически не имеет напряжений. Адамантан является наиболее стабильным изомером C480. Пространственное расположение атомов углерода в молекуле адамантана такое же, как в кристалле алмаза. Это сходство привело к названию адамантан, которое происходит от греческого слова adamantinos (относящегося к стали или алмазу ). Это белое твердое вещество с запахом камфоры. Это простейший алмазоид.
Открытие адамантана в нефти в 1933 году положило начало новой области химии, посвященной синтезу и свойствам полиэдрических органических соединений. Производные адамантана нашли практическое применение в качестве лекарств, полимерных материалов и термостойких смазок.
В 1924 году Х. Декер предположил существование адамантана, который он назвал декатерпеном .
. Первая попытка лабораторного синтеза была предпринята в 1924 году немецким химиком Гансом Меервейном с использованием реакции из формальдегида с диэтилмалонатом в присутствии пиперидина. Вместо адамантана Меервейн получил 1,3,5,7-тетракарбометоксибицикло [3.3.1] нонан-2,6-дион: это соединение, позднее названное сложным эфиром Меервейна, было использовано в синтезе адамантана и его производных. Д. Боттгер пытался получить адамантан, используя в качестве прекурсора эфир Меервейна. Продукт, трицикло- [3.3.1.1], был не адамантаном, а его производным.
Другие исследователи пытались синтезировать адамантан, используя флороглюцин и производные циклогексанона, но также не удалось.
 Эфир Меервейна
Эфир Меервейна Адамантан был впервые синтезирован Владимиром Прелогом в 1941 году из эфира Меервейна. Пятиступенчатый процесс с выходом 0,16% был непрактичным (упрощенный на изображении ниже). Этот метод используется для синтеза определенных производных адамантана.

Метод Прелога был усовершенствован в 1956 году. Выход декарбоксилирования был увеличен путем добавления пути Хайнсдекера (11%) и реакции Хоффмана (24%), которые увеличили общий выход до 6,5%. Процесс все еще был слишком сложным, и в 1957 году Пауль фон Раге Шлейер нашел более удобный метод: дициклопентадиен сначала гидрировали в присутствии катализатора. (например, диоксид платины ), а затем преобразовали в адамантан с использованием кислоты Льюиса (например, хлорида алюминия ) в качестве другого катализатора. Этот метод увеличил выход до 30-40% и обеспечил доступный источник адамантана; поэтому он стимулировал определение адамантана и до сих пор используется в лабораторной практике. Позднее выход синтеза адамантана был увеличен до 60% и 98% с помощью ультразвука и суперкислотных катализаторов. Сегодня адамантан - это доступное химическое соединение, стоимость которого составляет около 1 доллара за грамм.

Все вышеупомянутые методы дают адамантан в виде поликристаллического порошка. Используя этот порошок, монокристаллы можно выращивать из расплава, раствора или паровой фазы (например, с помощью техники Бриджмена – Стокбаргера ). Рост расплава приводит к наихудшему кристаллическому качеству с мозаичным разбросом рентгеновского отражения около 1 °. Лучшие кристаллы получаются из жидкой фазы, но рост практически невозможен - несколько месяцев для кристалла 5–10 мм. Рост из паровой фазы - разумный компромисс с точки зрения скорости и качества. Адамантан сублимируется в кварцевой трубке, помещенной в печь, которая оборудована несколькими нагревателями, поддерживающими определенный температурный градиент (около 10 ° C / см для адамантана) вдоль трубки. Кристаллизация начинается на одном конце трубки, температура которого близка к температуре замерзания адамантана. Медленное охлаждение трубки при поддержании температурного градиента постепенно смещает зону плавления (скорость ~ 2 мм / час) с образованием монокристаллической були.
Адамантан был впервые выделен из нефть чешских химиков С. Ланды, В. Мачачека и М. Мзурека. Они использовали фракционную перегонку нефти. Landa et al. смог произвести только несколько миллиграммов адамантана, но заметил его высокую температуру кипения и точки плавления. Из-за (предполагаемого) сходства его структуры со структурой алмаза новое соединение было названо адамантаном.
Нефть остается источником адамантана; содержание варьируется от 0,0001% до 0,03% в зависимости от нефтяного месторождения и является слишком низким для коммерческой добычи.
Нефть содержит более тридцати производных адамантана. Их выделение из сложной смеси углеводородов возможно благодаря их высокой температуре плавления и способности перегоняться с водяным паром и образовывать стабильные аддукты с тиомочевиной.
Чистый адамантан представляет собой бесцветное кристаллическое твердое вещество с характерным запахом камфоры. Практически не растворяется в воде, но хорошо растворяется в неполярных органических растворителях. Адамантан имеет необычно высокую температуру плавления для углеводорода. При 270 ° C его температура плавления намного выше, чем у других углеводородов с той же молекулярной массой, таких как камфен (45 ° C), лимонен (-74 ° C), оцимен (50 ° C), терпинен (60 ° C) или твистан (164 ° C), или чем линейный углеводород C 10H22декан (-28 ° C). Однако адамантан медленно сублимирует даже при комнатной температуре. Адамантан может быть дистиллирован с водяным паром.
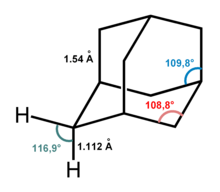
Как было установлено с помощью дифракции электронов и рентгеновской кристаллографии, молекула имеет T d симметрия. Длина углерод-углеродной связи составляет 1,54 Å, что почти идентично длине алмаза. Расстояние между углеродом и водородом составляет 1,112 Å.
В условиях окружающей среды адамантан кристаллизуется в гранецентрированной кубической структуре (пространственная группа Fm3m, a = 9,426 ± 0,008 Å, четыре молекулы в элементарной ячейке), содержащие ориентационно неупорядоченные молекулы адамантана. Эта структура превращается в упорядоченную примитивную тетрагональную фазу (a = 6,641 Å, c = 8,875 Å ) с двумя молекулами на ячейку либо при охлаждении до 208 К или повышение давления выше 0,5 ГПа.
Этот фазовый переход имеет первый род; сопровождается аномалией теплоемкости,, упругих и других свойств. В частности, если в кубической фазе молекулы адамантана свободно вращаются, в тетрагональной они заморожены; плотность увеличивается ступенчато с 1,08 до 1,18 г / см, а энтропия изменяется на значительную величину, составляющую 1594 Дж / (моль · К).
Константы упругости адамантана были измерены с использованием крупных (сантиметровых) монокристаллов и ультразвукового эхо-метода. Главное значение тензора упругости , C 11, было выведено как 7,52, 8,20 и 6,17 ГПа для кристаллических направлений , и . Для сравнения, соответствующие значения для кристаллического алмаза составляют 1161, 1174 и 1123 ГПа. Расположение атомов углерода одинаково в адамантане и алмазе. Однако в твердом адамантане молекулы не образуют ковалентную решетку, как в алмазе, а взаимодействуют посредством слабых ван-дер-ваальсовых сил. В результате кристаллы адамантана становятся очень мягкими и пластичными.
Спектр ядерного магнитного резонанса (ЯМР) адамантана состоит из двух плохо разрешенных сигналов, которые соответствуют на сайты 1 и 2 (см. рисунок ниже). Химические сдвиги ЯМР 1Н и 13С составляют соответственно 1,873 и 1,756 м.д. и составляют 28,46 и 37,85 м.д. Простота этих спектров согласуется с высокой симметрией молекул.
Масс-спектры адамантана и его производных весьма характерны. Основной пик при m / z = 136 соответствует иону C. 10H. 16. Его фрагментация приводит к более слабым сигналам, так как m / z = 93, 80, 79, 67, 41 и 39.
инфракрасный спектр поглощения адамантана относительно прост из-за высокой симметрии молекула. Основные полосы поглощения и их распределение приведены в таблице:
| Частота колебаний, см | Отнесение |
|---|---|
| 444 | δ (CCC) |
| 638 | δ (CCC) |
| 798 | ν (C − C) |
| 970 | ρ (CH 2), ν (C − C), δ (HCC) |
| 1103 | δ (HCC) |
| 1312 | ν (C − C), ω (CH 2) |
| 1356 | δ (HCC), ω (CH 2) |
| 1458 | δ (HCH) |
| 2850 | ν (C-H) в группах CH 2 |
| 2910 | ν (C − H) в группах CH 2 |
| 2930 | ν (C − H) в группах CH 2 |
Условные обозначения соответствуют типам колебаний: δ - деформация, ν - растяжение, ρ и ω - внеплоскостные деформационные колебания групп CH 2.
Производные адамантана с разными заместителями у каждого узлового атома углерода являются хиральными. Такая оптическая активность была описана для адамантана в 1969 году с четырьмя различными заместителями: водород, бром и метил и карбоксильная группа. Значения удельное вращение невелики и обычно находятся в пределах 1 °.
Используя правила систематической номенклатуры, адамантан называют трицикло [3.3.1.1] деканом. Однако IUPAC рекомендует использовать название «адамантан».

Молекула адамантана состоит только из углерода и водорода и имеет симметрию T d. Следовательно, его 16 атомов водорода и 10 атомов углерода могут быть описаны только двумя сайтами, которые обозначены на рисунке как 1 (4 эквивалентных сайта) и 2 (6 эквивалентных сайтов).
Структурными родственниками адамантана являются и, которые, соответственно, содержат на одну связь меньше и на одну больше CH 2, чем адамантан.
Катион адамантана можно получить обработкой 1-фторадамантана SbF 5. Его стабильность относительно высока.
Дикатион 1,3-дидегидроадамантана получали в растворах суперкислот. Он также обладает повышенной стабильностью из-за явления, называемого «трехмерной ароматичностью» или гомоароматичностью. Эта четырехцентровая двухэлектронная связь включает одну пару электронов, делокализованных между четырьмя атомами-мостами.

Большинство реакций адамантана протекает через 3-скоординированные углеродные центры. Они участвуют в реакции адамантана с концентрированной серной кислотой, которая дает адамантанон.

. Карбонильная группа адамантанона позволяет проводить дальнейшие реакции через мостиковый участок. Например, адамантанон является исходным соединением для получения таких производных адамантана, как 2-адамантанкарбонитрил и 2-метиладамантан.
Адамантан легко реагирует с различными бромирующими агентами, включая молекулярные бром. Состав и соотношение продуктов реакции зависят от условий реакции и особенно от наличия и типа катализаторов.

Кипячение адамантана с бромом приводит к монозамещенному адамантану, 1-бромадамантану. Множественное замещение бромом достигается добавлением катализатора кислота Льюиса.
Скорость бромирования увеличивается при добавлении кислот Льюиса и не изменяется при облучении или добавлении свободных радикалов. Это указывает на то, что реакция протекает по ионному механизму.
Первые фторирования адамантана проводили с использованием 1-гидроксиадамантана и 1-аминоадамантана в качестве исходных соединений. Позже фторирование стали осуществлять, начиная с самого адамантана. Во всех этих случаях реакция протекает через образование катиона адамантана, который затем взаимодействует с фторированными нуклеофилами. Сообщалось также о фторировании адамантана газообразным фтором.
Карбоксилирование адамантана впервые было описано в 1960 году с использованием муравьиной кислоты в качестве карбоксилирующий агент и четыреххлористый углерод в качестве растворителя.
<110>
трет-бутанол (t-BuOH) и серную кислоту добавляли для образования катиона адамантана; затем катион карбоксилировали монооксидом углерода, образующимся in situ при взаимодействии между муравьиной и серной кислотами. Доля карбоксилированного адамантана составляла 55-60%.
1-Гидроксиадамантан легко образуется при гидролизе 1-бромадамантана в водном растворе ацетона. Его также можно получить озонированием адамантана: Окисление спирта дает адамантанон.

Адамантан взаимодействует с бензолом в присутствии Кислоты Льюиса, приводящие к реакции Фриделя – Крафтса. Арилзамещенные производные адамантана можно легко получить, исходя из 1-гидроксиадамантана. В частности, реакция с анизолом протекает в нормальных условиях и не требует катализатора.
Нитрование адамантана - сложная реакция, характеризующаяся умеренными выходами. Азотзамещенное лекарственное средство амантадин может быть получено взаимодействием адамантана с бромом или азотной кислотой с образованием бромида или сложного нитроэфира в 1-положении. Взаимодействие любого соединения с ацетонитрилом дает ацетамид, который гидролизуется с образованием 1-адамантиламина:

Адамантан сам по себе находит мало применений, поскольку он является просто нефункционализированным углеводородом. Он используется в некоторых масках для сухого травления и полимерных составах.
В твердотельной ЯМР спектроскопии адамантан является общепринятым стандартом для привязки химического сдвига.
В лазерах на красителях, адамантан можно использовать для продления срока службы усиливающей среды; он не может быть фотоионизирован в атмосфере, потому что его полосы поглощения лежат в вакуумно-ультрафиолетовой области спектра. Энергия фотоионизации была определена для адамантана, а также для нескольких более крупных алмазоидов.
Все известные до сих пор медицинские применения включают не чистый адамантан, а его производные. Первым производным адамантана, использованным в качестве лекарственного средства, был амантадин - сначала (1967) в качестве противовирусного препарата против различных штаммов гриппа, а затем для лечения болезни Паркинсона. болезнь. Другие препараты среди производных адамантана включают адапален, адапромин, бромантан, мемантин, римантадин, саксаглиптин., тромантадин и вилдаглиптин. Полимеры адамантана были запатентованы как противовирусные средства против ВИЧ..
Штаммы вируса гриппа развивали лекарственную устойчивость к амантадину и римантадину, которые не эффективны против распространенных штаммов на момент 2016.
Адамантан недавно был идентифицирован как ключевая структурная субъединица в нескольких синтетических каннабиноиде дизайнерских наркотиках, а именно AB-001 и SDB-001.
Некоторые алкильные производные адамантана использовались в качестве рабочей жидкости в гидравлических системах. Полимеры на основе адамантана могут найти применение для покрытий сенсорных экранов, и есть перспективы использования адамантана и его гомологов в нанотехнологии. Например, мягкая каркасная структура твердого адамантана позволяет включать гостевые молекулы, которые могут высвобождаться внутри человеческого тела при разрушении матрицы. Адамантан можно использовать в качестве молекулярных строительных блоков для самосборки молекулярных кристаллов.
Многие молекулы и ионы имеют каркасные структуры, подобные адамантану. К ним относятся триоксид фосфора P4O6, триоксид мышьяка As4O6, пятиокись фосфора P4O10= (PO) 4O6, пентасульфид фосфора P4S10= (PS) 4S6и гексаметилентетрамин C6N4H12= N 4 (CH 2)6. Особенно известен тетраметилендисульфотетрамин, часто сокращаемый до «тетрамин», родентицид, запрещенный в большинстве стран из-за чрезвычайной токсичности для человека. кремниевый аналог адамантана, сила-адамантан, был синтезирован в 2005 году. Арсеницин A представляет собой встречающийся в природе органо-мышьяк аналог, выделенный из новокаледонской морской губки и представляет собой первое известное органическое соединение на основе полиомышьяка.

Адамантан






Соединение арсеницина
высшие алмазоиды, такие как диамантан (C14H20- две конденсированные адамантановые клетки), триамантан (C 18H24), тетрамантан (C 22H28), пентаман тан (C 474), гексамантан (C 472) и т.д. Их синтез аналогичен синтезу адамантана и, как и адамантан, их также можно экстрагировать из нефти, хотя и с гораздо меньшими выходами.