 Дифференцировка стволовых клеток в различные типы тканей.
Дифференцировка стволовых клеток в различные типы тканей.  Распределение количества клеток, показывающее клеточную дифференцировку для трех типов клеток (предшественник
Распределение количества клеток, показывающее клеточную дифференцировку для трех типов клеток (предшественник  , остеобласт
, остеобласт  и хондроцит
и хондроцит  ) обнажены на стимул проостеобластов.
) обнажены на стимул проостеобластов. Клеточная дифференцировка - это процесс, в котором клетка изменяется с одного типа клеток на другой. Обычно клетка меняется на более специализированный тип. Дифференциация происходит много раз во время развития многоклеточного организма, поскольку он превращается из простой зиготы в сложную систему тканей и типов клеток. Дифференциация продолжается и в зрелом возрасте, поскольку взрослые стволовые клетки делятся и создают полностью дифференцированные дочерние клетки во время восстановления тканей и во время нормального клеточного обмена. Некоторая дифференциация происходит в ответ на воздействие антигена. Дифференциация резко меняет размер, форму клетки, мембранный потенциал, метаболическую активность и реакцию на сигналы. Эти изменения в значительной степени обусловлены строго контролируемыми модификациями в экспрессии генов и являются предметом исследования эпигенетики. За некоторыми исключениями, клеточная дифференцировка почти никогда не включает изменение самой последовательности ДНК. Таким образом, разные клетки могут иметь очень разные физические характеристики, несмотря на одинаковый геном.
. Специализированный тип дифференцировки, известный как «терминальная дифференцировка», важен для некоторых тканей, например нервной системы позвоночных, поперечно-полосатой мышцы, эпидермис и кишечник. Во время терминальной дифференцировки клетка-предшественница, ранее способная к клеточному делению, навсегда покидает клеточный цикл, разрушает аппарат клеточного цикла и часто экспрессирует ряд генов, характерных для конечной функции клетки (например, миозин и актин для мышечной клетки). Дифференциация может продолжаться и после терминальной дифференцировки, если емкость и функции клетки претерпевают дальнейшие изменения.
Среди делящихся клеток существует несколько уровней активности клеток, способности клетки дифференцироваться в другие типы клеток. Более высокая эффективность указывает на большее количество типов клеток, которые могут быть получены. Клетка, которая может дифференцироваться во все типы клеток, включая ткань плаценты, известна как тотипотент. У млекопитающих только зигота и последующие бластомеры являются тотипотентными, тогда как у растений многие дифференцированные клетки могут стать тотипотентными с помощью простых лабораторных методов. Клетка, которая может дифференцироваться во все типы клеток взрослого организма, известна как плюрипотентная. Такие клетки называются меристематическими клетками у высших растений и эмбриональными стволовыми клетками у животных, хотя некоторые группы сообщают о наличии взрослых плюрипотентных клеток. Вирусно-индуцированная экспрессия четырех факторов транскрипции Oct4, Sox2, c-Myc и Klf4 (факторы Яманака ) достаточно для создания плюрипотентных (iPS) клеток из взрослых фибробластов. мультипотентная клетка - это клетка, которая может дифференцироваться на несколько различных, но тесно связанных типов клеток. Олигопотентные клетки более ограничены, чем мультипотентные, но все же могут дифференцироваться в несколько тесно связанных типов клеток. Наконец, унипотентные клетки могут дифференцироваться только в один тип клеток, но способны к самообновлению. В цитопатологии уровень клеточной дифференциации используется в качестве меры прогрессирования рака. «Степень » - это маркер того, насколько дифференцирована клетка в опухоли.
Тело млекопитающего состоит из трех основных категорий клеток: половых клеток, соматические клетки и стволовые клетки. Каждая из примерно 37,2 триллиона (3,72x10) клеток взрослого человека имеет свою собственную копию или копии генома, за исключением определенных типов клеток, таких как эритроциты, в которых отсутствуют ядра. в их полностью дифференцированном состоянии. Большинство клеток диплоидно ; у них есть две копии каждой хромосомы. Такие клетки, называемые соматическими клетками, составляют большую часть человеческого тела, например клетки кожи и мышц. Клетки дифференцируются, чтобы специализироваться на различных функциях.
Клетки зародышевой линии - это любая линия клеток, дающая начало гаметам - яйцам и сперматозоидам - и, таким образом, непрерывна на протяжении поколений. Стволовые клетки, с другой стороны, обладают способностью делиться на неопределенное время и давать начало специализированным клеткам. Их лучше всего описать в контексте нормального развития человека.
Развитие начинается, когда сперматозоид оплодотворяет яйцеклетку и создает единственную клетку, которая имеет потенциал для образования весь организм. В первые часы после оплодотворения эта клетка делится на идентичные клетки. У человека примерно через четыре дня после оплодотворения и после нескольких циклов клеточного деления эти клетки начинают специализироваться, образуя полую клеточную сферу, называемую бластоцистой. Бластоциста имеет внешний слой клеток, а внутри этой полой сферы находится кластер клеток, называемый внутренней клеточной массой. Клетки внутренней клеточной массы продолжают формировать практически все ткани человеческого тела. Хотя клетки внутренней клеточной массы могут образовывать практически все типы клеток человеческого тела, они не могут образовывать организм. Эти клетки называются плюрипотентными.
плюрипотентными стволовыми клетками, которые подвергаются дальнейшей специализации в мультипотентные клетки-предшественники, которые затем дают начало функциональным клеткам. Примеры стволовых клеток и клеток-предшественников включают:
Путь, который управляется молекулами клеточной адгезии, состоящими из четырех аминокислоты, аргинин, глицин, аспарагин и серин, образуются, когда клеточный бластомер отличает от однослойный бл astula к трем первичным слоям зародышевых клеток у млекопитающих, а именно к эктодерме, мезодерме и энтодерме (перечислены из большинства от дистального (внешнего) до проксимального (внутреннего)). Эктодерма образует кожу и нервную систему, мезодерма образует кости и мышечную ткань, а энтодерма образует ткани внутренних органов.
 Микрофотография липосаркомы с некоторой дедифференцировкой, не идентифицируемой как липосаркома (левый край изображения) и дифференцированным компонентом (с липобласты и повышенная васкуляризация (справа от изображения)). Полностью дифференцированная (морфологически доброкачественная) жировая ткань (центр изображения) имеет мало кровеносных сосудов. Окраска HE.
Микрофотография липосаркомы с некоторой дедифференцировкой, не идентифицируемой как липосаркома (левый край изображения) и дифференцированным компонентом (с липобласты и повышенная васкуляризация (справа от изображения)). Полностью дифференцированная (морфологически доброкачественная) жировая ткань (центр изображения) имеет мало кровеносных сосудов. Окраска HE.Дедифференцировка или интеграция - это клеточный процесс, часто наблюдаемый у более базальных форм жизни, таких как черви и земноводных, у которых частично или окончательно дифференцированная клетка возвращается на более раннюю стадию развития, обычно как часть регенеративного процесса. Дедифференцировка происходит и у растений. Клетки в культуре клеток могут потерять свойства, которыми они изначально обладали, такие как экспрессия белка, или изменить форму. Этот процесс также называется дедифференцировкой.
Некоторые полагают, что дедифференцировка - это нарушение нормального цикла развития, которое приводит к раку, тогда как другие считают, что это естественная часть иммунного ответа, утраченного из-за люди в какой-то момент в результате эволюции.
Обнаружена небольшая молекула, названная реверсином, аналог пурина, которая, как было доказано, вызывает дедифференцировку в мышечных трубках. Эти дедифференцированные клетки могут затем повторно дифференцироваться в остеобласты и адипоциты.
 Диаграмма, демонстрирующая несколько методов, используемых для превращения взрослых соматических клеток в тотипотентность или плюрипотентность.
Диаграмма, демонстрирующая несколько методов, используемых для превращения взрослых соматических клеток в тотипотентность или плюрипотентность.  Механизмы клеточной дифференцировки. 315>Каждый специализированный тип клеток в организме экспрессирует подмножество всех генов, составляющих геном этого вида. Каждый тип клеток определяется его конкретным паттерном регулируемой экспрессии гена. Таким образом, дифференцировка клеток - это переход клетки от одного типа клеток к другому и включает переключение с одного паттерна экспрессии гена на другой. Клеточную дифференциацию во время развития можно понять как результат регуляторной сети генов. Регуляторный ген и его цис-регуляторные модули являются узлами в регуляторной сети генов; они получают ввод и создают вывод в другом месте сети. Подход системной биологии к биологии развития подчеркивает важность изучения того, как механизмы развития взаимодействуют для создания предсказуемых паттернов (морфогенез ). Однако недавно была предложена альтернативная точка зрения. На основе стохастической экспрессии гена клеточная дифференцировка является результатом дарвиновского селективного процесса, происходящего среди клеток. В этом контексте белковые и генные сети являются результатом клеточных процессов, а не их причиной.
Механизмы клеточной дифференцировки. 315>Каждый специализированный тип клеток в организме экспрессирует подмножество всех генов, составляющих геном этого вида. Каждый тип клеток определяется его конкретным паттерном регулируемой экспрессии гена. Таким образом, дифференцировка клеток - это переход клетки от одного типа клеток к другому и включает переключение с одного паттерна экспрессии гена на другой. Клеточную дифференциацию во время развития можно понять как результат регуляторной сети генов. Регуляторный ген и его цис-регуляторные модули являются узлами в регуляторной сети генов; они получают ввод и создают вывод в другом месте сети. Подход системной биологии к биологии развития подчеркивает важность изучения того, как механизмы развития взаимодействуют для создания предсказуемых паттернов (морфогенез ). Однако недавно была предложена альтернативная точка зрения. На основе стохастической экспрессии гена клеточная дифференцировка является результатом дарвиновского селективного процесса, происходящего среди клеток. В этом контексте белковые и генные сети являются результатом клеточных процессов, а не их причиной.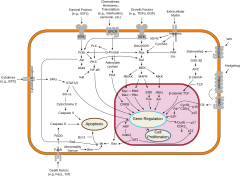 Обзор основных путей передачи сигнала.
Обзор основных путей передачи сигнала. Хотя эволюционно консервативные молекулярные процессы участвуют в клеточных механизмах лежащие в основе этих переключателей, у животных видов они сильно отличаются от хорошо охарактеризованных механизмов регуляции генов бактерий и даже от механизмов ближайших одноклеточные родственники. В частности, дифференцировка клеток у животных сильно зависит от биомолекулярных конденсатов регуляторных белков и энхансерных последовательностей ДНК.
Клеточная дифференцировка часто контролируется передачей сигналов клеток. Многие из сигнальных молекул, которые передают информацию от клетки к клетке во время контроля клеточной дифференцировки, называются факторами роста. Хотя детали конкретных путей передачи сигнала различаются, эти пути часто имеют следующие общие этапы. Лиганд, продуцируемый одной клеткой, связывается с рецептором во внеклеточной области другой клетки, вызывая конформационное изменение рецептора. Форма цитоплазматического домена рецептора изменяется, и рецептор приобретает ферментативную активность. Затем рецептор катализирует реакции, которые фосфорилируют другие белки, активируя их. Каскад реакций фосфорилирования в конечном итоге активирует спящий фактор транскрипции или цитоскелетный белок, тем самым внося свой вклад в процесс дифференцировки в клетке-мишени. Клетки и ткани могут различаться по своей компетенции, их способности реагировать на внешние сигналы.
Индукция сигнала относится к каскадам передачи сигналов событий, во время которых клетка или ткань сигнализируют другой клетке или ткани о необходимости повлиять на его судьбу развития. Ямамото и Джеффри исследовали роль хрусталика в формировании глаз у пещерных и поверхностных рыб, что явилось ярким примером индукции. Посредством взаимных трансплантаций Ямамото и Джеффри обнаружили, что везикула хрусталика поверхностных рыб может стимулировать развитие других частей глаза у пещерных и поверхностных рыб, в то время как везикула хрусталика пещерных рыб - нет.
Другие важные механизмы подпадают под категорию асимметричных клеточных делений, делений, дающих начало дочерним клеткам с разными судьбами развития. Асимметричные деления клеток могут происходить из-за асимметрично экспрессируемых материнских цитоплазматических детерминант или из-за передачи сигналов. В первом механизме отдельные дочерние клетки создаются во время цитокинеза из-за неравномерного распределения регуляторных молекул в родительской клетке; отличная цитоплазма, которую наследует каждая дочерняя клетка, приводит к определенному паттерну дифференцировки для каждой дочерней клетки. Хорошо изученным примером формирования рисунка посредством асимметричных делений является формирование рисунка оси тела у Drosophila. РНК молекулы являются важным типом сигнала контроля внутриклеточной дифференцировки. Молекулярные и генетические основы асимметричного деления клеток также изучались на зеленых водорослях рода Volvox, модельной системе для изучения того, как одноклеточные организмы могут эволюционировать в многоклеточные. У Volvox carteri 16 клеток в переднем полушарии 32-клеточного эмбриона делятся асимметрично, каждая из которых производит одну большую и одну маленькую дочерние клетки. Размер клетки в конце всех клеточных делений определяет, станет ли она специализированной зародышевой или соматической клеткой.
Поскольку каждая клетка, независимо от типа клетки, обладает одинаковым геном, определение типа клетки должно происходить на уровне экспрессии гена. Хотя регуляция экспрессии гена может происходить с помощью цис- и трансрегуляторных элементов, включая промотор и энхансеры, возникает проблема относительно того, как этот паттерн экспрессии поддерживается на протяжении многих поколений клеточного деления. Оказывается, эпигенетические процессы играют решающую роль в регуляции решения принять судьбу стволовых, предшественников или зрелых клеток. В этом разделе основное внимание будет уделено стволовым клеткам млекопитающих .
. В системной биологии и математическом моделировании сетей регуляции генов предполагается, что определение судьбы клеток будет демонстрировать определенную динамику, такую как конвергенция аттрактора ( аттрактор может быть точкой равновесия, предельным циклом или странным аттрактором ) или колебательным.
Первый вопрос, который можно задать, - это степень и сложность роли эпигенетических процессов в детерминации клеточной судьбы. Четкий ответ на этот вопрос можно увидеть в статье 2011 года Lister R et al. об аберрантном эпигеномном программировании в человеческих индуцированных плюрипотентных стволовых клетках. Поскольку считается, что индуцированные плюрипотентные стволовые клетки (ИПСК) имитируют эмбриональные стволовые клетки по своим плюрипотентным свойствам, между ними должно существовать несколько эпигенетических различий. Чтобы проверить это предсказание, авторы провели полногеномное профилирование паттернов метилирования ДНК в нескольких человеческих эмбриональных стволовых клетках (ESC), iPSC и линиях клеток-предшественников.
Женские жировые клетки, фибробласты легких и фибробласты крайней плоти были перепрограммированы в индуцированное плюрипотентное состояние с помощью OCT4, Гены SOX2, KLF4 и MYC. Сравнивались паттерны метилирования ДНК в ЭСК, ИПСК, соматических клетках. Lister R, et al. наблюдали значительное сходство в уровнях метилирования между эмбриональными и индуцированными плюрипотентными клетками. Около 80% динуклеотидов CG в ESC и iPSC были метилированы, то же самое верно только для 60% динуклеотидов CG в соматических клетках. Кроме того, соматические клетки обладали минимальными уровнями метилирования цитозина в динуклеотидах, не относящихся к CG, в то время как индуцированные плюрипотентные клетки обладали такими же уровнями метилирования, как и эмбриональные стволовые клетки, от 0,5 до 1,5%. Таким образом, в соответствии с их соответствующей транскрипционной активностью, паттерны метилирования ДНК, по крайней мере на геномном уровне, сходны между ESC и iPSC.
Однако при более тщательном изучении паттернов метилирования авторы обнаружили 1175 областей дифференциального метилирования динуклеотидов CG между по крайней мере одной линией клеток ES или iPS. Сравнивая эти области дифференциального метилирования с областями метилирования цитозина в исходных соматических клетках, 44-49% дифференциально метилированных областей отражали паттерны метилирования соответствующих соматических клеток-предшественников, в то время как 51-56% этих областей отличались от обоих предшественников. и линии эмбриональных клеток. In vitro -индуцированная дифференцировка линий ИПСК привела к передаче 88% и 46% гипер- и гипометилированных дифференциально метилированных областей, соответственно.
Из этого исследования легко сделать два вывода. Во-первых, эпигенетические процессы в значительной степени вовлечены в определение клеточной судьбы, как видно из сходных уровней метилирования цитозина между индуцированными плюрипотентными и эмбриональными стволовыми клетками, что согласуется с их соответствующими паттернами транскрипции. Во-вторых, механизмы де-дифференцировки (и, как следствие, дифференцировки) очень сложны и не могут быть легко дублированы, что видно по значительному количеству дифференциально метилированных областей между линиями ES и iPS клеток. Теперь, когда эти два момента установлены, мы можем изучить некоторые эпигенетические механизмы, которые, как считается, регулируют клеточную дифференцировку.
Три фактора транскрипции, OCT4, SOX2 и NANOG - первые два из которых используются в репрограммировании индуцированных плюрипотентных стволовых клеток (ИПСК), наряду с Klf4 и c-Myc - высоко экспрессируются в недифференцированных эмбриональных стволовых клетках и необходимы для поддержание их плюрипотентности. Считается, что они достигают этого за счет изменений в структуре хроматина, таких как модификация гистона и метилирование ДНК, чтобы ограничить или разрешить транскрипцию генов-мишеней. Несмотря на высокую экспрессию, их уровни требуют точного баланса для поддержания плюрипотентности, нарушение которого будет способствовать дифференцировке в разные клоны в зависимости от того, как меняются уровни экспрессии генов. Было показано, что дифференциальная регуляция уровней Oct-4 и SOX2 предшествует отбору судьбы зародышевого листка. Повышенные уровни Oct4 и пониженные уровни Sox2 способствуют мезэндодермальной судьбе , при этом Oct4 активно подавляет гены, связанные с нейронной эктодермальной судьбой. Сходным образом, повышенные уровни Sox2 и пониженные уровни Oct4 способствуют дифференцировке в направлении нейральной эктодермальной судьбы, при этом Sox2 ингибирует дифференцировку в сторону мезэндодермальной судьбы. Независимо от линии дифференцировки клеток, подавление NANOG было идентифицировано как необходимое предварительное условие для дифференцировки.
В области подавление гена, Репрессивный комплекс Polycomb 2, один из двух классов белков семейства Polycomb group (PcG), катализирует ди- и три-метилирование гистона H3 лизин 27 (H3K27me2 / me3). Связываясь с нуклеосомой, меченной H3K27me2 / 3, PRC1 (также комплекс белков семейства PcG) катализирует моноубиквитинилирование гистона H2A по лизину 119 (H2AK119Ub1), блокируя активность РНК-полимеразы II и приводя к подавление транскрипции. Нокаутные по PcG ES-клетки не дифференцируются эффективно в три зародышевых листка, а делеция генов PRC1 и PRC2 приводит к повышенной экспрессии генов, связанных с клонами, и незапланированной дифференцировке. Предположительно, комплексы PcG ответственны за репрессию транскрипции, дифференцировку и гены, способствующие развитию.
Альтернативно, после получения сигналов дифференцировки, белки PcG рекрутируются на промоторы факторов транскрипции плюрипотентности. PcG-дефицитные ES-клетки могут начать дифференцировку, но не могут поддерживать дифференцированный фенотип. Одновременно гены, способствующие дифференцировке и развитию, активируются регуляторами хроматина группы Trithorax (TrxG) и теряют репрессию. Белки TrxG рекрутируются в областях с высокой транскрипционной активностью, где они катализируют триметилирование гистона H3 лизина 4 (H3K4me3 ) и способствуют активации гена посредством ацетилирования гистонов. Комплексы PcG и TrxG участвуют в прямой конкуренции и считаются функционально антагонистическими, создавая при дифференцировке и развитии локусы, которые называют «двухвалентным доменом», и делая эти гены чувствительными к быстрой индукции или репрессии.
Регуляция экспрессии генов дополнительно достигается за счет метилирования ДНК, при котором метилирование остатков цитозина в динуклеотидах CpG, опосредованное ДНК-метилтрансферазой, поддерживает наследственную репрессию, контролируя доступность ДНК. Большинство сайтов CpG в эмбриональных стволовых клетках неметилированы и, по-видимому, связаны с нуклеосомами, несущими H3K4me3. При дифференцировке небольшое количество генов, включая OCT4 и NANOG, метилируются, а их промоторы репрессируются, чтобы предотвратить их дальнейшую экспрессию. Соответственно, эмбриональные стволовые клетки с дефицитом метилирования ДНК быстро вступают в апоптоз при дифференцировке in vitro.
В то время как последовательность ДНК большинства клеток одного и того же организма, паттерны связывания факторов транскрипции и соответствующие паттерны экспрессии генов различны. В значительной степени различия в связывании факторов транскрипции определяются доступностью хроматина их сайтов связывания посредством модификации гистона и / или пионерных факторов. В частности, важно знать, покрывает ли нуклеосома данный сайт связывания генома или нет. Это может быть определено с помощью анализа иммунопреципитации хроматина (ChIP).
ДНК-нуклеосомные взаимодействия характеризуются двумя состояниями: либо прочно связанное нуклеосомами и транскрипционно неактивный, называемый гетерохроматином, или слабо связанный и обычно, но не всегда транскрипционно активный, называемый эухроматином. Эти изменения в первую очередь объясняются эпигенетическими процессами метилирования и ацетилирования гистонов, а также их обратными деметилированием и деацетилированием. Эффекты ацетилирования и деацетилирования более предсказуемы. Ацетильная группа либо добавляется, либо удаляется из положительно заряженных остатков лизина в гистонах ферментами, называемыми гистонацетилтрансферазами или, соответственно. Ацетильная группа предотвращает ассоциацию лизина с отрицательно заряженным остовом ДНК. Метилирование не так просто, поскольку ни метилирование, ни деметилирование не коррелируют с активацией или репрессией гена. Однако неоднократно было показано, что определенные метилирования либо активируют, либо репрессируют гены. Триметилирование лизина 4 на гистоне 3 (H3K4Me3) связано с активацией гена, тогда как триметилирование лизина 27 на гистоне 3 подавляет гены
Во время дифференцировки стволовых клеток изменяют свои профили экспрессии генов. Недавние исследования выявили роль позиционирования нуклеосом и модификаций гистонов во время этого процесса. Есть два компонента этого процесса: выключение экспрессии генов эмбриональных стволовых клеток (ESC) и активация генов клеточных судеб. Полагают, что лизинспецифическая деметилаза 1 (KDM1A ) предотвращает использование энхансерных областей генов плюрипотентности, тем самым ингибируя их транскрипцию. Он взаимодействует с комплексом Mi-2 / NuRD комплекс (ремоделирование нуклеосом и гистондеацетилаза), давая пример, когда метилирование и ацетилирование не являются дискретными и взаимоисключающими, а взаимосвязанными процессами.
Последний вопрос, который следует задать, касается роли передачи сигналов клеток во влиянии на эпигенетические процессы, управляющие дифференцировкой. Такая роль должна существовать, поскольку было бы разумно думать, что внешняя передача сигналов может приводить к эпигенетическому ремоделированию, точно так же, как она может приводить к изменениям в экспрессии генов посредством активации или репрессии различных факторов транскрипции. Имеется мало прямых данных о конкретных сигналах, которые влияют на эпигеном, и большая часть текущих знаний об этом предмете состоит из предположений о вероятных кандидатах в регуляторы эпигенетического ремоделирования. Сначала мы обсудим несколько основных кандидатов, которые, как считается, участвуют в индукции и поддержании как эмбриональных стволовых клеток, так и их дифференцированного потомства, а затем обратимся к одному из примеров конкретных сигнальных путей, в которых существуют более прямые доказательства их роли в эпигенетических изменениях.
Первым основным кандидатом является сигнальный путь Wnt. Путь Wnt участвует во всех стадиях дифференцировки, и лиганд Wnt3a может замещать сверхэкспрессию c-Myc в генерации индуцированных плюрипотентных стволовых клеток. С другой стороны, нарушение ß-катенина, компонента пути передачи сигналов Wnt, приводит к снижению пролиферации нейральных предшественников.
Факторы роста составляют второй основной набор кандидатов в эпигенетические регуляторы клеточной дифференцировки. Эти морфогены имеют решающее значение для развития и включают морфогенетические белки кости, трансформирующие факторы роста (TGFs) и факторы роста фибробластов (FGFs). Было показано, что TGF и FGF поддерживают экспрессию OCT4, SOX2 и NANOG посредством передачи сигналов ниже по течению к белкам Smad. Истощение факторов роста способствует дифференцировке ESC, в то время как гены с двухвалентным хроматином могут стать более ограничивающими или разрешающими в своей транскрипции.
Некоторые другие сигнальные пути также считаются первичными кандидатами. Цитокин Факторы ингибирования лейкемии связаны с поддержанием ЭСК мыши в недифференцированном состоянии. Это достигается за счет активации пути Jak-STAT3, который, как было показано, необходим и достаточен для поддержания плюрипотентности мышиных ESC. Ретиноевая кислота может вызывать дифференцировку ESC человека и мыши, а Notch передача сигналов участвует в пролиферации и самообновлении стволовых клеток. Наконец, Sonic hedgehog, помимо своей роли морфогена, способствует дифференцировке эмбриональных стволовых клеток и самообновлению соматических стволовых клеток.
Проблема, конечно же, в том, что кандидатура этих сигнальных путей была сделана в первую очередь на основании их роли в развитии и дифференцировке клеток. Хотя эпигенетическая регуляция необходима для управления клеточной дифференцировкой, их явно недостаточно для этого процесса. Прямая модуляция экспрессии генов посредством модификации факторов транскрипции играет ключевую роль, которую следует отличать от наследственных эпигенетических изменений, которые могут сохраняться даже в отсутствие исходных сигналов окружающей среды. В настоящее время существует лишь несколько примеров сигнальных путей, ведущих к эпигенетическим изменениям, которые изменяют судьбу клеток, и мы сосредоточимся на одном из них.
Экспрессия Shh (Sonic hedgehog) активирует выработку BMI1, компонента комплекса PcG, который распознает H3K27me3. Это происходит Gli-зависимым образом, поскольку Gli1 и Gli2 являются эффекторами нижестоящего пути передачи сигнала Hedgehog. В культуре Bmi1 опосредует способность пути Hedgehog способствовать самообновлению стволовых клеток молочной железы человека. Как у людей, так и у мышей, исследователи показали, что Bmi1 сильно экспрессируется в пролиферирующих незрелых предшественниках гранулярных клеток мозжечка. Когда Bmi1 был нокаутирован у мышей, это привело к нарушению развития мозжечка, что привело к значительному снижению постнатальной массы мозга наряду с нарушениями в моторном контроле и поведении. Отдельное исследование показало значительное снижение пролиферации нервных стволовых клеток наряду с увеличением пролиферации астроцитов у Bmi нулевых мышей.
Альтернативная модель клеточной дифференцировки во время эмбриогенеза заключается в том, что позиционная информация основана на механической передаче сигналов цитоскелетом с использованием Волны эмбриональной дифференциации. Затем механический сигнал эпигенетически преобразуется через системы передачи сигнала (частью которых являются определенные молекулы, такие как Wnt), что приводит к дифференциальной экспрессии генов.
Таким образом, роль передачи сигналов в эпигенетическом контроле судьбы клеток у млекопитающих в значительной степени неизвестна, но существуют отдельные примеры, указывающие на вероятное существование других таких механизмов.
Известно, что взрослые стебли для выполнения задачи по регенерации различных тканей мигрируют из своих ниш, прикрепляются к новым внеклеточным матрицам (ЕСМ) и дифференцируются. Пластичность этих микроокружений уникальна для разных типов тканей. ВЦМ, окружающие мозг, мышцы и костные ткани, варьируются от мягких до жестких. Трансдукция стволовых клеток в эти типы клеток направляется не только сигналами хемокинов и передачей сигналов от клетки к клетке. Эластичность микроокружения также может влиять на дифференцировку мезенхимальных стволовых клеток (МСК, которые происходят в костном мозге). Когда МСК помещаются на субстраты такой же жесткости, как мозг, мышцы и костные внеклеточные клетки, МСК приобретают свойства соответствующих клеток. типы. Матричное зондирование требует, чтобы клетка прижалась к матрице в очаговых адгезиях, что запускает клеточный механопреобразователь для генерации сигнала, который сообщает, какая сила необходима для деформации матрицы. Чтобы определить ключевых игроков в спецификации происхождения на основе эластичности матрикса в MSC, были воспроизведены различные микросреды матрицы. Из этих экспериментов был сделан вывод, что фокальные адгезии МСК были клеточным механопреобразователем, воспринимающим различия в эластичности матрикса. Немышечные изоформы миозина IIa-c генерируют силы в клетке, которые приводят к передаче сигналов маркеров ранней приверженности. Nonmuscle myosin IIa generates the least force increasing to non-muscle myosin IIc. There are also factors in the cell that inhibit non-muscle myosin II, such as blebbistatin. This makes the cell effectively blind to the surrounding matrix. Researchers have obtained some success in inducing stem cell-like properties in HEK 239 cells by providing a soft matrix without the use of diffusing factors. The stem-cell properties appear to be linked to tension in the cells' actin network. One identified mechanism for matrix-induced differentiation is tension-induced proteins, which remodel chromatin in response to mechanical stretch. The RhoA pathway is also implicated in this process.