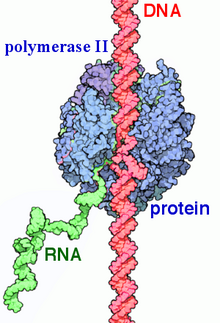
 Функция РНК-полимеразы II (транскрипция). Зеленый: новая цепь РНК, синтезированная ферментом
Функция РНК-полимеразы II (транскрипция). Зеленый: новая цепь РНК, синтезированная ферментом РНК-полимеразой II (RNAP II и Pol II ), представляет собой мультибелковый комплекс, который транскрибирует ДНК в предшественники информационной РНК (мРНК) и большей части малой ядерной РНК (мяРНК) и микроРНК. Это один из трех ферментов RNAP , обнаруженных в ядре эукариотических клеток. РНКП II, состоящий из 12 субъединиц, 550 кДа, является наиболее изученным типом РНК-полимеразы. Для связывания с промоторами гена и начала транскрипции требуется широкий спектр факторов транскрипции.
 РНК-полимераза II Saccharomyces cerevisiae, состоящая из всех 12 субъединиц.
РНК-полимераза II Saccharomyces cerevisiae, состоящая из всех 12 субъединиц. Ранние исследования предполагали наличие минимум двух РНКП: одна, которая синтезировала рРНК в ядрышке, а другая - другую. РНК в нуклеоплазме, часть ядра, но вне ядрышка. В 1969 году научные экспериментаторы Роберт Родер и Уильям Раттер окончательно открыли дополнительную РНКП, которая отвечает за транскрипцию некоторого вида РНК в нуклеоплазме. Обнаружение было получено с использованием ионообменной хроматографии с использованием шариков сефадекса, покрытых DEAE. Методика разделяла ферменты в порядке соответствующих элюций,, ΙΙ,, путем увеличения концентрации сульфата аммония. Ферменты были названы в соответствии с порядком элюирования: RNAP I, RNAP II, RNAP IΙI. Это открытие продемонстрировало, что в нуклеоплазме присутствует дополнительный фермент, который позволяет дифференцировать RNAP II и RNAP III.
 Эукариотическая РНК-полимераза II из Saccharomyces cerevisiae, PDB ID. Цветные субъединицы: RPB3 - оранжевый, RPB11 - желтый, RPB2 - пшеничный, RPB1 - красный, RPB6 - розовый, остальные 7 субъединиц окрашены в серый цвет.
Эукариотическая РНК-полимераза II из Saccharomyces cerevisiae, PDB ID. Цветные субъединицы: RPB3 - оранжевый, RPB11 - желтый, RPB2 - пшеничный, RPB1 - красный, RPB6 - розовый, остальные 7 субъединиц окрашены в серый цвет. эукариотическая ядерная РНК-полимераза II была сначала очищена с использованием транскрипционные анализы. Очищенный фермент обычно имеет 10–12 субъединиц (12 у человека и дрожжей) и не способен распознавать специфический промотор. Известно много взаимодействий субъединица-субъединица.
RPB3 задействован в сборке РНК-полимеразы II. Подкомплекс RPB2 и RPB3 появляется вскоре после синтеза субъединицы. Этот комплекс впоследствии взаимодействует с RPB1. RPB3, RPB5 и RPB7 взаимодействуют друг с другом, образуя гомодимеры, и вместе RPB3 и RPB5 могут связываться со всеми другие субъединицы RPB, кроме RPB9. Только RPB1 прочно связывается с RPB5. Субъединица RPB1 также связывается с RPB7, RPB10 и более слабо, но наиболее эффективно с RPB8. Как только RPB1 входит в комплекс, другие субъединицы, такие как RPB5 и RPB7, могут входить туда, где RPB5 связывается с RPB6 и RPB8, а RPB3 приносит RPB10, RPB 11 и RPB12. RPB4 и RPB9 могут войти, когда большая часть комплекса будет собрана. RPB4 образует комплекс с RPB7.
Ферменты могут катализировать до нескольких миллионов реакций в секунду. Нормы содержания ферментов зависят от условий раствора и концентрации субстрата. Как и другие ферменты, POLR2 имеет кривую насыщения и максимальную скорость (V max). Он имеет Km (концентрация субстрата, необходимая для половины V max) и k cat (количество молекул субстрата, обрабатываемых одним активным центром в секунду). Константа специфичности определяется как k cat /Km. Теоретический максимум для константы специфичности - это предел диффузии примерно от 10 до 10 (Ms), где каждое столкновение фермента с его субстратом приводит к катализу. У дрожжей мутация в домене триггерной петли самой большой субъединицы может изменить кинетику фермента.
Бактериальная РНК-полимераза, родственница РНК-полимеразы II, переключается между инактивированным и активированным состояниями путем перемещения назад и вперед по ДНК. Концентрации [NTP] eq = 10 мкМ GTP, 10 мкМ UTP, 5 мкМ ATP и 2,5 мкМ CTP, дают среднюю скорость элонгации, число оборота, ~ 1 п.н. (NTP) для бактериального RNAP, a родственник РНК-полимеразы II.
 РНК-полимераза II серый. Взаимодействие альфа-аманитина (красный).
РНК-полимераза II серый. Взаимодействие альфа-аманитина (красный). РНК-полимераза II претерпевает обширную котранскрипционную паузу во время элонгации транскрипции. Эта пауза особенно выражена в нуклеосомах и частично возникает из-за того, что полимераза входит в транскрипционно некомпетентное состояние обратного отслеживания. Продолжительность этих пауз колеблется от секунд до минут или дольше, и выходу из долгоживущих пауз могут способствовать факторы удлинения, такие как TFIIS. В свою очередь, скорость транскрипции влияет на то, вытесняются ли гистоны транскрибируемых нуклеосом из хроматина или повторно вставляются за транскрибирующую полимеразу.
РНК-полимераза II ингибируется α -Аманитин и другие аматоксины. α-Аманитин - очень ядовитое вещество, которое содержится во многих грибах. Грибной яд по-разному влияет на каждую из РНК-полимераз: I, II, III. RNAP I полностью не реагирует на вещество и будет функционировать нормально, в то время как RNAP III имеет умеренную чувствительность. Однако RNAP II полностью подавляется токсином. Альфа-аманитин ингибирует RNAP II за счет сильного взаимодействия в «воронке», «щели» и ключевом «мостиковом α-спиральном » участках субъединицы RPB-1.
Холофермент РНК-полимеразы II представляет собой форму эукариотической РНК-полимеразы II, которая рекрутируется на промоторы генов, кодирующих белок в живых клетках. Он состоит из РНК-полимеразы II, подмножества общих факторов транскрипции и регуляторных белков, известных как белки SRB.
Часть сборки холофермента называется преинициационным комплексом, потому что его сборка происходит на промоторе гена до инициирование транскрипции. Медиаторный комплекс действует как мост между РНК-полимеразой II и факторами транскрипции.
Это схема примерного механизма дрожжевых клеток, с помощью которого структура хроматина и посттрансляционная модификация гистона помогает регулировать и регистрировать транскрипцию генов с помощью РНК-полимеразы II.
Этот путь дает примеры регуляции в следующих точках транскрипции:
Обратите внимание, что это относится к различным стадиям процесса как к стадиям регуляции. Не было доказано, что они используются для регулирования, но весьма вероятно, что это так.
Промоторы элонгации Pol II РНК можно разделить на 3 класса.
С-конец RPB1 присоединяется для образования С-концевого домена (CTD). Карбоксиконцевой домен РНК-полимеразы II обычно состоит из 52 повторов последовательности Tyr-Ser-Pro-Thr-Ser-Pro-Ser. Домен простирается от ядра фермента RNAPII до выходного канала, это размещение эффективно из-за индукции «реакций процессинга РНК посредством прямого или косвенного взаимодействия с компонентами механизма процессинга РНК». Домен CTD не существует в РНК-полимеразе I или РНК-полимеразе III. CTD РНК-полимеразы был впервые обнаружен в лаборатории К. Дж. Инглса в Университете Торонто, а также в лаборатории Дж. Кордена в Университете Джона Хопкинса во время процессов секвенирования ДНК, кодирующей субъединицу RPB1 РНК-полимеразы дрожжей и мышей соответственно. Другие белки часто связывают С-концевой домен РНК-полимеразы, чтобы активировать полимеразную активность. Это белковый домен, который участвует в инициации транскрипции, кэппинге РНК-транскрипта и прикреплении к сплайсосоме для сплайсинга РНК.
РНК-полимераза II существует в двух нефосфорилированных и фосфорилированных формах, IIA и IIO соответственно. Переход между двумя формами способствует различным функциям транскрипции. фосфорилирование CTD катализируется одним из шести общих факторов транскрипции, TFIIH. TFIIH служит двум целям: первая - раскручивать ДНК в стартовом сайте транскрипции, а вторая - фосфорилировать. Полимераза формы IIA присоединяется к преинициативному комплексу, это предполагается, потому что IIA связывается с более высокой аффинностью с TBP (TATA-бокс-связывающий белок ), субъединицей общего фактора транскрипции TFIID, чем форма полимеразы IIO. Полимераза формы IIO способствует удлинению цепи РНК. Метод инициации элонгации осуществляется путем фосфорилирования серина в положении 5 (Ser5) через TFIIH. Вновь фосфорилированный Ser5 рекрутирует ферменты для закрытия 5'-конца вновь синтезированной РНК и «3 'процессинговых факторов до сайтов поли (A) ». Как только второй серин фосфорилируется, Ser2, элонгация активируется. Для прекращения удлинения должно произойти дефосфорилирование. Как только домен полностью дефосфорилируется, фермент RNAP II «рециркулирует» и катализирует тот же процесс с другим сайтом инициации.
Окислительное повреждение ДНК может блокировать РНК-полимеразу II транскрипция и вызовет разрывы цепи. Был описан процесс рекомбинации, связанный с транскрипцией, который может защитить от повреждения ДНК. Во время стадий G1 / G0 клеточного цикла клетки демонстрируют сборку гомологичных факторов рекомбинации на двухцепочечных разрывах в активно транскрибируемых областях. Похоже, что транскрипция связана с репарацией двухцепочечных разрывов ДНК с помощью шаблонной гомологичной рекомбинации РНК. Этот процесс репарации эффективно и точно воссоединяет двухцепочечные разрывы в генах, активно транскрибируемых РНК-полимеразой II.
(Wayback Machine копия)