 | |
| Имена | |
|---|---|
| Другие наименования 2-амино-5-гуанидинопентановая кислота | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) |
|
| 3DMet | |
| Ссылка Beilstein | 1725411, 1725412 R, 1725413 S |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.738 |
| Номер ЕС |
|
| Справка Гмелина | 364938 R |
| IUPHAR / BPS | |
| KEGG | |
| MeSH | Аргинин |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C6H14N4O2 |
| Молярная масса | 174,204 г · моль |
| Внешний вид | Белые кристаллы |
| Запах | Без запаха |
| Точка плавления | 260 ° C; 500 ° F; 533 K |
| Температура кипения | 368 ° C (694 ° F; 641 K) |
| Растворимость в воде | 14,87 г / 100 мл (20 ° C) |
| Растворимость | мало растворим в этанол. нерастворимый в этиловом эфире |
| log P | -1,652 |
| Кислотность (pK a) | 2,18 (карбоксил), 9,09 (амино), 13,2 (гуанидино) |
| Термохимия | |
| Теплоемкость (C) | 232,8 Дж · К · моль (при 23,7 ° C) |
| Стандартная молярная. энтропия (S 298) | 250,6 ДжК моль |
| Стандартная энтальпия образования. (ΔfH298) | −624,9–−622,3 кДж моль |
| Стандартная энтальпия. горения (ΔcH298) | −3,7396–−3,7370 MJ mol |
| Фармакология | |
| Код ATC | B05XB01 (ВОЗ ) S |
| Опасности | |
| Паспорт безопасности | См.: страница данных. www.sigmaaldrich. com |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| Краткая характеристика опасности GHS | H319 |
| Меры предосторожности GHS | P305 + 351 + 338 |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 5110 мг / кг (крыса, перорально) |
| Родственные соединения | |
| Родственные алкановые кислоты | |
| Родственные соединения | |
| Страница дополнительных данных | |
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая постоянная (εr) и т. Д. |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ |
| Спектральные данные | UV, IR, ЯМР, MS |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в информационном окне | |
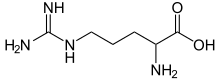
Аргинин, также известный как l-аргинин (символ Arg или R ), представляет собой α- аминокислоту, которая используется в биосинтезе белков. Он содержит группу α- амино, группу α- карбоновой кислоты и боковую цепь, состоящую из 3-углеродной алифатической прямой цепи, оканчивающейся знаком гуанидино группа. При физиологическом pH карбоновая кислота депротонирована (-COO), аминогруппа протонирована (-NH 3), а гуанидиногруппа также протонирована с образованием гуанидиниевой формы (-C- (NH 2)2), превращая аргинин в заряженную алифатическую аминокислоту. Это предшественник для биосинтеза оксида азота. Он кодируется с помощью кодоны CGU, CGC, CGA, CGG, AGA и AGG.
Аргинин классифицируется как полусущественная или условно незаменимая аминокислота, в зависимости от стадии развития и состояния здоровья Недоношенные дети не могут синтезировать или вырабатывать аргинин внутри организма, что делает эту аминокислоту необходимой для них. Большинству здоровых людей не нужно добавлять аргинин, поскольку он является компонентом всех белковосодержащих продуктов и может синтезироваться в тело из глутамина через цитруллин.
Аргинин был впервые выделен в 1886 году из проростков желтого люпина в 1886 году немецким химиком Эрнстом Шульце. и его помощник Эрнст Штайгер. Он назвал его от греческого ágeryros (ἄργυρος), что означает «серебро» из-за серебристо-белого цвета кристаллов нитрата аргинина. В 1897 году Шульце и Эрнст Винтерштейн (1865–1949) определили структуру аргинина. Шульце и Винтерстайн синтезировали аргинин из орнитина и цианамида в 1899 году, но некоторые сомнения относительно структуры аргинина сохранялись до синтеза Соренсена 1910 года.
Традиционно его получают гидролизом различных дешевых источников белка, таких как желатин. Его получают в промышленных масштабах путем ферментации. Таким образом, можно получить 25-35 г / литр, используя глюкозу в качестве источника углерода.
Аргинин является условно незаменимой аминокислотой для людей и грызунов, поскольку может потребуются в зависимости от состояния здоровья или жизненного цикла человека. Например, в то время как здоровые взрослые люди могут обеспечивать свою потребность в аргинине, незрелые и быстрорастущие люди нуждаются в аргинине в своем рационе, и это также важно при физиологическом стрессе, например, во время восстановления после ожогов, травм и сепсиса, или когда тонкий кишечник и почки, которые являются основными участками биосинтеза аргинина, были повреждены. Однако это незаменимая аминокислота для птиц, поскольку у них нет цикла мочевины. Для некоторых плотоядных животных, например кошек, собак и хорьков, аргинин необходим, потому что после еды их высокоэффективный катаболизм белков производит большое количество аммиака, который необходимо перерабатывать через цикл мочевины, и если присутствует недостаточное количество аргинина, то токсичность аммиака может быть смертельной. На практике это не проблема, потому что мясо содержит достаточное количество аргинина, чтобы избежать этой ситуации.
Животные источники аргинина включают мясо, молочные продукты и яйца, а растительные источники включают семена всех типов, например зерна, бобы и орехи.
Аргинин синтезируется из цитруллина в метаболизме аргинина и пролина за счет последовательного действия цитозольных ферментов аргининосукцинатсинтетаза и аргининосукцинатлиаза. Это энергетически затратный процесс, потому что для каждой синтезированной молекулы аргининосукцината, одна молекула аденозинтрифосфата (АТФ) гидролизуется до аденозинмонофосфата (AMP), потребляя два эквивалента АТФ.
Цитруллин может быть получен из нескольких источников:
Пути, связывающие аргинин, глутамин и пролин, являются двунаправленными. Таким образом, чистое использование или производство этих аминокислот сильно зависит от типа клетки и стадии развития.
 Биосинтез аргинина.
Биосинтез аргинина. В целом синтез аргинина происходит в основном через кишечно-почечную ось: эпителиальные клетки тонкой кишки производят цитруллин, в основном из глутамина и глутамата, которые переносятся с кровотоком в клетки проксимальных канальцев почки, которые извлекают цитруллин из кровообращение и преобразовать его в аргинин, который возвращается в обращение. Это означает, что нарушение функции тонкого кишечника или почек может снизить синтез аргинина, увеличивая потребность в питании.
Синтез аргинина из цитруллина также происходит на низком уровне во многих других клетках, и способность клеток к синтезу аргинина может быть заметно увеличена в условиях, которые увеличивают продукцию индуцибельной NOS. Это позволяет цитруллину, побочному продукту катализированного NOS производства оксида азота, быть рециклированным в аргинин по пути, известному как путь цитруллин-NO или аргинин-цитруллин. Это демонстрируется тем фактом, что во многих типах клеток синтез NO может в некоторой степени поддерживаться цитруллином, а не только аргинином. Однако эта рециркуляция не является количественной, поскольку цитруллин накапливается в NO-продуцирующих клетках вместе с нитратом и нитритом, стабильными конечными продуктами распада NO.
Аргинин играет важную роль в делении клеток, заживлении ран, удалении аммиака из организма, иммунной функции и высвобождении гормонов.. Он является предшественником синтеза оксида азота (NO), что делает его важным в регуляции артериального давления.
Боковая цепь аргинина амфипатична., поскольку при физиологическом pH он содержит положительно заряженную гуанидиниевую группу, которая является высокополярной, на конце гидрофобной алифатической углеводородной цепи. Поскольку глобулярные белки имеют гидрофобные внутренние части и гидрофильные поверхности, аргинин обычно находится снаружи белка, где гидрофильная головная группа может взаимодействовать с полярным окружением, например, принимая участие в водородных связях и солевые мостики. По этой причине он часто находится на границе раздела двух белков. Алифатическая часть боковой цепи иногда остается ниже поверхности белка.
Остатки аргинина в белках могут быть уничтожены ферментами PAD с образованием цитруллина в процессе посттрансляционной модификации, который называется цитруллинирование. Это важно для развития плода, является частью нормального иммунного процесса, а также контролирует экспрессию генов, но также важно при аутоиммунных заболеваниях. Другая посттрансляционная модификация аргинина включает метилирование белком метилтрансферазой.
Аргинин является непосредственным предшественником NO, важной сигнальной молекулы, которая может действовать как второй мессенджер, а также межклеточный мессенджер, который регулирует вазодилатацию, а также играет роль в реакции иммунной системы на инфекцию.
Аргинин также является предшественником мочевины, орнитина и агматина ; необходим для синтеза креатина ; и также может быть использован для синтеза полиаминов (в основном через орнитин и в меньшей степени через агматин, цитруллин и глутамат). Наличие асимметричного диметиларгинина (ADMA), a близкий родственник, тормозит реакцию оксида азота; следовательно, ADMA считается маркером сосудистого заболевания, так же как L -аргинин считается признаком здорового эндотелия.
 Делокализация заряда в гуанидиниевая группа 1-аргинина
Делокализация заряда в гуанидиниевая группа 1-аргинина Аминокислота боковая цепь аргинина состоит из 3-углеродной алифатической прямой цепи, дистальной конец которой блокирован группой гуанидиния, которая имеет pKa 12,48, и поэтому всегда протонирована и положительно заряжена при физиологическом pH. Из-за конъюгации между двойной связью и неподеленными парами азота, положительный заряд делокализован, что делает возможным образование множественных водородных связей.
Аргинин, вводимый внутривенно, используется в тестах на стимуляцию гормона роста, поскольку он стимулирует секрецию гормона роста. Обзор клинических испытаний показал, что пероральный аргинин увеличивает выработку гормона роста, но снижает секрецию гормона роста, которая обычно связана с физическими упражнениями. Однако в более недавнем исследовании сообщалось, что, хотя пероральный аргинин повышал уровни L -аргинина в плазме, он не вызывал повышения уровня гормона роста.
A метаанализ показал, что L -аргинин снижает артериальное давление с объединенными оценками в 5,4 мм рт. ст. для систолического артериального давления и 2,7 мм рт. ст. для диастолического артериального давления.
Добавление l-аргинина снижает диастолическое артериальное давление и удлинение беременности для женщин с гестационной гипертензией, включая женщин с высоким артериальным давлением в рамках преэклампсии. Он не снизил систолическое артериальное давление и не улучшил вес при рождении.
Как жидкостная хроматография, так и жидкостная хроматография / масс-спектрометрические анализы показали, что ткань мозга умерших шизофреников показывает измененный метаболизм аргинина. Анализы также подтвердили значительно сниженные уровни гамма-аминомасляной кислоты (ГАМК), но повышенную концентрацию агматина и соотношение глутамат / ГАМК в случаях шизофрении. Регрессионный анализ показал положительную корреляцию между активностью аргиназы и возрастом начала заболевания, а также между уровнем L-орнитина и продолжительностью заболевания. Более того, кластерный анализ показал, что L-аргинин и его основные метаболиты L-цитруллин, L-орнитин и агматин образуют отдельные группы, которые были изменены в группе шизофрении. Несмотря на это, биологические основы шизофрении все еще плохо изучены, ряд факторов, таких как гиперфункция дофамина, глутаматергическая гипофункция, ГАМКергический дефицит, дисфункция холинергической системы, стрессовая уязвимость и нарушения нервного развития, были связаны с этиологией и / или патофизиологией
L-аргинин признан безопасным (статус GRAS) при потреблении до 20 граммов в день.
| Wikimedia У Commons есть средства массовой информации, связанные с аргинином. |